ELEKTROTERAPIA
Podstawowe pojęcia związane z elektrycznością
Elektryczność jest jedną z podstawowych form energii w naukach fizyki i może również powodować znaczne efekty w tkankach biologicznych. Ładunek elektryczny jest podstawową właściwością materii, która jest podstawą siły elektromagnetycznej. Istnieją dwa rodzaje ładunków: pozytywny i negatywny. Na najprostszym poziomie ładunki są przenoszone przez elektrony (ujemny) i protony (dodatni) atomu. Ładunki o takim samym znaku odychają się, a o przeciwnym przyciągaja się. Ładunek może przemieszczać się z jednego obiektu do innego.
W przyrodzie obowiązuje zasada zachowania ładunku, niepodzielny jest ładunek elementarny (nośnik elektron i proton) o wartości e=1,602 x 10-19C. W układzie izolowanym elektrycznie całkowita suma ładunków elektrycznych nie może ulec zmianie.
Koncepcja ładunku elektrycznego nie ogranicza się do elektronowego poziomu materii. Jeżeli atom straci elektrony, bez zmiany ilości protonów w jądrze, staje się naładowany dodatnio (kation). Jeżeli atom pozyska elektrony staje się naładowany ujemnie (anion). Atomy pierwiastków, które mają deficyt lub nadmiar elektronów nazywają się jonami.
Siła elektryczna naładowanych cząsteczek jest przenoszona do innych naładowanych cząsteczek poprzez pole elektryczne, które tworzy każdy ładunek wokół siebie.
Napięcie jest to zmiana elektrycznej energii potencjalnej pomiędzy dwoma punktami w polu elektrycznym przez jednostkę ładunku (synomin: różnica potencjału elektrycznego). Jednostka napięcia jest volt (V). 1 volt równa się 1 J (joule) zmienionemu w energię przez ładunek 1 culomba. 1V=1J/1C
Jeżeli istnieje różnica potencjałów, naładowane cząsteczki dążą do ruchu w materii. Substancje, w których ładunki elektryczne umieszczone w polu elektrycznym mają łatwość ruchu, nazywają się przewodnikami.
Tkanki człowieka zawierające naładowane cząsteczki w roztworze (jony sodu, potasu, chloru) są dobrymi przewodnikami, ponieważ jony wykonują wolne ruchy w czasie działania siły elektromotorycznej. Zdolność ruchu jonów w tkanach człowieka nie jest jednakowa we wszystkich tkankach. Mięśnie, nerwy, naczynia krwionośne są dobrymi przewodnikami, natomiast skóra i tłuszcz słabymi.
Izolatory są to substancje, które w przeciwieństwie do przewodników, nie pozwalają na wolne ruchy jonów i elektronów.
Ruch ładunków elektrycznych w przewodniku w reakcji na działanie pola elektrycznego zwany jest prądem. Przewodzenie ładunku elektrycznego przez materię z jednego punktu do drugiego jest transferem energii, która powoduje fizjologiczne zmiany w czasie klinicznego zastosowania stymulacji elektrycznej. Nośnikami prądu są elektrony, jony dodatnie lub ujemne.
Prąd płynie, jeżeli pomiędzy punktami połączonymi przewodnikiem istnieje różnica potencjałów. Prąd jest ścisle definiowany jako ilość ładunku (q), jaki przepłynął poprzez poprzeczny przekrój przewodnika w jednostce czasu. I=Δq/Δt Jednostką natężenia jest 1A (amper)=1C/1s.
Ilość płynącego ladunku jest nie tylko określona przez wielkość napięcia, ale również poprzez relatywną łatwość, z jaką jony i elektrony mogą poruszać się w przewodniku. Ta właściwość przewodnika określana jest jako rezystencja, która określa opór dla ruchu naładowanych cząsteczek w przewodniku. Jednostka oporu jest ohm (Ω). Związek między napięciem a opornością określający wielkość prądu jest wyrażony w prawie Ohma: I=V/R lub V=IxR
Pojemność elektryczna jest właściwością sytemu przewodników i izolatorów określającą zdolność systemu do przechowywania ładunku.
Na prądy wytwarzane w tkankach biologicznych ma wpływ nie tylko oporność tkanek, ale również ich pojemność elektryczna. Pojemność elektryczna przewodnika równa się stosunkowi ładunku zgromadzonego na danym przewodniku do potencjału jaki ten ładunek wytwarza i wyrażona jest w faradach (F). 1F=1C/1V.
Określenie impendencja opisuje opór dla prądów dwukierunkowych, podobnie jak rezystencja dla prądów jednokierunkowych. Impendecja bierze pod uwagę zwrówno pojemność elektryczną, jak i rezystencję jako przeciwstawianie się ruchowi naładowanych cząsteczek.
Tkanki ludzkie tworzą system oporników i kondesatorów, więc w czasie działania klinicznej elektrostymulacji bardziej odpowiednie jest wyrażanie oporności jako impendencja. Zależy ona od właściwości pojemności elektrycznej tkanek biologicznych, a jej wielkość od częstotliwości zastosowanego prądu. Im wyższa częstotliwość prądu, tym niższa impendencja w tkankach.
Trapeutyczne zastosowanie prądu elektrycznego
Stymulacja za pomocą prądu elektrycznego stosowana jest do badania i leczenia tkanki nerwowej i mięśniowej. Stosowana jest powszechnie w terapii fizykalnej do leczenia różnych stanów patologicznych tkanki nerwowo-mięśniowej, polepszania lokalnego krążenia i zdrowienia tkanek, zmniejszenia bólu, zwiększania zakresu ruchu i siły mięśniowej. Wiele różnorodnych czynników fizykalnych stosowanych w terapii charakteryzuje się bardzo ważną wspólną cechę, czyli zdolnością do przyspieszania zdrowienia uszkodzonych tkanek, choć efekt ten powstaje dzięki różnym mechanizmom.
Podstawowe efekty uzyskiwane w tkankach podczas działania energii elektrycznej obejmują zmiany chemiczne, pobudzanie skurczu mięśnia i zmianę percepcji bólu, grzanie tkanek przez działanie prądu wielkiej częstotliwości (zmiany są na tyle szybkie, że tkanka pobudliwa nie jest w stanie zareagować na nie). Terapia prądem elektrycznym pobudza zdrowienie przez wykorzystanie skutków bioelektrycznych.
Cele elektroterapii: działanie na objawy wtórne choroby lub urazu w celu łagodzenia odczuć bólowych, poprawy ukrwienia, zmniejszenia napięcia mięśni szkieletowych poprzecznie prążkowanych i gładkich, pobudzenia skurczu mięśni osłabionych i odnerwionych oraz osiągnięcia korzystnego punktu wyjścia do rozpoczęcia zabiegów fizjoterapeutycznych.
Bioelektryczność
W organizmach żywych bardzo ważną funkcję spełnia czynność elektryczna komórek, zwana bioelektrycznością. Czynność ta jest odpowiedzialna za pobudliwość komórek nerwowych i mięśniowych. Za transport ładunku elektrycznego odpowiedzialna jest w zasadzie różnica potencjałów elektrycznych. Ładunek elektryczny może być jednak przenoszony łącznie z substancją (np. za pośrednictwem jonów).
Ciało ludzkie jest bogatym źródłem bioelektryczności zawierającym różne źródła i typy elektrycznych potencjałów. Można rozróżnić co najmniej trzy źródła elektrycznego potencjału określane jako: 1. potencjał membranowy (błony komórkowej), 2. potencjał uszkodzenia, 3. potencjał związany z obciążeniem.
Potencjał błony komórkowej jest najłatwiejszym do zarejestrowania bioelektrycznym sygnałem naszego ciała. Najlepszym przykładem jest EKG (prądy serca), EEG (prądy mózgu), EMG (kombinacja elektrycznych prądów w nerwach i mięśniach). Środowisko wewnątrz i zewnątrz komórkowe zawiera cząsteczki naładowane elektrycznie. Zewnętrzna błona oddziela wewnętrzne struktury i zawartość komórki od zewnętrznego otoczenia. Z drugiej strony błona komórkowa posiada potencjał elektryczny, wytworzony przez różnicę stężenia jonów. Najważniejsze elektrolity to Na+, K+. Na+ jest składnikiem płynów zewnątrz komórkowych, K+ wewnątrz komórkowych. Stężenie sodu Na+ jest około 10 razy wyższe w płynie zewnątrz komórkowym niż w jego wnętrzu, a stężenie potasu K+ jest 30 razy wyższe w cytoplazmie neuronu niż w jego otoczeniu. Fakt ten powoduje spolaryzowanie elektryczne (potencjał spoczynkowy) błony komórkowej i pobudliwość elektryczną stanów czynnych np. w komórkach nerwowych. Włókno nerwowe w stanie spoczynku ma różnicę potencjałów błony komórkowej wynoszącą ok.70V, w środku komórka ma negatywny ładunek, na zewnątrz pozytywny.
Impuls nerwowy jest zmianą elektrochemiczną, która rozprzestrzenia się wzdłuż włókna. Depolaryzacja błony komórkowej może być spowodowana bodźcem elektrycznym. Impuls nerwowy płynie w dwóch kierunkach, ale efekt powstaje tylko w jednym (kierunek ortodromowy), w przeciwnym kierunku jest blokowany przez synapsę. Sytuacja taka powstaje ponieważ bodziec elektryczny wyzwala ruch jonów przez tkankę, stąd też przez błonę komórkową. Musi powstać odpowiednia różnica- poza próg wartości ok. 10mV- wyzwalająca impuls nerwowy. Potencjał czynnościowy pojawia się zgodnie z prawem „wszystko albo nic”. Oznacza to, że gdy na skutek stymulacji zmiany elektrotoniczne osiągną w neuronie poziom depolaryzacji krytycznej i powstanie potencjał iglicowy, dalsze pobudzenie nie zmienia w danych warunkach amplitudy powstałego potencjału. Do powstania tej sytuacji konieczna jest minimalna ilość ładunku elektrycznego, aby wyzwolić impuls nerwowy tzn. pewna mała wartość natężenia prądu dla relatywnie długiego impulsu, bądź też duże natężenia prądu dla krótkiego impulsu. Minimalna wartość prądu o długim czasie impulsu niezbędna do wywołania w danych warunkach impulsu nerwowego (reakcja) zwana jest reobazą. Myśl ta jest zilustrowana przez krzywą I\t.
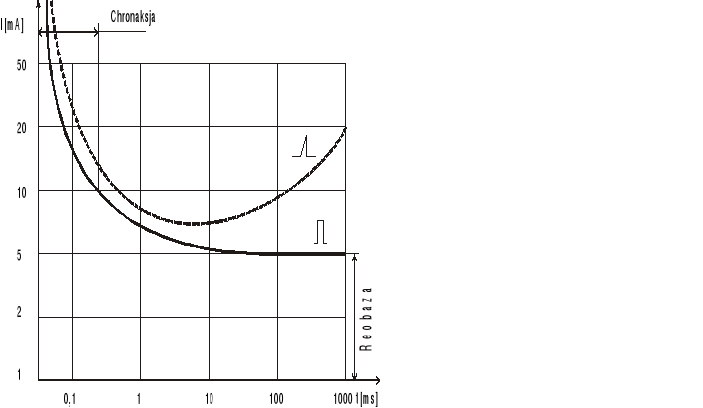
Rysunek 1. Krzywa I/t
Ruch naładowanych cząsteczek powstaje we wszystkich komórkach ciała i jest uważany za bardzo ważną cechę żywych komórek. Ciągły ruch zjonizowanych cząsteczek przez błonę komórkową znany jest jako prąd bioelektryczny (bardzo słabiutki). Wewnątrz komórek znajduje się wiele organelli, specjalnych struktur, które utrzymują funkcje życiowe komórek. Większość z tych organelli ma własne błony, które je oddzielają od innych wewnątrzkomórkowych składników. Prąd bioelektryczny powstaje również przez błonę organelli. Prąd bioelektryczny powstaje w biologicznym zakresie częstotliwości od 0.1 do 250 cyklów na sekundę (Hz).
Potencjał uszkodzenia. Mechanizm produkujący potencjał membranowy i prąd bioelektryczny omówiony wcześniej, jest również źródłem trwałego potencjału, zwanego potencjałem uszkodzenia, gdy normalny potencjał błonowy zostaje przerwany. Kiedy ciało jest w stanie dobrego zdrowia, w naszym organizmie isnieje normalna aktywność hormonalną i bioelektryczną. W razie choroby bądź urazu, dotknięte tkanki oczekują naprawy uszkodzonych struktur. Proces naprawy może być rozpatrywany jako rozszerzenie normalnej aktywności zajętych tkanek. Nowy materiał musi dostać się uszkodzonego obszaru, substancje niepożądane muszą być usunięte, wtedy rozpocznie się resynteza i regeneracja. Wszystkie te procesy są bezpośrednio związane z ruchem naładowanych cząsteczek i z obecnością prądu bioelektrycznego. Zmiana elektrycznego profilu może potrzebować „korekty”, aby proces naprawczy był skuteczny. Niezależnie od obecności potencjału uszkadzającego, tło elektromagnetyczne zajętych tkanek również nie jest prawidłowe. Istnieje możliwość popierania procesów naprawy w dwojaki sposób, to znaczy dzięki zastosowaniu terapeutycznego pola elektromagnetycznego lub terapeutycznych prądów elektrycznych.
Potencjał powstający w wyniku obciążenia. Mechaniczny wysiłek i deformacja ma zdolność wytworzenia zmian w potencjale elektrycznym związanym z tkankami niepobudliwymi takimi jak: kości, chrząstki, tkanka kolagenowa. Potencjał ten ma inne źródło aktywności błony komórkowej niż omówione poprzednio. W rzeczywistości są one niezależne w „żywym” systemie komórek i są cechą aktualnej fizycznej struktury tkanki. Najbardziej znany jest potencjał związany z działaniem siły na kość. Potencjały są wytwarzane przez efekt piezoelektryczny jako funkcja fizycznej struktury tkanki. Potencjały te produkowane są w tkankach żywych i martwych. Powstają, gdy na tkanki działa zmienne, mechaniczne obciążenie. Podobne potencjały powstają w czasie działania ciepła na tkanki (skutek). W dodatku efekt piezoelektryczny powstaje w kilku tkankach w wyniku działania pola elektrycznego.
Tkanki naszego organizmu ze względu na reagowanie na bodziec zewnętrzny dzielą się na dwie grupy: tkanki pobudliwe i niepobudliwe.
Do tkanek pobudliwych należą: komórki nerwowe wszystkich typów, aksony nerwów wszystkich typów, włókna ruchowe, autonomiczne włókna nerwowe, włókna mięśnia sercowego, komórka organów jamy brzusznej, komórki produkujące wydzieliny gruczołów. Do tkanek niepobudliwych należą: kości, chrząstka, tkanka kolagenowa, ścięgna, więzadła. Kiedy tkanka pobudliwa jest stymulowana zwykle obserwowalna jest reakcja pacjenta. Reakcja może być czuciowa, ruchowa, wydzielnicza lub gruczołowa. Reakcja czuciowa tkanki pobudliwej zależy od różnych czynników związanych z charakterystyką bodźca elektrycznego. Do czynników wrunkujących reakcję tkanek pobudliwych na prąd zalicza się nastepujące parametry:
Natężenie: niskie natężenie powoduje delikatne mrowienie, zwiększanie natężenia mocniejsze mrowienie, nawet bolesne odczucia. Włókna bólowe pobudzane są wyższym natężeniem, gdyż próg pobudzenia tych włókien jest wyższy niż pozostałych włókien. Natężenie mierzone jest w mA ( lub μA) i określa aktualną ilość elektryczności płynącą przez tkanki, prąd średni (ilość na jednostkę czasu) lub szczytowy (najwyższe natężenie w czasie trwania każdego impulsu).
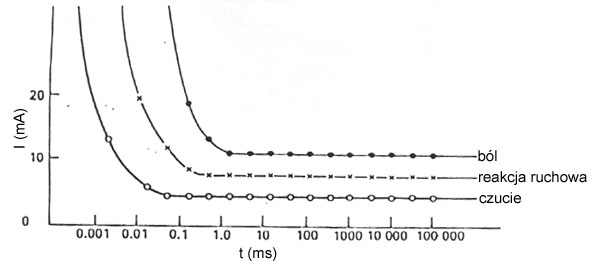
Rysunek 2. Wykresy krzywej i/t dla różnych włókien mięśniowych.
Czas trwania impulsu, jest to długość czasu w jakim prąd przepływa przez tkankę pacjenta. Mierzony jest w milisekundach lub w mikrosekundach. Im dłuższy czas impulsu tym mniejszy komfort odczuć pacjenta.
Częstotliwość określa ilość impulsów na sekundę, zwykle ilość cyklów na sekundę (Hz). Nerwy i mięśnie mają różnorodną wrażliwość na bodziec elektryczny. Tkanka nerwowa jest bardziej wrażliwa na bodziec elektryczny niż tkanka mięśniowa. Z tego względu aktywność ruchowa i wydzielnicza powstaje w wyniku stymulacji elektrycznej nerwów zaopatrujących te tkanki. Nerwy maja różnorodną charakterystykę fizyczną i czynnościową. Głównym efektem działania bodźców o określonej częstotliwości będzie różnorodne stymulowanie różnych nerwów w danej populacji. Częstotliwość około 100Hz i wyższa stymuluje grube nerwy czuciowe bardziej niż cienkie, natomiast częstotliwość poniżej 30 Hz cienkie, bólowe i autonomiczne.
Kształt impulsu: trójkątny, prostokątny, sinusoidalny, trapezowy.
Polaryzacja. Każdy bodziec elektryczny dostarcza do tkanki ładunek pozytywny lub negatywny w zależności od ładunku jaki posiada. Negatywny → nadmiar elektronów, pozytywny → brak elektronów po poszczególnymi elektrodami. Bodziec w postaci impulsu elektrycznego ciągle wytwarza pozytywne i negatywne ładunki (galwanizacja) lub składa się z impulsów o dodatnich lub ujemnych ładunkach (fazy w prądzie przemiennym). Efekt polaryzacji określa skutek w tkankach pod elektrodami: katoda: tendencja do depolaryzacji, martwica rozpływna, łagodne przekrwienie, substancje zasadowe. Anoda: hyperpolaryzacja, stwardnienie tkanek, łagodne przekrwienie, substancje kwasowe.
Kierunek przepływu: przyjęto ruch ładunków dodatnich do ujemnych. Po odkryciu elektronów uznano iż prąd płynie od bieguna ujemnego do dodatniego.
STYMULACJA NERWÓW I MIĘŚNI
Wszystkie stymulatory tkanki nerwowej (oprócz implantowanych) są w rzeczywistości przezskórnymi elektrycznymi stymulatorami nerwów (TENS), ale termin ten zastał zarezerwowany dla aplikacji przez zminiaturyzowane aparaty zasilane bateriami, a stosowane do stymulacji nerwów czuciowych w kontroli bólu. Takie nazwy jak prąd faradyczny, sinusoidalny, diadynamiczny i akomodacyjny używano do wyszczególnienia pewnych kształtów pulsów i wskazania określonych skutków ich działania. Bardzo ważne jest zrozumienie skutków działania elektrycznych ładunków na tkanki. Zależą one od zakresu zmian impulsu:
Jeżeli nie ma zmian, lub są one bardzo powolne i prąd płynie w jednym kierunku, miarowy przepływ jonów do i z tkanek powoduje zmiany chemiczne w miejscu połączenia elektrody z tkanką.
Jeżeli zakres zmian jest szybszy i impuls wystarczająco długi równowaga jonowa pobudliwej błony komórkowej jest zaburzona wywołując stymulację nerwów i mięśni. Jeżeli prąd ma jeden kierunek przepływu, jego działanie obejmuje zmiany chemiczne, jeśli jest to prąd równo zmienny, zmiany chemiczne nie występują, gdyż są anulowane, w czasie, gdy prąd płynie w przeciwnym kierunku.
Jeżeli zakres zmian jest bardzo szybki, nie ma odpowiedniej ilości czasu, aby powstało pobudzenie błony komórkowej. Tak duży prąd stosowany jest do wytwarzania ciepła w tkankach.
Powyższe zmiany zależą oczywiście od natężenia prądu, im wyższe natężenie tym większe skutki działania. Natężenie determinuje również siłę pojedynczego pulsu, aby była ona wystarczająca do wywołania impulsu nerwowego: krótki impuls- niskie natężenia→ nie ma reakcji; krótki impuls- wysokie natężenie→występuje reakcja.
Pojedyncze impulsy mogą być opisane przez:
czas trwania impulsu w sec, ms, μs
natężenia w mA, V
kształt- zakres wzrostu i spadku natężenia, czyli jak natężenia zmienia się w czasie.
Określenie szczyt natężenia prądu odnosi się do najwyższego prądu, który powstaje w czasie impulsu. Jeżeli weźmiemy pod uwagę serie impulsów, to ich ocena może być wyrażona w ilości impulsów na sekundę lub jako częstotliwość impulsów w Hz (jednostka czasu przez okres). Uwagi te dotyczą prądu o jednym kierunku przepływu.
Wiele prądów stosowanych terapeutycznie jest prądami dwufazowymi. Prąd przechodzi najpierw w jednym kierunku, potem w przeciwnym. Impulsy mogą mieć różnorodny kształt, czas przerwy, formę ciągłą lub wybuchową.
RODZAJE PRĄDÓW STOSOWANYCH W ELEKTROTERAPII
Prąd stały galwaniczny
Przerywany prąd stały: daję serie impulsów lub faz, o pewnym kształcie, powtarzający się z pewną częstotliwością. Ustalony czas trwania impulsu, kształt i częstotliwość mają określone nazwy.
Długi czas trwania impulsu (1ms lub więcej)
impuls prostokątny: są to impulsy o czasie trwania między 1ms a 600ms oddzielone przerwą od 1ms do kilku sekund, mogą stymulować nerwy ruchowe i mogą być stosowane do stymulacji odnerwionych mięśni.
impulsy akomodacyjne: trójkątne, trapezoidalne, wolnowzrastające- synonimy impulsów eksponencjalnych. Relatywnie długi czas trwania impulsu (600 do 1000ms) czas przerwy od pół do kilku sekund. Stosowany do selektywnej stymulacji tkanki mięśniowej (różnica między akomodacją mięśni i nerwów).
Krótki czas trwania pulsu (1ms i mniej)
Prądy typu faradycznego: impuls o czasie 0,1-1ms, powtarzany z częstotliwością 30-100Hz. Przy częstotliwości 100Hz cykl wynosi 10ms, wtedy czas pulsu=1ms, a czas przerwy=9ms. Impulsy te mogą mieć jeden kierunek przepływu (przerywany prąd stały o krótkim czasie pulsu) lub mogą być również dwufazowe. Oryginalnie prąd powstawał w zwoju faradycznym, nierównozmienny, nierówny w kształcie→skurcze tężcowe→faradyzm.
TENS-impulsy jednofazowe lub w większości dwufazowe, symetryczne i asymetryczne w kształcie, czas pulsu 0,01-0,3ms, częstotliwość 2-200Hz , najczęściej stosowana do 100Hz.
Prądy równo zmienne (przemiennie zmienne)
Prądy sinusoidalne: fala w kształcie sinusoidy, przy f=50Hz→100 impulsów, fazy po 10ms każda, 50 w jednym kierunku i 50 w drugim kierunku. Stymuluje nerwy ruchowe i czuciowe (napięcie prądu stosowanego terapeutycznie ok. 80V).
Prądy diadynamiczne: wyprostowany, sinusoidalnie zmienny prąd of=50Hz lub 100Hz o czasie impulsu 10ms oraz ich kombinacje. Stosowany głównie w Europie.
Prądy „rosyjskie”: prąd zmienny o sinusoidalnej fali o f=2500Hz zastosowany w 50 wybuchach na sekundę tj. 10ms wybuchów w 25 cyklach każdy, 10ms przerwy między nimi. Każdy dwufazowy impuls trwa tylko 0,4ms potrzebuje prądu o wysokim natężeniu, aby wywołać skurcz mięśni .
Prądy interferencyjne: prądy zmienne o f=4000Hz (lub wyższej w zależności od producentów). Kiedy dwa obwody prądy o niewielkiej różnicy częstotliwości działają w tym samym czasie i w tym samym miejscu, powstaje trzeci prąd umożliwiający różny poziom stymulacji.
Prądy wielkiej częstotliwości: zbyt szybkie zmiany, aby mogły stymulować nerwy lub mięśnie, wytwarzane jest ciepło.
PRĄDY NISKIEJ CZĘSTOTLIWOŚCI 0-1000Hz (typu faradycznego, TENS, sinusoidalne, diadynamiczne)
PRĄDY ŚREDNIEJ CZĘSTOTLIWOŚCI 1000Hz-100000Hz (interferencyjne (techniki dwupolowe [premoduowany] i czteropolowe [klasyczna interferencja, dipol vector, izoplanar], prądy falujące, rosyjska stymulacja, impulsowy jednokierunkowy średniej częstotliwości)
PRĄDY WIELKIEJ CZĘSTOTLIWOŚCI 100000Hz i więcej (diatermia krótkofalowa)
Efekty działania bodźca elektrycznego na tkankę
W czasie przepływu prez tkanki prądu niskiej i średniej częstotliwości możemy zauważyć dwie grupy skutków jego działania:
efekty działania na tkankę pobudliwą ( nerwy i mięśnie) są dobrze udokumentowane i obejmują wiele efektów pośrednich np. modyfikację percepcji bólu w CUN oraz wyzwalanie skurczu mięśni jako następstwo stymulacji włókna nerwowego. Istnieją również dowody na to, że prąd stały działający na tkankę wpływa na jej wzrost i metabolizm (elektroterapia powodujące prawidłowe odżywianie→eutroficzna, nerw kieruje syntezą białek i utrzymuje prawidłowe właściwości błony komórkowej). Nerwy obwodowe składają się z wielu włókien- wypustek komórki nerwowej- czuciowych (aff.) i ruchowych (eff.). Włókna ruchowe są aksonami komórek w rogu brzusznym (przednim) rdzenia kręgowego (komórki rogu przedniego), podczas gdy komórki nerwów czuciowych znajdują się w zwoju korzenia grzbietowego (tylnego). Nerwy ruchowe do mięśni szkieletowych i nerwy czuciowe są grubymi, mielinizowanymi włóknami szybkoprzewodzącymi. Większość włókien nerwów obwodowych to niemielinizowane, wolnoprzwodzące, cienkie włókna nerwowe. Większy procent stanowią włókna C przewodzące ból, inne to autonomiczne włókna nerwowe.
efekt działania na tkanki niepobudliwe na poziomie komórki jest w mniejszym stopniu rozpoznany i zrozumiany. Istnieją dowody na to, że przerywany prąd stały może przyspieszyć gojenie skóry i innych tkanek (np. tkanka łączna). Sugeruje się również, że prądy te mogą pobudzić komórkowy metabolizm prowadzący do zmian na poziomie mikrokrążenia tętnic, żył i naczyń limfatycznych. Niestety nie ma istotnych dowodów potwierdzających tę tezę.
W celu dostarczenia bodzica elektrycznego do tkanek konieczny jest kompletny obwód elektryczny (2 elektrody z odpowiednim materiałem przewodzącym, przymocowane do skóry). Efekty będą widoczne, jeżeli gęstość prądu jest odpowiednio wysoka pod aktywną -mniejszą elektrodą. Konsekwentnie skórne włókna nerwowe będą pobudzane najwcześniej, a zwiększając gęstość prądu będą pobudzane głębiej położone włókna nerwowe. Włókna czuciowe i ruchowe są grubymi, mielinizowanymi i szybkoprzewodzącymi włóknami, dlatego też są wcześniej stymulowane niż cienkie włókna bólowe. Najpierw więc stymulowane są (niska dawka prądu) włókna czuciowe w skórze, które normalnie przewodzą dotyk, temperaturę i ucisk. Pacjent czuje delikatne „kłucia” w wyniku szybko powtarzającej się stymulacji receptorów dotyku. Dalsze zwiększenie natężenia prądu wyzwala większe odczucie „mrowienia” i ewentualnie wyzwala skurcze mięśni. Określenie stymulacja mięśni stosowane jest dla wygody. Prąd stymuluje włókna nerwowe ruchowe, które przewodzą impuls nerwowy do stymulowanych mięśni.
Penetracja impulsu elektrycznego przez tkanki
Oporność skóry jest bardzo duża dla prądu stałego i dla przerywanego o długim czasie impulsu, dużo większa niż innych tkanek. Oporność skóry zmniejsza dla prądu przerywanego o krótkim czasie impulsu. Dla pulsu o czasie trwania 10ms oporność skóry wynosi około 1000Ω a dla pulsu 0,1ms tylko 50Ω. Dzieje się tak dlatego, że skóra działa jak kondensator, który daje mniejszą oporność dla krótkiego czasu pulsu, tak jak przy prądach średniej częstotliwości. Rozprowadzanie prądu o krótszym czasie impulsu przez tkankę jest tutaj bardziej równe, więc efektywnie penetruje on głębsze tkanki. W konsekwencji głębiej położone nerwy (ruchowe) są łatwiej stymulowne przez krótki impuls. Większość prądów z dłuższym czasem impulsu używana jest głównie do stymulacji nerwów czuciowych.
CHARAKTERYSTYKA PRĄDÓW STOSOWANYCH W TERAPII FIZJOLOGICZNE EFEKTY ICH DZIAŁANIA
Prąd stały (galwaniczny)
Cechy prądu:
ciągle płynie w jednym kierunku
stałe natężenie
nie pobudza nerwów i mięśni
Parametry prądu stałego:
natężenie
kierunek przepływu prądu (polaryzacja)
Polaryzacja:
katoda pozyskuje elektrony (ujemna)
anoda traci elektrony (dodatnia)
Prąd płynie drogą o najmniejszym oporze (ujścia i przewody wyprowadzające gruczołów potowych w skórze, głębiej w przestrzeniach międzykomórkowych, wzdłuż naczyń krwionośnych, limfatycznych i nerwów).
Przewodnictwo tkanek zależy od:
zawartości wody
stężenia elektrolitów
Dobre przewodniki: krew, mocz, limfa, płyn mózgowo-rdzeniowy, mięśnie.
Słabe przewodniki: tkanka tłuszczowa, ścięgna , torebki stawowe, kości. Prądu nie przewodzi warstwa rogowa naskórka suchej skóry, paznokcie, włosy. W wilgotnej skórze występuje zmniejszenie oporu dla płynącego prądu. W czasie wykonywania zabiegów należy stosować grube podkłady zmoczone w wodzie lub 0.1 - 0.5% roztworze soli kuchennej.
↓ oporu powoduje ogrzanie skóry (w niewielkim zakresie)
↑oporu występuje wskutek polaryzacji granicznych błon tkankowych.
Poprzeczne ułożenie powoduje duży opór w związku z warstwową budową tkanek, występują opory na powięziach i błonach.
Podłużne ułożenie stwarza lepsze warunki do przepływu prądu, który płynie przez tkanki o mniejszym oporze, omijając tkankę tłuszczową.
Działanie prądu stałego na organizm
↑ procesu dyfuzji (wyrównanie stężeń jonów po każdej stronie błony przepuszczalnej)
↑ procesu osmozy (proces przemieszczania się rozpuszczalnika w celu wyrównania poziomu stężeń substancji pomiędzy wnętrzem a zewnętrzną częścią komórki, co poprawia jej funkcje odżywczo - troficzne)
Przepływowi prądu elektrycznego towarzyszy polaryzacja jonowa (miejscowe grupowanie jonów wytwarzających różnice potencjału o znaku przeciwnym w stosunku do przyłożonego z zewnątrz napięcia). W czasie przepływu prądu stałego przez tkanki zachodzą zjawiska fizykochemiczne i fizjologiczne.
Zjawiska elektrochemiczne
elektroliza, czyli proces powstawania w elektrolicie po wpływem przepływu prądu stałego swobodnych atomów ze znajdujących się w nim jonów.
występuje przemieszczanie się jonów dodatnich - kationy (Na+, Ca+, K+) w kierunku katody, ujemnych- aniony (NO3-, SO42-, CL_, CO3-) w kierunku anody.
Zjawiska elektrokinetyczne
Pod wpływem pola elektrycznego występuje przesunięcie względem siebie faz rozproszonej i rozpraszającej koloidów tkankowych.
Elektroforeza: ruch naładowanych jednoimiennie cząsteczek fazy rozproszonej układu koloidowego względem fazy rozpraszającej. Katoforeza → ruch dodatnich cząsteczek ku katodzie.
Anoforeza → ruch ujemnych cząsteczek do anody.
Elektroosmoza → ruch fazy rozpraszającej układu koloidowego w stosunku do fazy rozproszonej, czyli przesunięcie wody przez błony komórkowe w kierunku katody. Pod katodą występuje lekki obrzęk, pod anodą skóra jest wyschnięta.
Zjawiska elektrotermiczne
Tarcie związane z ruchem jonów, atomów i cząsteczek w polu elektrycznym powoduje powstawanie ciepła Joule'a [H=I2 R t]. Ilość ciepła jest niewielka. Nie odgrywa żadnej roli terapeutycznej.
Reakcja nerwów i mięśni na prąd stały
Prąd stały w czasie przepływu nie wywołuje skurczu mięśni. Może on wystąpić tylko w czasie zamykania lub otwierania obwodu prądu. Prawo Du Bois Reymonda: bodźcem nie jest sam prąd, ale dostatecznie szybka zmiana jego natężenia w czasie. Prąd stały zmienia pobudliwość komórek, co wykorzystuje się w zabiegach elektroleczniczych.
Zmiany miejscowe
Stymulacja czuciowa. W czasie przepływu prądu świadomie odczuwa się łagodne mrowienie i ukłucia, które w razie wzrostu natężenia prądu mogą przejść w pieczenie lub irytację. Jest to błąd w sztuce!!!
W skórze pod elektrodami dochodzi do krótkotrwałego zwężenia, a potem rozszerzenia naczyń krwionośnych. Przekrwienie, czyli rumień galwaniczny jest intensywniejszy pod katodą, mniejszy pod anodą. Występuje również nieznacznie wokół elektrod. Czas- około 1.5-2h. Spowodowany jest przez uwolnioną z magazynów tkankowych histaminą, zwiększa się przepuszczalność błon komórkowych oraz resorpcja.
Rozszerzeniu ulegają również naczynia głębiej położonych mięśni, w wyniku drażnienia odpowiednich receptorów układu autonomicznego w skórze. Występuje wzrost przepływu krwi w całym segmencie, w którym wykonuje się zabieg. Poprawa krążenia korzystnie wpływa na odżywienie tkanek.
Przyspieszenie procesów regeneracji (gojenie ran i odleżyn) → mikroprąd.
Działanie przeciwbólowe. Starsze teorie: zmiana pobudliwości pod anodą - hyperpolaryzacja, anelektronus. Pod katodą zwiększenie pobudliwości - katelektronus. Nowe teorie: odpychanie pod anodą jonów wodoru i potasu wpływa na zmniejszenie bólu.
Reakcje zachodzące pod anodą i katodą w czasie przepływu prądu
Katoda (+) Anoda (-)
Wzrost ph (odczyn zasadowy) spadek ph (odczyn kwaśny)
Wzrost napięcia mięśni spadek napięcia mięśni
Depolaryzacja włókien nerwowych hiperpolaryzacja wł. Nerwowych
Intensywne zaczerwienienie skóry mierne zaczerwienienie skóry
Lekki obrzęk wysuszanie skóry
Zabiegi wykonywane z wykorzystaniem prądu stałego:
galwanizacja
jonoforeza
kąpiele elektryczno - wodne
Przed zabiegiem należy dokumentować: dane osobowe, rozpoznanie (choroba podstawowa, współistniejące), sposób wykonania zabiegu, dawka.
Technika galwanizacji
przygotowanie pacjenta
sprawdzić czucie
kontrola skóry
pozycja pacjenta w czasie zabiegu
warunki bezpieczeństwa w czasie zabiegu
elektrody: płaskie z metalu niepolaryzującego: cyna, jednorazowe z folii aluminiowej, kształt i rozmiar dostosowany do wielkości powierzchni leczonej
podkłady: materiały naturalne (gaza), gąbka wiskozowa o równych otworach o grubości ok. 2 cm lub więcej
umocowanie, kolejność→ podkład, elektroda, folia, bandaż lub woreczki z piaskiem, taśmy mocujące→ równomierny nacisk w celu odpowiedniego przepływu prądu (brak zagęszczeń)
Przepływ prądu zależy od:
wymiarów elektrod (gęstość prądu)
technika jednobiegunowa, dwubiegunowa
ułożenia elektrod : poprzeczne, podłużne
odległość elektrod ( mała→ zagęszczenie prądu, duża→ zbyt małe zagęszczenie). Odległość nie może być mniejsza od średnicy elektrody (3-5cm).
Metody stosowania
przepływ prądu poprzeczny
przepływ prądu podłużny: zstępujący ± ↓, obniżenie pobudliwości, rozluźnienie mięśni, zmniejszenie bólu; wstępujący ↑, działanie pobudzające np. w niedowładach.
Dawkowanie: nie wolno przekroczyć dawki 0.2 mA/cm2 !!!!! Zależy od rodzaju choroby, jej stadium: ostre, podostre, przewlekłe.
Dawka obiektywna (ilość prądu na cm2 ).
Wg Konarskiej Wg Edela
Słaba: 0.01 - 0.1 mA/cm2 0.05 mA/cm2
Średnia: 0.3 mA/cm2 0.1 mA/cm2
Mocna: 0.5 mA/cm2 0.15 mA/cm2
Dawka subiektywna: słaba, nie wywołuje wrażeń czuciowych
średnia: przyjemne mrowienie
mocna: silne mrowienie
PIECZENIE, BÓL, SILNE CIEPŁO → OBJAWY PRZEDAWKOWANIA PRĄDU. NALEŻY PRZERWAĆ ZABIEG!!!!!
Czas zabiegu:
Wg Konarskiej 10-30 minut
Wg Jantscha 10-20 minut
Wg Edela 5-20 minut
Codziennie 10-12 dni, długa seria 12-18 zabiegów.
Po zabiegu należy sprwadzić skórę, podrażnienia zabezpieczyć obojętnym, tłustym kremem. Elektrody i folię umyć, podkłady wyprać i wygotować. Należy przestrzegać idealnej czystości.
Wskazania
Nerwobóle, przewlekłe zapalenia nerwów, splotów i korzeni, zespoły bólowe→ elektrodą czynną jest anoda (galwanizacja anodowa). Porażenia wiotkie, utrudniony zrost kości, zaburzenia krążenia obwodowego→ galwanizacja katodowa.
Przeciwwskazania
Ropne stany zapalne skóry i tkanek miękkich, wypryski, stany gorączkowe, porażenia spastyczne.
JONOFOREZA
Zabieg elektroleczniczy polegający na wprowadzeniu do tkanek jonów działających leczniczo siłami pola elektrycznego. Jony o takim samym ładunku, jak elektroda po którą się znajdują, zostają odpychane od niej. Zjawisko to powoduje przemieszczanie leków w postaci jonów do skóry. Podstawy fizykochemiczne - jak w prądzie stałym.
METODYKA ZABIEGU
stosowanie urządzenia wytwarzającego stabilny, dobrze wyprostowany prąd
stały
dokładne przygotowanie skóry w obszarze zabiegu, zabezpieczyć ubytki skóry
zastosowanie podkładu lekowego i grubego pośredniego, zwilżonego ciepłą wodą
podkład lekowy używać jednorazowo
rozmiar, kształt dostosowany do wielkości powierzchni leczonej
stosować elektrody cynowe
dawki jak w prądzie stałym
kontrolować doznania chorego w czasie zabiegu
po zabiegu kontrolować odczyn skóry
przed zabiegiem dokładnie sprawdzić rodzaj leku i jego stężenie
wykonać próbę na uczulenie w przypadku stosowania leków typu: lidokaina, prokaina, jod, antybiotyki
czas zabiegu zwykle 15-20 minut, codziennie lub co drugi dzień, 10-20 zabiegów
wykonywać tydzień po zakończeniu leczenia miejscowego maściami
Przeciwwskazania jak w prądzie stałym.
Wskazania wynikają z działania leków.
Leki stosowane do jonoforezy (zaznaczono biegun spod którego są wprowadzone do tkanek). Chlorek sodu -, siarczan magnezu+, jodek potasu-, chlorek wapnia+, chlorek litu+, salicylan sodu -, kwas octowy -, chlorek cynku+, siarczek miedzi+, hydrocortizon-, jad pszczeli+; leki rozszerzające naczynia krwionośne spod + (histamina, acetylocholiona, pridazol, forapin [jad pszczeli]); leki rozmiękczające tkankę: jodek potasu -, hialuronidaza+, contractubex +, kinetin 150JE +, hamowanie krzepnięcia: heparyna -, exirudin -; przeciwbólowe sod +(xylokain, lidokaina, epinefryna, novokaina; niestrydowe leki przeciwzapalne spod katody (diklofenac, ketoprofen, piroxicam, tenoxicamfenylbutazon, indomethacin).
KĄPIELE ELEKTRYCZNO - WODNE
Wstępująca: zwiększenie pobudliwości OUN, wpływ na układ sercowo-naczyniowy: zwiększenie odpływu krwi żylnej z kończyn dolnych i narządów objętych „dorzeczem” żyły wrotnej, zwiększenie dopływu krwi tętniczej do płuc i kończyn górnych, zwiększenie odpływu krwi żylnej z serca i płuc.
Zstępująca: obniżenie pobudliwości OUN, wpływ na układ sercowo-naczyniowy: zwiększenie dopływu krwi z krążenia małego do serca, zwiększenie odpływu krwi żylnej z płuc i kończyn górnych, dopływ krwi tętniczej do narządów objetych „dorzecze” żyły wrotnej.
Przed zabiegiem należy sprawdzić stan krążenia!!!!!
Wskazania: zapalenia wielonerwowe, nerwobóle, choroba zwyrodnieniowa, nerwica wegetatywna. Zaburzenia ukrwienia obwodowego.
Przeciwwskazania: Nie wolno wykonywać zabiegów u pacjentów z podciśnieniem tętniczym, nadciśnieniem, w stanach gorączkowych, w niewydolności krążenia.
Prąd impulsowy średniej częstotliwości
Prąd impulsowy średniej częstotliwości jest to przerywany prąd stały z częstotliwością 8000Hz. Uzyskany w ten sposób prąd o jednym kierunku przepływu, z czasem przerwy 5 μsec i czasem pulsu 125 μsec, cyklem pracy 95%, ma takie samo praktyczne zastosowanie jak prąd galwaniczny. Największa korzyść wynika z faktu, iż jest on lepiej tolerowany przez pacjentów. Impulsowy prąd średniej częstotliwości 8000Hz stwarza podobne możliwości wykorzystania w terapii jak prąd galwaniczny. Może być stosowany również do zabiegu jonoforezy, galwanizacji, przyspieszenia zdrowienia ran, usprawnienia krążenia obwodowego.
Prąd impulsowy trójkątny
Przerywany prąd galwaniczny o trójkątnym kształcie pulsu stosowany jest w diagnostyce i terapii, szczególnie w przypadku zaburzeń pobudliwości. W diagnostyce prąd ten stosuje się do wyznaczania krzywej I/t i współczynnika akomodacji, natomiast leczniczo do uzyskania skurczów odnerwionych mięśni (porażenie wiotkie) i stymulacji mięśni gładkich.
Prąd impulsowy prostokątny
Przerywany prąd galwaniczny o prostokątnym kształcie pulsu może być stosowany w diagnostyce i terapii do pobudzania skurczów mięśni nie wykazujących zaburzeń pobudliwości, tzn. mięśni zdrowych lub nieznacznie uszkodzonych. W diagnostyce prąd ten stosuje się do wyznaczania krzywej I/t, wyznaczania wartości reobazy i chronaksji.
Prąd Traberta ( 2|5, Ultra Reiz)
W latach 50-tych naszego stulecia po pierwszych próbach Nemeca związanych z zastosowaniem w terapii prądów interferencyjnych, niemiecki lekarz Helmut Trabert opublikował artykuł dotyczący leczenia pacjentów z dolegliwościami bólowymi w szyjnym i lędźwiowym odcinku kręgosłupa. Po przetestowaniu różnych rodzajów prądów, Trabert głównie stosował w terapii ciągły łańcuch pulsów prostokątnych o czasie trwania 2ms i przerwie 5ms, z bardzo wysokim natężeniem. Wynik tej aplikacji był tak niezwykły, iż w związku z tym Trabert nazwał go „Ultra Reizstrom”, chociaż nie potrafił wyjaśnić w sposób naukowy jego skuteczności. W związku z jego parametrami prąd ten zwany jest również prądem 2/5. Prąd sam w sobie nie jest wyjątkowy. Główna wartość terapii za pomocą prądu 2/5 jest związana z typowym ułożeniem elektrod. Dzięki tej metodzie segmentarne działanie zostało wprowadzone do elektroterapii. Trabert również nie próbował wyjaśniać skutków działanie segmentarnego. Prąd Traberta uważany jest jako oryginalna metoda lecznicza.
Charakterystyka prądu Traberta
czas impulsu: 2 ms
czas przerwy: 5 ms
częstotliwość: około 143 Hz
Efekty :
*galwaniczny→ istotna ciągła częstotliwość→ adaptacja→ zwiększenie natężenia 3-7 razy→wysokie natężenie→chronić przed pieczeniem!!!
*częstotliwości
depolaryzacja⇒ średnio-grubych włókien nerwowych→ mocne wrażenie wibracji „coś ciężkiego leży na plecach”
⇓stymulacja afferentnych wł.nerwowych w dermatomach i miotomach
⇓zmniejszenie odczucia bólu
hamowanie tonicznych wyładowań układu sympatycznego
depolaryzacja ⇒grubych włókien nerwowych→ skurcz mięśni
Dawkowanie:
*natężenie prądu: odpowiednie do mocnego odczuwania wibracji, brzęczenia, po adaptacji→ zwiększenie natężenia od 3 do 7 razy; limit: 0,2 mA na pow. w cm2
*czas zabiegu: 15 minut,
*częstotliwość leczenia: 6-8 razy, jeżeli wrażliwość skóry na to pozwala w zależności od celów i efektów leczniczych. W przypadku wystąpienia zmian skórnych pod wpływem prądu należy zastosować podobne leczenie wykorzystując prądy IF o parametrach 20Hz-20Hz, stosując szybkie i gwałtowne zmiany częstotliwości.
*efekty terapeutyczne są zauważalne już po pierwszym leczeniu, lub po 2-3 sesji leczniczej. Jeżeli nie ma pozytywnych efektów, nie należy kontynuować leczenia.
WSK. OSTROŻNOŚCI:
- sprawdzić przed leczeniem wrażliwość skóry w miejscu aplikacji (czucie dotyku, temepartury)
- dokładne sprawdzić skórę, miejsca o obniżonej oporności zabezpieczyć wazeliną,
-stosować podkłady o grubości 2-4 cm, dobrze nasączone wodą, dokładnie z jednakowym naciskiem przylegające do leczonej powierzchni, w razie potrzeby w czasie zabiegu należy dodać wody do podkładów,
-chronić skórę po leczeniu: posypać talkiem lub posmarować maścią łagodzącą.
Sposoby aplikacji:
-miejscowe,
-segmentarne.
Termin terapia segmentarna wymaga wyjaśnienia. Jakakolwiek stymulacja afferentnych włókien nerwowych ma następstwa w procesach informacji bólowej na poziomie rdzenia kręgowego, gdzie wchodzą włókna nerwowe. W tym samym czasie stymulacja ta oddziaływuje na sympatyczną regulację w segmencie należącym do poziomu rdzeniowego. Aplikacja zwana jest segmentarną, jeżeli pożądany jest wpływ w segmencie, bez lokalnych efektów po stronie stymulacji. W przypadku wielu stanów patologicznych użyteczne jest zastosowanie terapii segmentarnej do hamowania trwającej, chronicznie zwiększonej aktywności układu sympatycznego. Może to być dokonane przez stymulację średnio-grubych włókien nerwowych wchodzących do rdzenia kręgowego na poziomie, skąd wychodzą sympatyczne włókna nerwowe biegnące do powierzchni zmienionej chorobowo. Chcąc stosować terapię segmentarną bardzo ważna jest znajomość, z którego poziomu rdzenia kręgowego unerwiane są sympatycznie poszczególne rejony naszego ciała. Sympatyczne neurony znajdują się tylko w rogach bocznych (jądra pośrednio-boczne) na poziomie rdzeniowym C8-L2.
Z anatomicznego punktu widzenia rogi boczne zorganizowane są w specyficzny sposób. W bocznej części składaja się z małych teleskopowych kolumn ciał komórkowych neuronów przedzwojowych. W części środkowej zlokalizowane są przedzwojowe neurony dla naczyń. Nieznacznie bardziej bocznie znajdują się przedzwojowe neurony dla narządów tułowia, a najbardziej bocznie dla kończyn. W dogłowowej części rogów bocznych rdzenia kręgowego ich organizacja jest nieznacznie zróżnicowana. Znajdują się tam sympatyczne włókna nerwowe regulujące pracę oka (centrum rzęskowo-rdzeniowe), szerokość źrenicy, włókna nerwowe gałki ocznej o oczodołu. Od Th1 w dół obowiązuje zasada wcześniej omówiona. Struktura autonomicznego układu nerwowego jest anatomicznie różna od somatycznego układu nerwowego: somatyczna kontrola naszego ciała ma miejsce we wnętrzu rdzenia na całej jego długości, autonomiczna regulacja zaś tylko w ograniczonej jego części. Segmenty szyjne nie posiadają rogów bocznych. Istnieje interesująca hipoteza mówiąca o tym, że w czasie rozwoju embrionalnego kończyn bardzo duże zwiększenie rogów brzusznych spowodowało na poziomie szyjnym i lędźwiowym, zmniejszenie przestrzeni i „przesunięcie” komórek rogów bocznych z omawianych obszarów w kierunku odcinka piersiowego i górnego lędźwiowego. W tym samym czasie nowe rogi boczne uformowały się odpowiednio dla kończyn. Dlatego też komórki rogów bocznych dla naczyń i tułowia (tzw. autochtoniczne komórki rogów bocznych), jak i komórki rogów bocznych należące do segmentów, z których rozwijają się kończyny (tzw. allochtoniczne lub migracyjne komórki rogów bocznych) są na tym samym poziomie piersiowego odcinka kręgosłupa. Dalsze komórki są położone bocznie naprzeciwko autochtonicznych komórek rogów bocznych.
UNERWIENIE SYMPATYCZNE Z KOMÓREK ROGÓW BOCZNYCH RDZENIA KRĘGOWEGO
C8, T1→ centrum cliospinalis (oczy)
T1 - T4→ głowa, wyższe segmenty szyjne C1-C4
T4 - T9→ niższe segmenty szyjne C5-C8, kończyny górne
T10 - T12→ segmenty lędźwiowe L3-L5
L1 -L2 → segmenty krzyżowe
Rysunek 3. Ułożenie elektrod wg Traberta.
Metodyka dawkowania segmentarnego:
1. Ułożenie E1 wielkość elektrod 7x9 cm, ułożenie podłużne, pacjent leży przodem, odpowiednia pozycja zmniejszająca lordozę szyjną,
elektroda cranial (dogłowowo): os occipitale
elektroda caudal (doogonowo): 3 cm poniżej
choroby szyjno-czaszkowe→ katoda w pozycji „cranial”, stymulacja n.occipitalis major w wypadku potylicznych bólów głowy, powoduje zmniejszenie transmisji bólowej na poziomie szyjnym, impulsy nerwowe są w tym samym czasie przekazywane przez podłużne, wewnątrz rdzeniowe połączenia do kojarzonego rogu bocznego z k.układu sympatycznego w wyższym poziomie piersiowym, co powoduje lokalne zmniejszenie chronicznie zwiększonej aktywności w sympatycznym układzie nerwowym. Druga elektroda ma bezpośrednio hamujący wpływ na sympatyczną regulację obszaru szyjno-głowowego w tym samym wyższym poziomie piersiowym.
zaburzenia w kk. górnych → katoda w pozycji „caudal”, kojarzony poziom unerwienia somatycznego.
2.Ułożenie E2 wielkość elektrod 9x11cm
elektroda cranial: na poziomie C7
elektroda caudal: 3cm poniżej
zaburzenia: głowa, szyja, obr. barkowa, kończyny górne→ katoda w pozycji „cranial”, poziom somatycznego unerwienia tego obszaru, anoda na poziomie unerwienia sympatycznego.
zaburzenia w wyższych segmentach klatki piersiowe, zaburzenia kążenia w kończynach górnych→ katoda w pozycji „caudal” na poziomie unerwienia sympatycznego.
3.Ułożenie E3 wielkość elektrod 9x11cm, wskazane do leczenia zaburzeń tułowia. Pozycja katody jest zależna od lokalizacji nerwów rdzeniowych odpowiadających segmentowi, w którym zachodzi zaburzenie.
4.Ułożenie E4 wielkość elektrod 10x13cm, ochrona przed zwiększeniem lordozy lędźwiowej- podłożenie poduszki pod brzuch,
elektroda „caudal” ułożona poprzecznie przez kość krzyżową powyżej szpary pośladkowej, elektroda „cranial” ułożona podłużnie 3cm powyżej
bóle dolnego odcinka kręgosłupa, obręczy biodrowej i miednicy, zaburzenia krążenia w kończynach dolnych→ katoda w pozycji „cranial”, na kojarzonym poziomie unerwienia sympatycznego.
dolegliwości kk. dolnych→ katoda w pozycji „cauda” na poziomie unerwienia somatycznego.
Wskazania
Metoda segmentarna wskazana jest, gdy skutek odruchowy powinien pojawić się w obszarze unerwianym przez nerwy sympatyczne. Lokalna aplikacja może przedstawiać praktyczne problemy, ponieważ obszar na który chcemy wpływać jest zbyt duży (zaburzenia krążenia w obu stopach albo dłoniach), lub elektrody nie mogą być umieszczone prawidłowo w przypadku narządów wewnętrznych (w przypadku funkcjonalnych zaburzeń narządów wewnętrznych) lub w wypadku uszkodzeń skóry lub opatrunku gipsowego. Lokalna aplikacja może być również niemożliwa ze względu na zbyt wysoką lokalną wrażliwość (atrofia Sudecka). Główną kategorię zaburzeń leczonych za pomocą terapii segmentarnej stanowią specyficzne zaburzenia narządów, co obejmuje nie tylko funkcjonalne zaburzenia narządów wewnętrznych, ale również segmentarne wzmożenie napięcia mięśniowego, przeczulicę bólową, przeczulicę dotykową, zaburzenia krążenia. W tym przypadku skóra , mięśnie, stawy, nerwy, n krwionośne można traktować jako narządy. Każdy z tych narządów ma kliniczny obraz segmentarnego rozregulowania w postaci specyficznych zaburzeń tych organów i ich tkanek wewnętrznych.
SKÓRA
redukcja możliwości życiowych skóry (test podciągania fałdu skórnego)
redukcja plastyczności (fałdowanie)
redukcja zdolności przesuwania skóry wobec tkanek pod nią leżących
zmiany w konsystencji (grubość)
twardy end-feel
zmiany w kolorze: blady, szary, ziemisty
obniżenie temperatury
zmniejszenia wypełnienia kapilarów
zwiększenie wilgotności
lepkość skóry
przeczulica bólowa
przeczulica dotykowa
allodynia (ból pod wpływem bodźca, który normalnie nie wywołuje bólu, czyli wywołany innym bodźcem niż bodziec szkodliwy)
zwiększenie zaczerwienienia po drażnieniu mechanicznym
NERWY
zmniejszona elastyczność
zwiększona wrażliwość włókien nerwowych
wrażenie mrowienia
blokada przewodnictwa
MIĘŚNIE
zmniejszona elastyczność
twardy end- feel
skrócenie mięśni
zwiększenie wrażliwości na rozciąganie
męczliwość
wzmożone napięcie
ból skurczowy
zwiększenie podstawowego napięcia
zaburzona koordynacja
niestabilna aktywność
STAW
ograniczenie zakresu ruchu
wzorzec torebkowy
twardy end-feel
zwiększenie wrażliwości w końcowym zakresie ruchu
zmniejszenie sekrecji mazi stawowej
zwiększenie skłonności do zapaleń
wczesne powstawanie puchliny wodnej
utrata chrząstki stawowej
Przykłady :
Atrofia Sudecka: wymaga ostrożnego i długiego postępowania terapeutycznego. Wielu autorów proponuje terapie odruchową w rozumieniu terapii poza zajętym chorobą obszarem. Lokalna aplikacja wskazana jest tylko w lżejszych przypadkach.
Zespół zimnego barku (frozen sholder), w starej terminologii zwane również PHS, często traktowany jako schorzenie ortopedyczne. Wiele zaburzeń tkanek miękkich spowodowanych jest zakłóceniem równowagi między fizycznym obciążeniem
a wytrzymałością. Łatwo przypisać te zaburzenia przeciążeniom, ale w niezliczonej ilości przypadków przyczyna leży w słabej kondycji przemęczonych tkanek. Troficzne zaburzenia, przyczyną których jest neuralne pobudzenie, niedostateczne krążenie zwiększa wrażliwość na urazy w takim stopniu, że nawet osiągnięcie normalnej aktywności uważane jest za przeciążenie. Pod wpływem tych okoliczności powstaje wiele zespołów określanych jako periarthritis, bursitis, tendonitis. Lokalne oddziaływanie jest więc niewystarczające. Prace Levine i współautorów są bardzo interesujące w tym aspekcie, gdyż zawierają hipotezę, że długotrwałe zwiększenie aktywności układu sympatycznego przyczynia się do rozwoju reumatycznego zapalenia stawów; i typowe symetryczne rozszerzanie się symptomów może częściowo być wywoływane przez mechanizm odruchowy. Jeżeli hipoteza ta potwierdzi się, spowoduje nowy pogląd na terapię schorzeń, z którymi obecnie mamy problemy.
Leczenie zaburzeń krążenia obwodowego w wyniku funkcjonalnych zaburzeń (nie są spowodowane zmianami strukturalnymi w ścianach naczyń). Trabert uzyskiwał bardzo dobre rezultaty w leczeniu tych zaburzeń stosując swoją terapię.
Przeciwwskazania
Gorączka, nowotwór, gruźlica, brak komunikacji z pacjentem, ciąża (odcinek lędźwiowy), rozrusznik serca.
Relacja unerwienia sympatycznego w stosunku do unerwienia somatycznego
C2 → Th1
C3 → Th2
C4 → Th3
C5 → Th4
C6 → Th5
C7 → Th6
C8 → Th7
Th1 → Th1 Th8} ramie
Th2 → Th2 Th9} ramie
Th3 → Th3
Th4 → Th4
Th5 → Th5
Th6 → Th6
Th7 → Th7
Th8 → Th8
Th9 → Th9
Th10 → Th10
Th11 → Th11
Th12 → Th12
L1 → L1
L2 → L2
L3 → Th10
L4 → Th11
L5 → Th12
S1 → L1
S2 → L2
S3 → L2
S4 → L2
S5 → L2
Prąd neofaradyczny
Prąd neofaradyczny jest to nowoczesna odmiana prądu faradycznego, w której pozostawiono tylko dodatnie impulsy o kształcie trójkątnym, czasie pulsu 1ms, czasie przerwy 19ms i częstotliwości 50Hz. W nowoczesnych elektrostymulatorach istnieje możliwość ustalenia innej częstotliwości, mieszczącej się w zakresie prądów impulsowych niskiej częstotliwości. Prąd neofaradyczny może składać się z serii impulsów z modulowaną amplitudą, gdzie natężenie kolejnych impulsów w serii stopniowo wzrasta i maleje. Obwiednia pakietu impulsów może być dobrana indywidualnie (od prostokątnej do trójkątnej), dzięki zastosowaniu procentowego określania czasu narastania i czasu zbaczania. Ustawienie manualne czasu trwania pakietu impulsów i przerwy między nimi powoduje, że prąd ma charakter falujący. Dzięki temu można doskonale indywidualnie dostosować parametry elektrostymulacji, w zależności od stanu pacjenta i celu zabiegu. Prąd neofaradyczny stosuje się do stymulacji mięśni prawidłowo unerwionych w celu pobudzenia mięśnia do skurczu, reedukacji i treningu nowych akcji mięśnia.
Prądy diadynamiczne
Termin prądy diadynamiczne wprowadził francuski lekarz P.Bernard. W prądach diadynamicznych wyróżnia się dwie składowe: galwaniczną i zmienną, gdyż wyprostowany jednopołówkowo prąd sinusoidalnie zmienny o częstotliwości 50Hz nałożono na prąd galwaniczny. Czas trwania każdego impulsu wynosi 10ms i jest równy czasowi przerwy. W określaniu typów prądów diadynamicznych przyjęły się skrócone nazwy wywodzące się z języka francuskiego. Prąd MF (monophase fixe) jest to jednopołówkowo wyprostowany prąd zmienny o częstotliwości 50Hz. Prąd DF (diphase fixe) jest to dwupołówkowo wyprostowany prąd zmienny o częstotliwości 100Hz. Prąd CP (courte periode) cechuje się naprzemiennym występowaniem prądu MF i DF, czas trwania każdego z nich wynosi 1 sec. Prąd LP (longue periode) powstaje przez nałożenie na prąd MF takiego samego prądu, lecz o zmodulowanej amplitudzie i przesuniętego w fazie o 180 stopni. Czas trwania zmodulowanej części prądu MF wynosi 10 sekund, a części niezmodulowanej 6 sekund. Prąd RS (rhytme syncope) powstaje przez przerywanie co 1 sekundę prądu MF, z przerwą trwającą również 1 sekundę. Prąd MM (monophase module) jest to prąd MF zmodulowany w amplitudzie. Obwiednia modulacji ma kształt połówki sinusoidy, a czas trwania modulacji wynoszący 10 sekund jest równy czasowi przerwy. Prąd CP-ISO jest to prąd, w którym w czasie trwania fazy DF zwiększona jest siła prądu (ustawianie ręczne w %). Prąd ten jest mniej agresywny w odczuciach pacjenta niż prąd CP. Dobierając w terapii odpowiednie prądy diadynamiczne konieczne jest kierowanie się ich specyficznymi właściwościami. Prąd DF o częstotliwości 100Hz, ma wysoki komponent galwaniczny Pacjent w czasie stymulacji odczuwa delikatne wibracje. Stosuje się go w pierwszej fazie leczenia, w przypadku silnego bólu, dla pacjentów o dużej wrażliwości, rozpoczyna się nim sesję leczniczą. Może być również stosowany, ze względu na stałą wysoką częstotliwość, w celach diagnostycznych dla lokalizacji powierzchni o zwiększonej pobudliwości. Prąd MF mimo niskiej komponenty galwanicznej (niższa częstotliwość) powoduje mocniejsze odczucia u pacjenta niż prąd DF i mniejsze zagrożenie występowania pieczenia pod elektrodami. Prąd ten jest preferowany przez pacjentów, którzy w czasie stymulacji prądem DF odczuwają nieprzyjemne drażnienie. Prąd CP z gwałtownie zmieniającą się częstotliwością powoduje u pacjentów najbardziej agresywne odczucia ze wszystkich prądów diadynamicznych. Nie należy stosować prądu CP u pacjentów zbyt wrażliwych lub w ostrym stadium schorzenia. Szczególnie wskazany jest dla pacjentów niezbyt wrażliwych lub opornych na terapię. Działając prądem CP uzyskuje się silne przekrwienie, prawdopodobnie wskutek wpływu na mechanizm pompy naczyniowo-mięśniowej, obniżenie napięcia mięśniowego, zmniejszenie bólu i zwiększenie resorpcji krwiaków i obrzęków. Prąd LP charakteryzujący się spokojnymi zmianami częstotliwości jest odczuwany przez pacjentów jako bardzo przyjemny. Stosowany jest u pacjentów bardzo wrażliwych, dla których prąd CP jest zbyt silny. Czas leczenia za pomocą prądów DD wynosi od 3 do 10 minut. Dłuższe czasy zabiegów mogą zwiększyć niebezpieczeństwo wystąpienia pieczenia. Zabieg leczniczy składa się z sekwencji prądów diadynamicznych np.: aplikacja prądem DF trwająca 1-2 minuty, następnie CP od 3 do 7 minut. Jeżeli pacjent jest bardzo wrażliwy lub dolegliwości są bardzo silne, prąd DF łączy się z prądem LP. Prądy diadynamiczne z bazą prądu galwanicznego (basis 2-4 mA) mają zwiększony efekt galwaniczny w tkankach, jakkolwiek równocześnie powodują nieprzyjemne odczucia pacjenta i niebezpieczeństwo wystąpienia uszkodzeń w skórze, w wyniku reakcji elektrochemicznych zachodzących pod katodą i anodą. Stosując każdy rodzaj prądu diadynamicznego, nawet przy niewielkim wzroście natężenia prądu, pacjent bardzo szybko odczuwa wrażenie mrowienia. Według Bernarda nie należy w czasie zabiegu zwiększać amplitudy stosowanego prądu, aby nie wywołać nieprzyjemnych odczuć. Należy raczej skrócić czas leczenia w wypadku wystąpienia adaptacji lub dobrać inną sekwencję prądów. Prąd MF występujący w postaci zmodulowanej (RS, MM) może być stosowany do stymulacji mięśni. Stymulacja mięśni wymaga wyższej amplitudy prądu, więc w związku z komponentem galwanicznym tego prądu, nie jest on raczej do tego celu wskazany.
Prądy diadynamiczne są szczególnie odpowiednie do leczenia dolegliwości małych stawów. Można je również stosować w terapii segmentarnej w leczeniu odruchowej dystorfii, czy w leczeniu półpaśca (herpes zoster).
TENS- PRZEZSKÓRNA ELEKTRYCZNA STYMULACJA NERWÓW
Większość ważnych odkryć dotyczących kontrolowania bólu za pomocą elektroterapii nastąpiło w latach 60-tych naszego stulecia po opublikowania w roku 1965 przez Ronalda Melzacka i Patricka Walla „teorii bramki kontrolnej”. Teoria ta pomogła naukowcom z prawie całego świata w badaniach wielu aspektów leczenia bólu. Z teorii „bramki” wynika prosta konkluzja, że selektywna stymulacja grubych i średnio-grubych włókien nerwowych powoduje hamowanie aktywności cienkich włókien nerwowych. Wall i Street rozwinęli różne sposoby terapii za pomocą prądów:
TENS- czyli elektrody umieszczone są na skórze ( prąd przechodzi z elektrod przez skórę bez przerwania jej ciągłości), nieinwazyjna technika,
PENS- elektrody igłowe umieszczone są w pobliżu dróg nerwowych,
pobudzające elektrody umieszczone w nerwie,
DCS- elektrody umieszczone w rdzeniu kręgowym.
Pierwsze próby zastosowania TENS:
Wall & Street: układali elektrody na skórze powyżej n. ulnaris i elektrody igłowe dla nerwów położonych głębiej. Parametry stymulacji: czas pulsu=0,1msec, f=100Hz → TENS tradycyjny: wysoka częstotliwość, niskie natężenie. Warunki konieczne do spowodowania zmniejszenia odczuć bólowych: odczuwanie mrowienia w obszarze bolesnym w czasie leczenia.
Shealy: DCS, technika inwazyjna, ryzykowna.
Andersson & Erikson: TENS niskiej częstotliwości: wysokie natężenie, niska częstotliwość, 1-5Hz; Burst: łańcuchy pulsów;
Melzack i współ.: hifi-TENS (wysoka częstotliwość i natężenie): f=100-150Hz, czas pulsu=0,15-0,25msec, czas zabiegu 5-15 minut.
RODZAJE TENS
Tradycyjny, wysokiej częstotliwości, definiowany jako ciągły nieprzerwany łańcuch generowanych z wysoką częstotliwością pulsów o krótkim czasie trwania i niskiej amplitudzie. Bardzo dobre rezultaty uzyskuje się przy f=60-100Hz i czasie impulsu 50-100 mikrosekund. Amplituda jest bardziej subiektywnym parametrem i powinna być tak dostosowana, aby pacjent odczuwał komfortowe wrażenie mrowienia, bez skurczu mięśni. Czas leczenia około 30 minut, cykl może być powtarzany. Niektórzy badacze twierdzą, że leczenie może trwać bez ryzyka do kilku godzin. Za pomocą tego rodzaju TENS-u stymulujemy grube i średnio-grube włókna nerwowe, co zamyka „bramkę” dla transmisji bólu przez cienkie włókna nerwowe.
Tens niskiej częstotliwości, stymulacja jak akupunktura, charakteryzuje się niskim zakresem częstotliwości, mniej niż 10Hz, optymalnie 2-4Hz z długim czasem pulsu 200 mikrosekund. Amplituda\natężenie najwyższe tolerowane przez pacjenta, powodujące widoczne skurcze mięśni. Ten typ stymulacji może działać na sekrecje endorfin, co tłumaczy dłuższy czas zmniejszenia odczuć bólowych u pacjentów.
Tens burst, bardzo podobny do wcześniejszego sposobu aplikacji. Dwa wybuchy impulsów na sekundę mają podobny skutek kliniczny jak dwa impulsy na sekundę. Szerokość serii impulsów w każdym wybuchu jest szersza niż szerokość pojedynczego impulsu, dlatego też natężenia konieczne do uzyskania widocznych skurczów jest mniejsze w Tensie typu burst niż w Tensie niskiej częstotliwości. Jest również lepiej tolerowany przez pacjentów. Efekty lecznicze utrzymują się około 4h w związku z wydzielaniem endorfin.
Brief intense Tens, podobny w charakterze do Tensu tradycyjnego, wysoka częstotliwość (100Hz), dłuższy czas impulsu (200mikrosekund), natężenie najwyższe tolerowane przez pacjenta, powoduje skurcze tężcowe oraz znieczulenia po około 15 minutach.
Tens modulowany, charakteryzuje się tym, że jeden z parametrów tzn. częstotliwość, szerokość pulsu lub natężenie pulsu jest modulowane. Ten sposób modulacji wywołuje wrażenia typu masażu. Czas zbiegu min. 15 minut.
Tabela 1. Porównanie parametrów prądów TENS .
|
Tens tradycyjny |
Tens niskiej częstotliwości |
Burst Tens |
Brief intense Tens „Hi- Fi” |
czas impulsu |
10-100μsec |
100-300μsec |
100-300μsec |
150-250μsec |
częstotliwość |
50-100Hz |
1-5Hz |
100-200Hz (w wybuchu) 2-4 wybuchy na sekundę |
60-100Hz |
Natężenie |
tylko odczuwalne, 3x próg wrażliwości |
próg tolerancji, 3-6x próg wrażliwości, powyżej progu motorycznego |
próg tolerancji, 3-6xpróg wrażliwości, powyżej progu motorycznego |
próg tolerancji, 3-6x próg wrażliwości, powyżej progu motorycznego |
czas leczenia |
od 30 minut do godzin |
20-45 minut |
20-45 minut |
15-20 minut |
ODDZIAŁYWANIE NA BÓL ZA POMOCĄ TENS
W systemie nerwowym znajdują się trzy poziomy, gdzie może zachodzić modulacja informacji bólowej:
poziom obwodowy receptorów włókien afferentnych,
poziom rdzeniowy w rogach tylnych,
poziom nadrdzeniowy lub centralny (twór siatkowaty, wzgórze, system limbiczny, przysadka mózgowa, kora).
Działanie na obwodowy system modulacji
Jeżeli ból ma być leczony przez wpływ na obwodowy system modulowania informacji bólowej, bardzo ważne jest, aby oddziaływać prądem na odpowiednie cienkie włókna nerwowe i hamować informację przez nie przewodzoną. Receptory bólowe wykrywają szkodliwą aktywność i wykazują również lokalne działanie troficzne. Ta podstawowa reakcja może zwalczyć szkodliwą stymulację. Silnej szkodliwej stymulacji może przeciwdziałać hamujące działanie wokół błony komórki nerwowej, co powoduje zablokowanie przewodnictwa nerwowego. W pracy Torebjork & Hallin wykazano, że podczas silnych przezskórnych elektrostymulacji maleje aktywność nerwów doprowadzających III i IV grupy, jak również szybkość przewodzenia. Silna stymulacja tworzy dużą liczbę potencjałów, co prowadzi do silnego wypływu jonów potasu. Zewnętrzna część błony komórki nerwowej zachowuje ładunek dodatni, aby czasowo nerw nie mógł być pobudzany. Mannheimer & Lampe nazwali to blokadą przewodzenia. Niektórzy autorzy porównują to z blokadą anodową znaną z terapii prądem wyprostowanym. Hamowanie powinno powstawać proksymalnie od miejsca skąd nerwy dostarczają informację bólową.
Konkluzja: opierając się na badaniach wpływ TENS na obwodowy system modulowania bólu jest ograniczony, ponieważ parametry tych prądów (natężenia i czas pulsu) są zbyt małe, aby aktywować blokowanie przewodnictwa nerwowego. Jedynie HIFI TENS (Brief intense) o długim czasie pulsu, wysokiej stałej częstotliwości, wysokim natężeniu i krótkim czasie stymulacji, może oddziaływać na ten mechanizm.
Działanie na rdzeniowy system modulacji
Oddziaływanie na rdzeniowy system modulacji będzie miało miejsce wówczas, jeżeli będziemy wybiórczo stymulować grube i średnio-grube włókna nerwowe. Zgodnie z teorią „bramki kontrolnej” pobudzenie włókien typu A wywiera efekt pobudzający na istotę galaretowatą (SG) na szczycie tylnego słupa rdzenia kręgowego. Ten z kolei za pomocą mechanizmu ujemnego sprzężenia zwrotnego jest w stanie hamować presynaptyczne przekazywanie impulsów z receptorów bólowych do komórek transmitujących T. Bramka zostaje zamknięta z powodu wysokiej aktywności włókien typu A. Wpływ przez stymulację za pomocą TENS jest mocniejszy jeżeli będziemy działać na odpowiedni segement i zastosujemy odpowiednie parametry TENS. Preferowane jest do wybiórczej stymulacji włókien typu A stosowanie wysokiej częstotliwości, krótkiego czasu impulsu i niskiego natężenia.
Działanie na centralny system modulowania bólu
Oparte jest na teorii, że w organizmie ludzkim istnieją naturalne opiaty (substancje tłumiące ból). Opiaty produkowane są przez przysadkę mózgową (betaendorfiny) i w rdzeniu kręgowym (SG w rogach tylnych). Enkefalina (peptyd składający się z pięciu aminokwasów) bardzo szybko działa likwidując na krótko ból, endorfina (30 aminokwasów) działa powoli, przedłużając likwidowanie bólu (czas stymulacji około 20 minut). Stymulacja centralnego systemu jest możliwa za pomocą TENS o określonych parametrach:
* czas pulsu musi być dostatecznie długi, co najmniej 0.1 msec, niektórzy autorzy wskazują dłuższy czas impulsu 0.5-1msec konieczny do stymulacji włókien IV grupy,
* częstotliwość niska, poniżej 10Hz,
* czas zabiegu od 20 do 45 minut, ale nie dłuższy, gdyż można spowodować wyczerpanie produkcji endorfin.
Również bardzo ważne dla aktywacji centralnego systemu modulacji bólu jest stymulowanie włókien czuciowych mających początek w mięśniach.
Wyciągając wnioski z badań Leandri i współautorów, należy stwierdzić, że stymulacja za pomocą TENS wyzwala lokalne rozszerzenie naczyń u pacjentów z powierzchownymi symptomami. Autorzy postulują, że lokalne pobudzenie rozszerzenia naczyń działa na ból, który jest wywołany przez trigger points. Fassbender dowodzi, że trigger points odnoszą się do małych, niedokrwionych powierzchni w tkance łącznej lub w mięśniach.
Inna teoria modulowania bólu za pomocą TENS odnosi się do akupunktury. Wykorzystując założenia medycyny chińskiej, leczenie punktów na meridianach (linie przepływu energii) stymuluje naturalne procesy zdrowienia, wyzwalając przepływ energii, co zmienia warunki powodujące ból. Współczesna badania dowodzą, że stymulacja tych punktów w leczeniu bólu jest bardziej skuteczna, niż stosowanie TENS na inne punkty ciała. (badania Norwega Kaada; punkt hogu między I a II kością śródręcza, meridian jelita)
Oddziaływanie na krążenie tkankowe
TENS powoduje możliwość oddziaływania na krążenie tkankowe (efekty pod i między elektrodami) i neurogeniczną regulację (wpływ przez sympatyczny układ nerwowy, skutki pojawiają się w pewnej odległości od elektrod).
Wpływ na autoregulację: wywoływanie skurczów mięśni wpływa na metabolizm (odpowiednie parametry prądu), działanie na obwodowy system modulowania infirmacji bólowej (axon reflex, substancje powodujące rozszerzenie naczyń-histamina).
Wpływ na regulację przez działanie na układ sympatyczny. TENS oprócz działania na systemy modulacji bólu, może również odruchowo wpływać na rdzeniowe i centralne mechanizmy regulujące krążenie. Na poziomie rdzeniowym: wpływ na aktywność rogów bocznych rdzenia kręgowego C8-L2; segmentarne ułożenie elektrod, bodziec powinien wchodzić do centralnego układu nerwowego na właściwym poziomie układu sympatycznego. Na poziomie nadrdzeniowym: elektrody powinny być umieszczone na stronie lub punktach, skąd jest zdolna transmisja afferentna.
CHARAKTERYSTYKA PARAMETRÓW TENS
Większość przezskórnych elektrycznych stymulacji nerwu ma charakter dwufazowy, ukształtowany w symetryczne lub asymetryczne pulsy. Obecnie stosuje się raczej pulsy o kształcie prostokąta.
Szerokość impulsu jest bardzo ważnym czynnikiem oddziaływującym na włókna nerwowe A beta. Badania kliniczne i testy laboratoryjne wykazały, że puls o szerokości 125 mikrosekund max. stymuluje włókna A beta, minimalne działając na włókna C i ruchowe. Częstotliwość pulsu jest innym bardzo ważnym parametrem niezbędnym dla optymalizacji stymulacji. Dla grubych czuciowych włókien nerwowych normalny zakres częstotliwości powodujący ich pobudzenie wynosi 50-100Hz. Wyższa częstotliwość może spowodować znużenie i nie zwiększa skutków stymulacji przeciwbólowej. Małe włókna nerwowe mogą być stymulowane przez niską częstotliwość 5-10Hz. Stąd też mamy podział na TENS wysokiej i niskiej częstotliwości.
Natężenie bodźca
Grube włókna nerwowe mają niższy próg pobudliwości niż cienkie włóna nerwowe, stopniowe zwiększanie od zera amplitudy bodźca (natężenia), powoduje najpierw pobudzenie większych a potem coraz mniejszych włókien nerwowych. Stąd też podstawową zasadą stosowania TENS w terapii bólu jest selektywne pobudzanie określonych włókien nerwowych. Bardzo istotne jest właściwe dawkowanie natężenia bodźca. Empirycznie stwierdzono, że natężenie stymulującego bodźca powinno się zwiększać do poziomu, który jest odczuwany jako brak komfortu, ale poniżej poziomu bólu. Może on wywoływać wrażenia mrowienia (jak w TENS-ie tradycyjnym) , ale nie powinny być one nieprzyjemne. Dla optymalizacji leczenia w czasie całego zabiegu odczuwanie stymulacji powinno być jednakowe. W TENS-ie niskiej częstotliwości natężenie jest na poziomie progu tolerancji wyzwalając rytmiczne skurcze mięśni.
WSKAZANIA
TENS służy do leczenia bólu w sensie aktywacji za jego pomocą mechanizmów systemu nerwowego kontrolujących ból. Jest to sposób bez ryzyka, nieinwazyjny, nieuzależniający i praktycznie bez efektów ubocznych. Pierwsze badania dotyczące skutków działania TENS wskazywały na 80-100% skuteczności, lecz ich wartość jest obecnie obniżona (efekt placebo) i staje się oczywiste, że TENS nie jest panaceum, gdyż efekt zmniejszenia bólu obniża się w czasie.
Wskazaniem do stosowania leczenia za pomocą TENS są zespoły bólowe, które można podzielić na bóle ostre i bóle chroniczne. Aktualność symptomów decyduje o tym jaki rodzaj TENS stosujemy do stymulacji. TENS może być również wskazaniem przed potencjalnie bolesnym leczeniem takim jak streching przykurczonych tkanek lub ran chirurgicznych.
PRZECIWWSKAZANIA I ŚRODKI OSTROŻNOŚCI
Istnieją okoliczności, które hamują i ograniczają stosowanie TENS. TENS jest absolutnie przeciwwskazany dla pacjentów z rozrusznikiem serca (zablokowanie rozrusznika). Ostatnio klinicyści podjęli próby zastosowania TENS z minitoringiem pacjenta (rozrusznik bipolarny) oraz dodatkowymi środkami ostrożności (bliskie umieszczenie elektrod, aby prąd nie rozpraszał się, elektrody umieszczone najdalej od serca, tak jak to jest tylko możliwe, (niskie natężenie). Umieszczenie elektrod nad zatoką szyjną może spowodować reakcję obniżenia ciśnienia. Ponieważ nie jest znane działanie TENS na embrion, nie należy stosować TENS u pacjentek w pierwszym trysemestrze ciąży. Ostrożność należy zachować również w następujących sytuacjach:
Przednia powierzchnia szyi. Stymulując ten obszar należy omijać zatokę szyjną.
Choroby serca. Należy unikać stymulacji przez klatkę piersiową.
Epilepsja. Należy unikać stymulacji na głowie i szyi pacjenta z epilepsją.
Na oczy. Skutek nieznany.
Powierzchnie śluzowe. TENS nie jest stosowany do leczenia tych powierzchni.
Nieodpowiedni pacjenci i dzieci.
Ubytki skóry.
Generalnie TENS jest bezpiecznym sposobem leczenia. Rzadko występujące szkodliwe skutki mogą wynikać z reakcji alergicznych na żel lub przylepce, złęj techniki aplikacji (utrata żelu, nieodpowiednie wyczyszczenie skóry, nierówny kontakt elektrod).
POSTĘPOWANIE LECZNICZE
OCENA PACJENTA.
wywiad medyczny,
etiologię bólu, wcześniejsze leczenie, leki,
charakterystykę, czas trwania, rodzaj, lokalizację bólu,
„mierzenie” bólu za pomocą skali bólu np. VAS.
wpływ czynników psycho- socjalnych,
określenie czynników ograniczających zdrowienie,
ocena fizykalna: zakres ruchu, chód, postawa, test czucia,
określić cele leczenia i prognozę,
określić plan leczenia, dostosować sposób leczenia i parametry lecznicze TENS (w zależności od oceny bólu na skali 0- 10).
0 - nie ma bólu; 10 - najgorszy ból, jaki można sobie wyobrazić
Skala 1-3 np. Tens ciągły impuls 0.1-0.3ms, częstotliwość 1-45Hz, lub Tens Hi-Fi, natężenie najwyższe tolerowane do uzyskania skurczu mięśnia..
Skala 4-7 np. Tens „burst” impuls 0.1-0.2 ms, częstotliwość pulsu 100Hz, częstotliwość uderzeń 2Hz, natężenie najwyższe tolerowane do uzyskania skurczu mięśnia.
Skala 8-10 np. Tens ciągły impuls 0.01-0.1 ms, częstotliwość 100Hz, natężenie najwyższe tolerowane, ale wrażenia czuciowe (mrowienie) nie mogą być odczuwane jako dyskomfort przez pacjenta.
po leczeniu ocenić jego skutki; kontynuować, jeśli są pozytywne, jeżeli nie, zastosować inne parametry, zmienić ułożenie elektrod, rodzaj TENS lub inna metoda lecznicza.
POSTĘPOWANIE Z PACJENTEM
wyjaśnienie sposobu postępowania, aby pacjent nie przejawiał lęku i skoncentrował się na leczeniu,
opisanie wrażeń związanych z leczeniem,
wyjaśnienie korzyści wynikających ze stosowanej terapii,
objaśnienie obsługi w przypadku indywidualnych elektrostymulatorów,
przygotowanie skóry pacjenta - oczyszczenie alkoholem,
dobór elektrod (kauczukowe, silikonowe, samoprzylepne, indywidualne)
DOBÓR UMIESZCZENIA ELEKTROD
lokalnie, obejmując obszar bolesny (artralgie, ischialgia, blizny pooperacyjne),
przykręgosłupowo (leczenie lokalnych problemów obszaru przyległego do krągosłupa, działanie segmentarne),
w specyficznych punktach stymulacyjnych:
* punkty stymulacyjne nerwu,
* punkty motoryczne,
* MTP (powierzchowne punkty spustowe),
* punkty akupunkturowe.
METODYKA ZABIEGU ( przygotowanie pacjenta jak wyżej, bezpośrednia identyfikacja lokalizacji nerwów obwodowych).
ZASTOSOWANIE TENS W RÓŻNYCH ZESPOŁACH BÓLOWYCH
Bóle pooperacyjne
Współcześnie wiele publikowanych doniesień i badań interesuje się zmniejszaniem bólu powstałego w wyniku operacji. Zastosowanie leków przeciwbólowych może spowodować powstawanie efektów ubocznych i opóźniać rehabilitację pooperacyjną. Zastosowanie stymulacji nerwów obwodowych dla zmniejszenia bólu pooperacyjnego może okazać się alternatywą w tego typu sytuacjach. Istnieją dowody na to, że zastosowanie TENS nie tylko zmniejsza bóle pooperacyjne, ale również komplikacje typu porażenna niedrożność jelita grubego czy niedodma, jak również zwiększa ruchliwość pacjenta i skraca czas okresu zdrowienia. Przed operacją pacjent powinien być poinformowany o potencjalnych korzyściach wynikających z zastosowania TENS oraz poinstruowany odnośnie obsługi aparatu. Leczenie za pomocą TENS rozpoczynamy bezpośrednio po operacji (pacjent przytomny, wybudzony z narkozy), stymulacja powinna trwać przez pierwsze 2 godziny. Po upływie tego czasu mijają skutki znieczulenia i pacjent jest zdolny opisać ból powstały w wyniku operacji oraz jego percepcję przy zastosowaniu stymulacji. Należy również dostosować natężenie, aby uzyskać optymalne wyniki. Pacjent nie może kontrolować natężenia w tym stadium leczenia. Stymulacja może być ciągła lub z przerwami: 2h stymulacja, 2h przerwa. Stosując sterylne, jednorazowe elektrody mogą być utrzymane w miejscu stymulacji do trzech dni. Stosując inne elektrody powinno się zmieniać miejsce ich przytwierdzenia na skórze, aby zapobiec ewentualnemu jej podrażnieniu. Trwająca trzy dni stymulacja, ciągła lub przerywana powinna dać zadawalające rezultaty w przypadkach pooperacyjnych. Dodatkową stymulację możemy stosować w trudniejszych stanach, lub jeżeli pacjenci życzą sobie zastosowania jej w programie rehabilitacji domowej. Należy bardzo dokładnie poinstruować pacjentów jak stosować stymulację TENS. Umieszczenie elektrod:
w przypadku operacji na klatce piersiowej: nad i pod blizną,
w przypadku operacji brzusznych: na wstępującej i zstępującej części okrężnicy.
Proponowany rodzaj TENS: wysoka częstotliwość, natężenie poniżej progu odczuwania bólu.
Carlsson w swej publikacji(1985, Painful scars after thoracic and abdominal surgery. Acta Chir Scand) opisał skutki działania różnych metod leczniczych (blokady znieczulające, TENS, resekcja blizn, termokoagulacja) u pacjentów mających dolegliwości z bolesnych blizn po operacjach brzucha i klatki piersiowej. Wyniki wskazują, że TENS jest bardzo skuteczny w zmniejszaniu odczuć bólowych i autorzy zalecają stosowanie ich wspólnie z psychoterapią w leczeniu tych przypadków.
Bóle szyi i barków
Bóle szyi i barków można podzielić na:
bóle głównie w szyi,
bóle szyjno-barkowe,
bóle głównie w barkach.
Badanie pacjenta, który uskarża się na którykolwiek z bóli musi obejmować szyję, korzenie nerwowe wychodzące z tego obszaru, łopatkę i obszar międzyłopatkowy, rejon klatki piersiowej, obojczyki i pachę. Jedną z wielu przyczyn wywołujących ostry ból szyi i barków jest wzmożonego napięcia odcinka szyjnego kręgosłupa wskutek nadmiernego wysiłku. Objawia się on wzmożonym napięciem mięśnia mostkowo-obojczykowo-suktowego i ból może być odczuwany za uchem. Charakterystyczne jest, że ból nie jest związany z rotacją , oraz tępe pobolewania są lokalizowane bardziej bocznie, niż dyskomfort w obszarze podpotylicznym. Wzmożone napięcie jest często jednostronne i rozciąga się poza wyrostek sutkowaty. Wzmożone napięcie wynikające np. z uszkodzenia splotu barkowego (wypadki samochodowe) jest bardzo oporne na terapię.
Zmiany zwyrodnieniowe w stawach odcinka szyjnego są charakterystyczne dla wieku średniego. Warte zauważenia jest, że jeśli nawet pacjent ma zmiany degeneracyjne odcinka szyjnego (RTG), może nie mieć żadnych symptomów bólowych, aczkolwiek wzmożone napięcie w wyniku urazu lub przeciążenia, stres, osłabienie chorobowe może wyzwalać ból.
Zmiany reumatyczne regionu szyjnego mogą wyzwalać bóle w obszarze szyjno-potylicznym. Ból ogranicza ruchomość odcinka szyjnego, może obejmować barki, mogą występować bóle głowy. Jest zwykle związany ze sztywnością, która zwiększa się w ciągu dnia. Bóle szyjne i szyjno-barkowe są opisywane jako bóle o charakterze tępym lub piekącym. Często bardzo trudno tym pacjentom zlokalizować ból, gdyż jest on rozlany. Czasami jest kłujący i szarpiący, może powodować mrowienia. Bóle barków plus bóle promieniujące mogą być spowodowane zmianami degeneracyjnymi dysków, kompresją na korzeń w otworach międzykręgowych, zmianami zwyrodnieniowymi kręgów (zespół korzeni szyjnych). Zmiany degeneracyjne dysków wywołują ból w szyi oraz bóle promieniujące do kończyny górnej. Ból może zwiększyć się jeśli pacjent wykona skłon w stronę, gdzie jest uszkodzony dysk, oraz zmniejszyć się, gdy wykona skłon w stronę przeciwną. Pacjenci ci mają przerywane ataki dyskomfortu, które zmniejszają się po odpoczynku i zastosowaniu tradycyjnego leczenia typu: kołnierz ortopedyczny, ciepłe okłady, masaż, iniekcje do punktów spustowych, leki znieczulające, leki przeciwzapalne, relaksację mięśni. Zastosowanie stymulacji za pomocą TENS wybitnie skraca czas trwania dolegliwości bólowych. Najbardziej efektywne ułożenie elektrod: centralnie na poziomie C5-C7 i proksymalnie po stronie, gdzie jest odczuwany ból (folie). Dobór sposobu leczenia zależy od stanu pacjenta (ból ostry lub przewlekły).
Bóle dolnego odcinka kręgosłupa
Bóle dolnego odcinka kręgosłupa są najbardziej powszechną dolegliwością, z jaką zgłaszają się pacjenci do lekarzy i fizjoterapeutów. Kluczem do sukcesu jest niewątpliwie właściwa diagnoza i ocena pacjenta, co pomaga zmniejszyć dolegliwości. Problemy powstają w wyniku niepoprawnej diagnozy lub nie brania pod uwagę czynników psychologicznych czy socjologicznych. Poważne niepowodzenia wynikają również z faktu, że pacjenci nie przestrzegają zaleceń lekarskich, nie poddają się rehabilitacji, która mogłaby pomóc im w zmniejszeniu dolegliwości bólowych, oraz nie akceptują czynników psychologicznych, pełniących ważną rolę w odczuwaniu przez nich bólu. Zaburzenia dolnego odcinka kręgosłupa i wzmożone napięcie mięśni dolnego odcinka kręgosłupa jest generalnie związane z podnoszeniem ciężkich przedmiotów, upadkiem, nagłym hamowaniem w wypadkach samochodowych. Tacy pacjenci mają ostry dyskomfort i przybierają nieprawidłową pozycję w wyniku napięcia mięśni krzyżowo-kręgosłupowych. Ból lokalizowany głównie w dolnym odcinku lędźwiowym zmniejsza się wyraźnie po odpoczynku. Protrusja, czyli wysunięcie ku przodowi krążków międzykręgowych jest obecnie uważana za główną przyczynę ostrych i chronicznych oraz nawracających bóli dolnego odcinka kręgosłupa i bóli kończyn dolnych. Sytuacja ta powstaje szczególnie między L5 a S1, dużo rzadziej między wyższymi partiami lędźwi. Przyczyną może być uraz zgięciowy, ale istnieje wiele nieurazowych przyczyn tych dolegliwości min. degeneracja więzadeł tylnych kręgosłupa. Degeneracja tylnych więzadeł kręgosłupa i pierścienia włóknistego powstająca głownie u ludzi w starszym wieku, może mieć charakter utajniony, bądź też manifestować się łagodnym, przerywanym bólem w odcinku lędźwiowym. Kichnięcie, przechylenie się na jedna stronę lub inne dziwne ruchy mogą powodować wysuwania się jądra miażdżystego i osłabienie tylnej części pierścienia włóknistego. Rozwinięty pełny zespół chrateryzuje się bólem dolnego odcinka kręgosłupa, nienormalną postawą i ograniczeniem ruchomości, szczególnie zgięcia. Zajęcie korzenia grzbietowego jest wskazywane przez bóle promieniujące, zaburzenia czucia, drgania pęczkowe mięśni, wzmożone napięcie mięśniowe, osłabienie odruchu ścięgnistego. Chrakterystyczny wzorzec symptomów bólowych może być wykorzystany dla określenia poziomu uszkodzenia. Uszkodzenie piątego korzenia lędźwiowego wyzwala ból w rejonie biodra, pachwiny, tylno-bocznej części uda, bocznej części łydki, kostki zewnętrznej, grzbietowej części stopy, I, II, III palec. Uszkodzenie pierwszego korzenia krzyżowego wyzwala ból w środkowej części pośladka, tylnej części uda, tylnej części łydki do pięty, podeszwowa powierzchnia stopy, IV i V palec. Bóle od łagodnych do bardzo ostrych i dokuczliwych.
Inną dużą grupę przyczyn dolegliwości dolnego odcinka kręgosłupa stanowią arthritis. Ból powstaje w późniejszym okresie życia, obejmują jakąś część kręgosłupa, skoncentrowany jest głównie wokół kręgosłupa, zwiększa się w czasie ruchu, związany ze sztywnością i ograniczeniem ruchomości. Zwykle zmniejsza się po odpoczynku. Leczenie za pomocą TENS daje szczególnie doskonałe rezultaty w ostrej fazie, gdy występuje wzmożone napięcie mięśni, powodując wręcz natychmiastowe zmniejszenie napięcia, szybką kontrolę bólu i przyspieszenie zdrowienia. Największe korzyści przynosi stosowanie stymulacji TENS przez pierwsze trzy dni trwania dolegliwości z właściwą instrukcją dotyczącą wykonywania ruchów i aktywności pacjenta. Wiele współczesnych doniesień mówi o skutkach leczenia bólów chronicznych spowodowanych wzmożonym napięciem. U około 50% pacjentów dolegliwości zmniejszają się na kilka dni, u 20% na około 2 lata (ze względu na ograniczoną liczbę pacjentów kontynuujących leczenie). Przykładowe leczenie: Ischialgia, ból chroniczny, powstały w połączeniu z selektywnością układu nerwowego.
Cele: zmniejszenie bólu, stworzenie warunków do ćwiczeń leczniczych.
Stymulacja jednokanałowa, jedna elektroda umieszczona przykręgosłupowo na poziomie S1-S2 po stronie bólu, druga na punkcie N. tibialis w dole podkolanowym.
W przypadku niskiej aktualności symptomów stosujemy Brief intense TENS (HIFI), który dość szybko i odpowiednio zmniejsza ból.Parametry, standardowe dla tego typu TENS (mogą różnić się w niewielkim zakresie w zależności od producenta aparatury), natężenie do poziomu tolerancji, bardzo ważne jest uzyskanie skurczów w rejonie łydki, skutek po 10 minutach; w czasie terapii ruchem można kontynuować stymulację.
Artrozy
Zależnie od etiologii można podzielić na pięć dużych grup: infekcje, degeneracje, pourazowe, metaboliczne, o nieznanej etiologii. Schorzenia reumatyczne i infekcje stawowe obejmują głównie błone maziową i struktury okołostawowe. Osteoartritis głównie zajmuje kości i chrząstki, ból w czasie ruchu, zmniejsza się po odpoczynku, sztywność poranna, lokalizacja: dystalne stawy palców, kolana, biodra, kręgosłup. Reumatyczne zapalenia stawów obejmuje proksymalne stawy międzypaliczkowe, śródręcznopaliczkowe, stawy palców nóg, nadgarstki, stawy skokowe, łokcie, kolana, biodra i barki. Początek choroby jest podstępny z występującym zmęczeniem, parastezjami w kończynach, bólami stawów i sztywnością. Ból wzmaga się przy ruchach, zmniejsza po odpoczynku. Stosując TENS uzyskiwane są w różnym stopniu efekty pozytywne. Proponuje się układanie elektrod w pobliżu obszaru występowania dolegliwości bólowych.
Bóle powstające w wyniku odcięcia bodźców z danego narządu (deaferentecja)
Uszkodzenie nerwów prowadzące do trwałego uszkodzenia obwodowych nerwów czuciowych wyzwala zespoły bólowe, zwykle są klasyfikowane jako bóle deaferentecyjne. Zespoły te powstają z uszkodzeń, chorób związanych z degeneracją nerwów lub wyniku interwencji chirurgicznej z powodu uszkodzenia nerwu. Są to neuralgiczne zespoły bólowe obejmujące kikuty i bóle fantomowe kończyn, kauzalgie, neuralgie poopryszczkową, neuralgie nerwu trójdzielnego. Powstawanie bólu może mieć różne przyczyny, uszkodzenie nerwów i degeneracja jest jedną z nich. Parry (1981) dowodzi w swych badaniach, że u 65% pacjentów z pourazowym uszkodzeniem nerwów obwodowych uzyskuje się znaczne zmniejszenie dolegliwości bólowych po zastosowaniu TENS wysokiej częstotliwości. Elektrody powinny być umieszczone proksymalnie od poziomu uszkodzenia.
Przykładowe leczenie: Herpes zoster (półpasiec)
Cel leczenia: zmniejszenie bólu,
W przypadku wysokiej aktualności symptomów i nieselektywnego działania systemu nerwowego stosujemy łagodne impulsy: TENS tradycyjny, dwu-kanałowa stymulacja, lokalne ułożenie elektrod obejmujące obszar bólu, krótki czas impulsu, wysoka częstotliwość, natężenie podprogowe; długi czas trwania stymulacji, 1h z 1h przerwy, ciągła stymulacja w nocy w czasie snu. Herpes zoster neurogenicznym zaburzeniem powstającym w wyniku uszkodzenia włókien czuciowych w zwojach nerwowych rdzenia kręgowego. Zajęte są szczególnie grube włókna nerwowe. Neuralgia powstająca w wyniku półpaśca obejmuje głównie dermatomy i trwa około 30 dni po powstaniu wykwitów skórnych. Stymulacja włókien grupy II i o niskim progu włókien grupy III na obwodzie neuralnego uszkodzenia (zwoje nerwowe) może prowadzić do aktywności włókien typu IIIb i IV; lokalne umieszczenie elektrod może zwiększyć odczucia bólowe. W tym przypadku preferowane jest umieszczenie elektrod w sąsiadujących segmentach ( afferentne wejście przez drogę Lissauera, mrowienie w obszarze bólu nie jest możliwe). W przypadku selektywności systemu nerwowego, może być aktywowany centralny system modulacji bólu; segmentarna stymulacja nie jest konieczna, możemy stymulować specyficzne punkty stymulacyjne, oddalone, ale związane z obszarem bólu.
Neuralgia nerwu trójdzielnego
Rozróżnia się dwa rodzaje neuralgii: specyficzna i niespecyficzna. W specyficznej neuralgii, występującej w starszym wieku, delikatny dotyk pewnych punktów na twarzy (zwykl zlokalizowanych wokół nosa i ust) wywołuje intensywny ból spowodowany przez kurcz mięśni. Niespecyficzna lub nietypowa neuralgia powstaje w młodym wieku; związana jest z urazem twarzy lub uszkodzeniem jednej z gałązek nerwu trójdzielnego. Obserwacje i badania Eriksona (1984) wskazują, że TENS (wysokiej częstotliwości lub Burst) może być alternatywną metodą w stosunku do leczenia chirurgicznego w leczeniu specyficznej neuralgii oraz daje satysfakcjonujące wyniki w leczeniu nietypowej neuralgii. FOLIE.
Bóle fantomowe
W kontroli bólu fantomowego duże sukcesy uzyskano stosując TENS HIFI. Elektrody należy umieszczać na bolesne trigger points, związane z nerwami obwodowymi i segmentami rdzenia kręgowego unerwiającymi obszar bolesny. U niektórych pacjentów pomocna jest kontrlateralna stymulacja, jak również umieszczania elektrod na skórze razem z protezą.
Bóle naczyniowe
Pacjenci mogą się uskarżać na bóle, których źródło jest związane z naczyniami (patologiczne procesy toczące się w ścianach naczyń). Arterioskleroza dużych i średnich tętnic jest bardzo powszechną chorobą naczyń u mężczyzn, jej symptomy są wyzwalane przez ćwiczenia (chromanie przestankowe), ale mogą również powstawać w czasie odpoczynku (ischemiczny ból). Pierwszy, obejmujący głównie łydki i uda zmniejsza się w czasie odpoczynku, drugi zwiększa się szczególnie w nocy i całkowicie lub częściowo zmniejsza w czasie ćwiczeń (zlokalizowany w stopach i palcach, często występuje z owrzodzeniami i gangreną). Inną częstą lokalizacją bólu naczyniowego są ściany żył. Różne stany zapalne powierzchownych i głębokich żył mogą powodować bóle w kończynach. Przy zajęciu żył powierzchownych zajęty obszar jest wrażliwy i twardy, powyżej leżąca skóra jest opuchnięta i zaczerwieniona. Przy zajęciu żył głębokich, zwykle ból jest tępy i długotrwały, może wystąpić opuchlizna i\lub brązowe zabarwienie. Zazwyczaj symetryczne zaburzenie o nieznanym pochodzeniu jest chorobą Reynaud's (nerwica naczyniowa). Głównie występuje u młodych kobiet, a zimno i bodźce emocjonalne są czynnikami wyzwalającymi reakcję w palcach rąk, rzadziej stóp. Stają się one białe, potem niebieskie i w końcu czerwone (trójfazowa kolorowa reakcja). W czasie niedotlenienia występują ból i parastezje. Powtarzające się długotrwałe napady i wtórne następstwa przewlekłego niedokrwienia mogą prowadzić do zaburzeń troficznych. Od choroby Raynaud's odróżnia się zespół lub objaw Raynaud's, który może towarzyszyć wielu chorobom, może je wyprzedzać i być tak silny, że maskuje chorobę podstawową. Występuje u obu płci i zdarza się częściej u kobiet. Może występować w kolagenozach, w chorobach organicznych naczyń obwodowych (miażdżyca zarostowa tętnic, zakrzepowo-zarostowe zapalenie naczyń), w chorobach układu nerwowego (jamistość rdzenia), w zatruciach metalami ciężkimi, w chorobie wibracyjnej, w nowotworach złośliwych.
Po zastosowaniu leczenia za pomocą TENS zwiększa się dystans, który mogą przejść pacjenci i zmniejszają się dolegliwości bólowe. Roberts (1979) zastosował TENS u 39 chorych z zakrzepowym zapaleniem żył w kończynach dolnych. Elektrody były umieszczone poza bolesnym segmentem żył i na nerwach obwodowych. Zastosował Tens tradycyjny, czas zabiegu 30-60 minut, 3-4xdziennie, przez okres 1-3 dni. Duże zmniejszenie odczuć bólowych uzyskano u 32 pacjentów, u 3 niewielkie, u 4 nie uzyskano zmniejszenia bólu. Pacjenci byli ostrzeżeni, aby bezpośrednio po stymulacji nie rozpoczynać gwałtownie aktywności, lecz przechodzić do niej stopniowo. Kaada (1982) donosi, że Tens niskiej częstotliwości daje dobre wyniki w leczeniu pacjentów mających dolegliwości z powodu zjawiska Raynaud's. Tens stosowano na akupunkturowy punkt zwany HO-QU, i uzyskano obwodowe rozszerzenie naczyń ze zwiększeniem temperatury skóry o 7-10 stopni C w zimnych kończynach górnych. Zwiększenie temperatury trwające od 4 do 8 godzin związane było również ze zmniejszeniem ischemicznego bólu.
Leczenie ran
Pojawienie się owrzodzeń w wyniku arteriosklerozy lub cukrzycy jest częstym stanem w starszym wieku. U większości pacjentów symptomy są łagodne, lecz u około 10% prowadzą do gangreny. Ratunkiem jest rekonstrukcja naczyń lub amputacja. Współczesne badania wskazują, że TENS i inne metody elektrostymulacji są alternatywną metodą w leczeniu owrzodzeń nóg. Lundenberg i współ.(1988) uzyskał dobre efekty stosując TENS wysokiej częstotliwości u chronicznych cukrzyków z owrzodzeniami na nogach. Elektrody były umieszczane powyżej owrzodzenia, w odpowiednim dermatomie. Stymulacja trwała co najmniej dwa razy dziennie po dwie godziny z natężeniem czterokrotnie przywyższającym próg czucia. Stosując HVS małą elektrodę anodę umieszczamy na ranie, dużą katodę po przeciwnej stronie anody, 1h dwa razy dziennie; przy stagnacji procesu zdrowienia - katoda na ranę. Zastosować sterylną gazę zamoczoną w solach fizjologicznych.
Bóle głowy
Bóle głowy mogą mieć naczyniowy charakter, wynikać z przykurczu mięśni lub mieć charakter epizodyczny. Symptomy bólowe od łagodnych, tolerowanych i dających się kontrolować przez proste analgetyki, do totalnego bólu uniemożliwiające funkcjonowanie. Najbardziej powszechnym bólem o podłożu naczyniowym jest migrena. Epizodyczne bóle powstają w jakimś miejscu głowy, wyzwalany przez zmęczenie, niepokój, lęk czy stres oraz bezsenność. Zmniejszają się po odpoczynku lub zażyciu słabych leków przeciwbólowych. W większości przypadków nie jest konieczna konsultacja z lekarzem. Przykurcze mięśni wywołujące bóle głowy, mogą powstawać wtórnie pod wpływem różnych zaburzeń: dysfunkcji stawu skroniowo-żuchwowego, zaburzeń odcinka szyjnego kręgosłupa, urazu, zapaleń nosowych i przynosowych, zapaleń wtórnych do systemowych zaburzeń (infekcje wirusowe). Wiele trudności w terapii sprawiają bóle chroniczne głowy. W literaturze występuje mało doniesień dotyczących specyficznego zastosowania TENS w bólach głowy. Shealy (1976) proponuje umieszczanie elektrod nad nerwem occipitalis z natężeniem powodującym parastezje z potylicy do wierzchołka głowy. Jeżeli ten sposób nie przynosi efektów pozytywnych, proponuje się stymulację czoła lub skroni. Najlepsze wyniki osiąga się, kiedy rozpoczynamy stymulację zaraz po rozpoczęciu ataku bólowego.
Bolesne miesiączki
Bolesne miesiączki są problemem około 10% kobiet. Ból często jest tak uporczywy, że powoduje pozostanie w łóżku 1-2 dni, lub nawet absencję w szkole lub w pracy. Zastosowanie niefarmakologicznych sposobów leczenia bez ich skutków ubocznych ma dużą wartość dla pacjentek. Lampe i Mannheimer (1984) badali skuteczność TENS w grupie 27 studentek, dzieląc je na grupę kontrolną, grupę z TENS wysokiej częstotliwości i grupę z TENS niskiej częstotliwości. Wyniki badań wskazują, że w grupie z TENS wysokiej częstotliwości u 72% studentek nastąpiło zmniejszenie dolegliwości trwające około 4h, w grupie z TENS niskiej częstotliwości u 52% , trwające około 2,5h.
Bóle porodowe
Tens stosowane są z dużym powodzeniem do kontroli bólu w czasie porodu. Proponuje się układanie par elektrod przykręgosłupowo: jedna para na poziomie T10-L1 w pierwszej fazie porodu, i na poziomie S2-S4 w drugiej fazie. Autorzy różnie oceniają skuteczność zabiegu, na ogół u około 50% pacjentek następuje bardzo dobra kontrola bólu, u około 25-30% zmniejszenie do łagodnych dolegliwości bólowych. Badania prowadzone przez Tischendorfa (1986) na 78 pacjentkach, przy zastosowaniu stymulacji na poziomie T10-L2, wskazują, że dzięki TENS można skrócić czas porodu.
Bóle nowotworowe
Współcześnie prowadzone badania kliniczne w celu ulepszenia metod kontrolowania bólu w chorobach nowotworowych, zmniejszenia skutków ubocznych leków przeciwbólowych, prowadzą do wniosku, że można zastosować inny rodzaj terapii analgetycznej. Taką szansą jest zastosowanie stymulacji Tens, jako metody niefarmakologicznej (we współpracy z lekarzem).
Urazy sportowe
W ostatnich latach wzrosło zainteresowanie stosowaniem TENS w medycynie sportowej. TENS jest generalnie stosowany w kombinacji z innymi metodami leczniczymi dla ułatwienia skuteczności programu rehabilitacyjnego. TENS stosujemy oczywiście do leczenia bólu w urazach sportowych. Jednak nie powinien być stosowany w sytuacjach fizycznego stresu zwiększającego wytrzymałość, gdzie ból jest sygnałem ostrzegawczym przed przeciążeniem. Jakkolwiek po cyklu ćwiczeń fizycznych można go stosować do zmniejszenia bólu mięśni i zmęczenia.
STYMULACJA WYSOKONAPIĘCIOWA
Prąd wysokonapięciowy, zwany również HVPC (wysokonapięciowy prąd impulsowy), HVS (stymulacja wysokonapięciowa) jest to jednofazowy prąd impulsowy, charakteryzujący się występowaniem bliźniaczych impulsów o bardzo krótkim czasie trwania, mniejszym od 0.1ms. .
Rysunek 4. Prąd wysokonapięciowy.
Częstotliwość podwójnych impulsów może być różnorodna, najczęściej od 1 do 120 Hz. Bardzo krótki czas bliźniaczych impulsów wymaga użycia wysokiego napięcia (do 500V) w celu wytworzenia odpowiedniego prądu, powodującego stymulację nerwów. Wartość szczytowa prądu wynosi około 2500 mA, powstający w tkance w czasie sekundy prąd średni osiąga maksymalną wartość tylko około 1,2-1,5 mA. W warunkach klinicznych stosuje się woltaż o wartości poniżej 500V. Powstający w czasie zabiegu prąd szybko jest rozpraszany w tkance i nie ma wpływu na zmianę wartości współczynnika ph w skórze. W praktyce należy pamiętać o tym, że zwiększając ilość impulsów na sekundę, należy ostrożnie dawkować amplitudę prądu wysokonapięciowego. Stymulatory wysokonapięciowe wytwarzają więc relatywnie wysoką wartość szczytową prądu w bliźniaczych impulsach z niskim apmerażem prądu średniego. W rzeczywistości powstały prąd pozwala na uzyskanie relatywnie głębokiej penetracji, bez niebezpieczeństwa powstania w skórze uszkodzeń elektrochemicznych. Na głębokość penetracji prądu wysokonapięciowego ma wpływ nie tylko wartość szczytowa prądu, która jest proporcjonalna do głębokości penetracji, ale również przewodnictwo elektryczne tkanek organizmu ludzkiego. Jest ono tym większe, im więcej jonów zawiera tkanka. Oporność skóry zmniejsza się poprzez zastosowanie podkładów zwilżonych w 0,1 do 0,5 % roztworze wody z solą kuchenną lub poprzez ogrzanie miejsca aplikacji. Zdolność penetracji prądu wysokonapięciowego nie ogranicza się jedynie do selektywnego pobudzenia obwodowych włókien nerwowych i mięśni szkieletowych. Działa również na mięśnie gładkie i gruczoły organów wewnętrznych bezpośrednio, lub przez autonomiczne włókna nerwowe.
Terapia HVS stosowana jest w leczeniu trudno gojących się ran, w celu zmniejszenia bólu ostrego i chronicznego, zmniejszenia napięcia mięśniowego, opuchlizny, w stymulacji mechanizmów krążenia oraz w elektrostymulacji celu reedukacji i wzmocnienia mięśni. Ze względu na nieznaczne zmiany chemiczne prąd ten nie ma zastosowania w zabiegu jonoforezy.
Impulsowy prąd wysokonapięciowy płynie między każdą elektrodą czynną (leczniczą) i większą elektrodą bierną. Prąd nie płynie między elektrodami czynnymi. Istnieją różne sposoby jego wytwarzania, w zależności od efektów terapeutycznych. Najczęściej spotyka się w elektrostymulatorach wysokonapięciowych trzy podstawowe sposoby emisji prądu:
tryb ciągły, co oznacza, że pacjent w czasie zabiegu jest stymulowany nieprzerwanie prądem o określonej częstotliwości; wskazany do leczenia dolegliwości w stanie ostrym;
tryb włączania „switch”, w czasie stymulacji prąd jest włączony lub wyłączony pod jedną lub wieloma elektrodami czynnymi; wskazany dla leczenia opuchlizny, modulacji bólu, stymulacji tkanki nerwowej; najczęściej stosowane czasy w trybie włączenia wynoszą 2.5, 5.0 i 10.0 sekund.
tryb „falujący”, w czasie stymulacji przepływ prądu jest przerywany pod wszystkimi aktywnymi elektrodami w regularnych cyklach czasowych, co powoduje jego „falowanie”; wskazany do reedukacji mięśni lub elektrostymulacji w celu wzmocnienia mięśni.
Bardzo ważnym czynnikiem bezpośrednio wpływającym na terapeutyczne efekty stymulacji wysokonapięciowej jest częstotliwość powtarzania bliźniaczych impulsów, która określa ile razy na sekundę tkanki ciała są stymulowane w czasie leczenia. Częstotliwość 15 Hz i wyższa stosowana jest w celu uzyskania w czasie stymulacji skurczów tężcowych. Siła skurczu tężcowego zależy od ilości stymulowanych włókien mięśniowych lub jednostek motorycznych. Skurcze tężcowe można wywoływać w mięśniach, jeżeli minął stan ostry, działając częstotliwością od 70-110 Hz lub 15-20 Hz, ale w tym wypadku konieczna jest wyższa intensywność prądu oraz zastosowanie trybu włączania [2.5 lub 5.0 lub 10.0 sekund]. Dużo uwagi w procesie leczenia urazów mięśni należy poświęcić zwiększaniu wytrzymałości osłabionych mięśni, ścięgien i więzadeł. Podstawową zasadą elektrogimnastyki i reedukacji mięśni jest stosowanie ujemnej polaryzacji pod elektrodą czynną, częstotliwości około 100Hz i falowania prądu. Czas, w którym prąd nie płynie, określany jako „surge off” powinien być co najmniej trzykrotnie dłuższy niż czas, w którym prąd działa na tkankę mięśniową „surge on”. Sekwencja ta zabezpiecza stymulowane mięśnie przed zmęczeniem. W przypadku reedukacji mięśni w chorobach CUN należy wykorzystywać niższy zakres częstotliwości około 15 Hz. HVS nie ma klinicznej wartości w terapii pacjentów z uszkodzeniem nerwów obwodowych z reakją wskazującą całkowite odnerwienie.
HVS wykorzystywana jest również w leczeniu bólu. Zmniejszenie dolegliwości bólowych poprzez mechanizmy „bramki kontrolnej” osiąga się dzięki zastosowaniu częstotliwości w zakresie 70-110 Hz oraz intensywności zwiększanej się do poziomu reakcji czuciowych. W czasie pierwszych dwóch, trzech zabiegów wskazane jest, aby elektrodą czynną, umieszczoną w obszarze bólu była anoda. W czasie kolejnych zabiegów należy zmienić polaryzację na ujemną. Działając na punkty spustowe lub akupunkturowe, elektrodą czynną zawsze jest katoda. HVS o niskiej częstotliwości [najczęściej 5Hz] i wysokiej intensywności działa przeciwbólowo poprzez zwiększenie produkcji endogennych substancji tłumiących ból, czyli endorfin. Uważa się jednak, że zastosowanie stymulacji wysokonapięciowej w celu produkcji endorfin nie jest tak skuteczne, jak w czasie stymulacji niskonapięciowej. Wielu terapeutów osiąga bardzo dobre efekty lecznicze, szczególnie w bólach chronicznych, stosując terapię kombinowaną łącząc HVS z ultradźwiękami.
Doświadczalnie wykazano, że HVS w niewielkim zakresie powoduje zwiększenie mikrokrążenia w rozumieniu odruchowego skutku w następstwie pobudzenia nerwów autonomicznych. HVS wykazuje dużą skuteczność w zmniejszaniu opuchlizny. Ponieważ jest to prąd impulsowy, w czasie stymulacji powstaje efekt pompy naczyniowo- mięśniowej, szczególnie skuteczny w leczeniu pourazowej opuchlizny, występującej w stanie ostrym. Zabiegi można łączyć z zimnymi okładami. Jeżeli terapia obejmuje stopę lub dłoń można ją wykonywać w zimnej wodzie. W przypadku leczenia opuchlizny chronicznej stymulację wysokonapięciową można wykonywać w ciepłej wodzie (stopa, dłoń). Wpływ polaryzacji na skuteczność HVS w zmniejszaniu opuchlizny nie jest znana. Uważa się, że w tym przypadku powinno stosować się ujemną polaryzację, ze względu na większa szybkość depolaryzacji błony komórkowej nerwów i mięśni pod katodą niż anodą, przy tej samej intensywności prądu. Sugeruje się, że zastosowanie katody jako elektrody czynnej pozwala na przesunięcie protein o ładunku ujemnym z przestrzeni śródmiąższowej do naczyń limfatycznych. Aby ocenić wpływ polaryzacji na skuteczność stymulacji wysokonapięciowej w zmniejszaniu opuchlizny konieczne są dalsze badania w tym zakresie. Elektryczna stymulacja wywołująca skurcze mięśni szkieletowych wzmaga odpływ żylny i limfatyczny, co w konsekwencji prowadzi do zmniejszania opuchlizny. Klinicznie należy sprawdzić hipotezę, czy agresywne formy stymulacji wywołujące skurcze mięśniowe nie będą bardziej skuteczne od dotychczas stosowanej stymulacji na poziomie reakcji czuciowej.. Z doświadczeń klinicznych wynika również fakt, że skutki terapii wysokonapięciowej są krótkotrwałe, dlatego też zabiegi powinny być powtarzane odpowiednio często.
W literaturze światowej istnieje wiele doniesień informujących o skuteczności terapii prądem wysokonapięciowym w przyspieszeniu tempa leczenia trudno gojących się ran. Naukowcy twierdzą, że do barier ograniczających prawidłowy proces gojenia ran należy zaliczyć nieprawidłowe mikrokrążenie, brak odpowiedniego potencjału elektrycznego w ranie, infekcje bakteryjne i przedłużający się ucisk w przestrzeni śródmiąższowej w wyniku występującej opuchlizny. Elektryczna stymulacja może przyspieszyć gojenie dzięki wytworzeniu odpowiedniej energii elektrycznej, która minimalizuje lub nawet odwraca niekorzystne działanie barier ograniczających prawidłowe gojenie ran. Energia elektryczna działa na krążenie krwi w tkankach bezpośrednio otaczających ranę, wytwarza pozytywny potencjał w łożysku owrzodzenia, co korzystnie wpływa na regenerację tkanek. Znane jest bakteriostatyczne działanie energii elektrycznej na środowisko rany oraz efekt katoforezy, dzięki któremu proteiny przesuwane są do naczyń limfatycznych. W warunkach laboratoryjnych in vitro badano hamujący wpływ HVS na wzrost bakterii najczęściej izolowanych z otwartych ran- Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa. HVS o intensywności większej niż 250V przy ujemnej polaryzacji elektrody czynnej, w czasie co najmniej dwóch godzin powoduje hamowanie wzrostu badanych bakterii.
Opierając się na doniesieniach literatury najczęściej w celu przyspieszenia tempa gojenia ran stosuje się częstotliwość 50-100Hz, intensywność od 100 do 175 V, bez wywoływania skurczów mięśniowych. Optymalny poziom prądu w czasie aplikacji wynosi od 0.5mA do 1.0 mA. Zabiegi wykonuje się w czasie od 20 do 45 minut raz dziennie lub 30 minut dwa razy dziennie. Protokoły lecznicze stosowane w licznych badaniach klinicznych są niestety bardzo różnorodne. Wielu klinicystów uważa, że w ciągu pierwszych trzech do siedmiu dni, ze względu na infekcje bakteryjne, ranę należy stymulować ujemną polaryzacją w stosunku do elektrody biernej. Jeżeli rana osiągnie aseptyczność, polaryzację zmienia się na dodatnią. Inni badacze stosowali początkowo dodatnią polaryzację lub zmieniali ją w określonych cyklach czasowych w czasie trwania zabiegu. Kliniczne próby wykazały, że stymulacja wysokonapięciowa wyraźnie skraca czas leczenia ran w porównaniu ze standardowym sposobem terapii. Wykonując zabiegi za pomocą stymulacji wysokonapięciowej wskazane jest używanie elektrod giętkich, ze względu na większą możliwość dostosowania do kształtu powierzchni leczonej. Bardzo ważna jest odpowiednia odległość elektrody czynnej od biernej. Im jest bliższa ich odległość, tym mniejsza jest głębokość penetracji prądu wysokonapięciowego. W czasie zabiegu można stosować równocześnie jedną, dwie, trzy lub cztery elektrody czynne, w zależności od tego, czy terapeuta chce stymulować specyficzne punkty czy większą powierzchnię. W technice jednobiegunowej duża elektroda bierna połączona jest z kilkoma elektrodami czynnymi, o mniejszej, niekoniecznie jednakowej powierzchni. Ten sposób stymulacji można na przykład stosować w celu zmniejszenia wzmożonego napięcia wstępującej części mięśnia czworobocznego, w stymulacji głębiej położonych nerwów lub w elektrogimnastyce mięśni. W technice dwubiegunowej elektrody czynna i bierna mają ten sam rozmiar. Metoda ta wskazana jest do stymulacji raczej pojedynczych mięśni, niż grup mięśniowych. Elektrody układa się w specyficznych punktach stymulacyjnych (punkty stymulacyjne nerwu, punkty motoryczne, punkty spustowe), przykręgosłupowo w celu leczenia lokalnych problemów obszaru przyległego do kręgosłupa lub w celu działania segmentarnego oraz lokalnie w obszarze dolegliwości (np. na ranie) Niezwykle istotne jest również, aby w czasie zabiegu spokojnie i powoli zwiększać amplitudę prądu (woltaż). Jeżeli gwałtownie wzrośnie dawka, oporność tkanek zwiększy się i stymulacja może być dla pacjenta bolesna, nawet jeżeli nie powstanie oparzenie skóry.
Stymulacja wysokonapięciowa jest bardzo bezpiecznym sposobem leczenia. Podstawowe przeciwwskazania dotyczą aplikacji na brzuch i dolny odcinek kręgosłupa u kobiet ciężarnych, nad obszarem z nowotworem oraz u pacjentów z rozrusznikiem serca.
MIKROPRĄDY
Współcześnie wzrosło także zainteresowanie wykorzystaniem w elektroterapii przerywanego prądu stałego o niskim natężeniu, określanego jako MENS (mikroamperażowa elektryczna stymulacja nerwów), Micro-TENS lub LIDC (prąd stały o niskim natężeniu). Prąd ten, w porównaniu z tradycyjną elektroterapią, w której natężenie prądu określa się w miliamperach, charakteryzuje się zastosowaniem natężenia prądu mierzonego w mikroamperach (10-800 μA). Amplituda mikroprądu jest tak mała, że w czasie stymulacji nie jest on odczuwany przez pacjenta. Współczesne urządzenia wytwarzają mikroprądy w postaci impulsowej jednokierunkowej lub dwukierunkowej. Bezpieczną i komfortową terapią mikroprądem stosuje się w kontroli bólu ostrego i chronicznego, w celu przyspieszenia regeneracji tkanek, zwiększenia tempa gojenia ran i zrostu kości. W czasie stymulacji mikroprądem nie występują efekty uboczne i powikłania.
Mechanizm działania mikroprądu nie jest jeszcze dokładnie wyjaśniony. Jedna z hipotez mówi o tym, że przywraca on biologiczną, elektryczną równowagę tkanek niezbędną do pobudzenia procesów gojenia. Zewnętrzna powierzchnia błony komórkowej posiada ładunek pozytywny, a wewnętrzna negatywny. Spoczynkowa różnica potencjałów wynosi około 50 mV. Kiedy komórka jest uszkodzona potencjał w tej części staje się bardziej negatywny, dlatego też prąd płynie do tego obszaru. Zjawisko to zmierzył Matteucci (1938) i Bois- Reymond (1843), a prąd nazwano „prądem uszkodzenia”. Generowany jest on zarówno w czasie uszkodzenia pojedynczej komórki, jak również tkanek. Doświadczalnie stwierdzono, że natężenie „prądu uszkodzenia” mieści się w zakresie od 10 do 30μA, więc jest to mikroprąd. Uważa się, że „prąd uszkodzenia” wspomaga zdrowienie komórek i tkanek w żywym organizmie. Dlatego też nieinwazyjnie aplikowany mikroprąd może uzupełniać i wspomagać naturalne funkcje „prądu uszkodzenia”. Eksperymentalne badania potwierdziły, że dzięki zastosowaniu mikroprądów zwiększa się produkcja ATP, synteza protein i aktywny transport aminokwasów i dzięki temu wspomagane są procesy regeneracji komórek i tkanek w żywym organizmie. Elektrony, jako integralna część wielu skomplikowanych reakcji zachodzących w żywym organizmie, pełnią również funkcję transportującą dla ATP. Kalkulacje wskazują, że w czasie aplikacji mikroprądem o natężeniu 10μA powstaje 6.3x1012 elektronów na sekundę. Ten przepływ elektronów działa na reakcje chemiczne w żywym organizmie.
Działania przeciwbólowego mikroprądu nie można wyjaśnić za pomocą mechanizmów „bramki kontrolnej”, czy teorii zwiększania produkcji endogennych substancji tłumiących ból, jak to ma miejsce w przypadku zastosowania prądów, których amplitudę mierzy się w miliamperach. Uważa się, że działanie przeciwbólowe mikroprądu można wyjaśnić za pomocą następujących hipotez:
A. Mikroprąd rozprzestrzenia się wzdłuż naczyń krwionośnych mających mały opór elektryczny. Dzięki przepływowi elektronów usprawnia się w naczyniach włosowatych krążenie krwi. Równocześnie przyspiesza się rozpad kwasu mlekowego i substancji uwrażliwiających receptory bólowe (np. bradykinina, histamina). Produkty rozpadu są również szybciej eliminowane dzięki zwiększonemu przepływowi krwi. Zmniejszenie dolegliwości bólowych następuje bezpośrednio po stymulacji. Na podstawie badań klinicznych proponuje się następujące parametry lecznicze mikroprądu: natężenie 300μA lub wyższe, czas impulsu 1-50msec, częstotliwość 10-400Hz lub wyższa.
B. W połączeniu z powyższym procesem wytwarzane jest ATP i zachodzi synteza protein, co przyspiesza proces zdrowienia tkanek, a naturalną jego konsekwencją jest zmniejszenie dolegliwości bólowych. W tym przypadku konieczny jest dłuższy czas terapii, aby uzyskać powyższe efekty kliniczne. Proponuje się następujące parametry lecznicze mikroprądu: natężenie 10μA-200μA, czas impulsu 100msec lub dłuższy, częstotliwość 0.3-1.0Hz.
Mikroprąd wykorzystywany jest również w celu przyspieszenia tempa gojenia ran, chociaż przedstawione w literaturze przedmiotu wyniki badań są bardzo różnorodne i często niekompletne.
Mikroprąd może powodować reakcje niepożądane w postaci pieczenia lub zaczerwienienia u pacjentów z wrażliwą skórą. W takim przypadku należy przerwać leczenie a pacjenta skierować do dermatologa. Po wyleczeniu podrażnień można kontynuować leczenie ostrożnie dawkując amplitudę mikroprądu. Terapia MENS jest przeciwwskazana u pacjentów z rozrusznikiem serca, w czasie infekcji, u pacjentów z gorączką powyżej 38°C, u kobiet ciężarnych, na brzuch w czasie menstruacji, w obszarze głowy, u dzieci poniżej 3 roku życia. Polaryzację elektrody czynnej należy dostosowywać w zabiegach podobnie jak w stymulacji wysokonapięciowej. W przypadku stosowania mikroprądu w postaci dwukierunkowej polaryzacja nie ma znaczenia w czasie zabiegu.
Terapia MENS zawiera zwykle dwie następujące po sobie fazy leczenia. W fazie pierwszej głównym celem jest szybkie zmniejszenie dolegliwości bólowych, w fazie drugiej- przyspieszenie procesu gojenia tkanek objętych procesem chorobowym. Czas zabiegu wynosi od 15 do 30 minut. Faza pierwsza trwa 15 minut, faza druga od 5 do 10 minut. Ilość sesji leczniczych należy dostosować do stanu leczonej tkanki. Zabiegi można wykonywać raz dziennie w ciągu 10 dni do 1,5 miesiąca. Po uzyskaniu zamierzonych efektów terapeutycznych wskazane jest kontynuowanie leczenia jeszcze przez 5-10 dni. W przypadku szczególnie ostrych dolegliwości bólowych terapię mikroprądem można łączyć z TENS-em. W takiej sytuacji w fazie pierwszej elektrostymulacji stosuje się TENS, w fazie drugiej mikroprąd o parametrach przyspieszających zdrowienie tkanki. W czasie zabiegów można stosować elektrody płaskie, które układa się wokół miejsc zmienionych chorobowo (lokalnie) oraz elektrody punktowe do stymulacji specyficznych punktów stymulacyjnych.
PRĄDY PRZEMIENNE ŚREDNIEJ CZĘSTOTLIWOŚCI- INTERFERENCYJNE
Prądy interferencyjne są to prądy średniej częstotliwości (4000Hz) zmodulowane w amplitudzie z małą częstotliwością. Terapeutyczne zastosowanie prądów średniej częstotliwości zapoczątkował austriacki lekarz Hans Nemec. Terapia interferencyjna polega na równoczesnym aplikowaniu na ciało pacjenta prądów z dwóch niezależnych obwodów, które nieznacznie różnią się częstotliwością. W wyniku nałożenia się prądów w tkance pacjenta (interferencji) powstaje nowy rodzaj prądu. Nazwa prąd interferencyjny, choć używana od lat nie określa prawidłowo tego typu prądu. Jego właściwa nazwa powinna brzmieć „niską częstoliwością amplitudowo modulowany sinusoidalnie zmienny prąd średniej częstotliwości”. Określenie to jest jednak zbyt długie, skomplikowane i niepraktyczne w codziennym zastosowaniu. dlatego też dalej w tekście będziemy posługiwać się zwyczajowo przyjętą nazwą prąd interferencyjny. Oporność pojemnościowa tkanek zmniejsza się w miarę zwiększania częstotliwości stosowanego prądu. Działając na skórę prądem o częstotliwości 4000Hz, z związku z jej zmniejszonym oporem, tkanki głębiej położone mogą być łatwiej stymulowane. Pod elektrodami zachodzą te same procesy chemiczne (brak bieguna negatywnego i pozytywnego). Pobudzenie włókien nerwowych za pomocą prądów średniej częstotliwości następuje w wyniku sumowania, zwanego też efektem Gildemaistera. Wymagane jest zaistnienie kilku okresów prądu zmiennego, aby doszło do oczekiwanego stopnia pobudzenia (zjawisko Gildemaistra). W czasie aplikacji symetrycznego prądu zmiennego średniej częstotliwości wpływ negatywnej połowy okresu (efekt katodowy) powoduje rozluźnienie błon komórkowych (lokalne ujemne naładowanie), natomiast podczas działania anodowej połówki fali naładowanie ujemne wygasa. Teoretycznie dzięki równej wartości względem linii zerowej nie powinien powstawać jakikolwiek stan pobudzenia. W praktyce efekt katodowy jest silniejszy, gdyż anodowe wzmocnienie wymaga pod względem termochemicznym dłuższego czasu niż katodowe rozluźnienie. Dochodzi więc do asymetryczności, po katodowej połowie fali pozostaje nadwyżka depolaryzacji na błonie komórkowej i jest gromadzona aż do wytworzenia potencjału akcyjnego. Prądy interferencyjne średniej częstotliwości charakteryzują następujące parametry:
AMF (amplitudowo modulowana częstotliwość) odnosi się do różnicy w częstotliwości prądów między dwoma obwodami. Wybieramy taką wartość tego parametru, jaką chcemy uzyskać w tkance w zależności od celów leczniczych.
Spektrum, jest to różnica między najwyższą a najniższą wartością AMF, np. AMF 10Hz, spektrum 50Hz, oznacza, że częstotliwość zmienia się w zakresie od 10Hz do 60Hz i wraca z powrotem do 10Hz.
Czas przemiatania (sweep time) jest to czas, w którym zachodzą zmiany częstotliwości. Niska wartość czasu przemiatania powoduje, że stymulacja ma agresywniejszy charakter. Wyższa wartość czasu przemiatania powoduje, że terapia ma łagodny charakter.
Czas zbaczania (contour) określa, w jakim procencie czasu przemiatania zachodzą zamiany częstotliwości od AMF do AMF+spektrum. Tzb 100% oznacza, że zmiany częstotliwości zachodzą stopniowo, przez cały czas przemiatania. Tzb 1% oznacza, że zmiany częstotliwości zachodzą gwałtownie (1% z czasu przemiatania).
Kąt określony w stoniach, występuje tylko w IF-Dipol, pozwala terapeucie wybrać kierunek działania bodźca w tkance pacjenta.
Parametry dobiera się w zależności od stanu pacjenta i ostrości jego dolegliwości. W stanach ostrych wskazane jest stosowanie AMF powyżej 100Hz, spektrum 10-50Hz, czas przemiatania reletywnie długi (powyżej 5 sekund), czas zbaczania powyżej 50%, zabiegi można powtarzać 2 razy dziennie, stosując relatywnie krótki czas trwania zabiegu. W stanach o umiarkowanej ostrości symptomów wskazane jest stosowanie częstotliwości w zakresie 10-50Hz, spektrum 10-50Hz, krótki czas przemiatania (1-2 sekundy), czas zbaczania poniżej 50%, zabiegi z relatywnie długim czasem trwania można stosować 3-4 razy w tygodniu.
Prądy interferencyjne mogą być generowane w technice dwupolowej i czteroplowej. Spośrod technik czteropolowych wyróżnia się:
klasyczną interferencję Nemeca,
IF-Izoplanar,
IF-Dipol vector.
W klasycznej interferencji 100% modulacja amplitudy zachodzi w dwóch uprzywilejowanych kierunkach, na dwusiecznej kątów utworzonych przez linie łączące środki elektrod zabiegowych. Mimo korzystnych właściwości tego prądu posiada on ograniczoną wartość terapeutyczną w związku z bardzo czasochłonnym układaniem elektrod i kalkulowaniem, gdzie zajdzie stuprocentowy efekt terapeutyczny i czy obejmie on obszar zmieniony chorobowo.
W prądzie IF-Izoplanar głębokość modulacji wynosi 100% w każdym miejscu między elektrodami, bodziec elektryczny jest jednakowy we wszystkich kierunkach. Stwarza to możliwość wykorzystania tej metody w stymulacji dużych powierzchni, objętych zmianami chorobwymi i leczenia trudnych do zlokalizowania zmian chorobowych, szczególnie w stanie ostrym. Jest to najłagodniejszy sposób terapii ze wszystkich technik czteropolowych.
W prądzie IF-Dipol, 100% modulacji amplitudy zachodzi tylko w jednym kierunku o kształcie wektora. W kierunku prostopadłym do wektora modulacja ma wartość zero. Metoda statyczna stosowana jest do lokalizacji i leczenia zmienionych chorobowo tkanek o przebiegu podłużnym (nerw kulszowy, mięśnie prostowniki lub zginacze nadgarstka). W czasie wyszukiwania optymalnego ustawienia wektora należy manualnie zmieniać jego pozycję, poprzez dostosowanie ustawienia kątowego. Po dokładnym ustawieniu właściwej pozycji wektora (pacjent odczuwa mrowienie wzdłuż przebiegu nerwu lub skurcz mięśni) i zanotowaniu ułożenia elektrod, należy rozpocząć terapię. Zastosowanie automatycznej rotacji pozwala uzyskać efekt obniżenia wzmożonego napięcia mięśniowego i usprawnienie krążenia, szczególnie w obszarze krzyżowania się mięśni biegnących w różnych kierunkach. Dłuższy czas rotacji charakteryzuje się silniejszym działaniem niż krótki czas rotacji.
Prąd IF-2 jest to dwupolowy prąd średniej częstotliwości, który w literaturze określany jest również jako premodulowany prąd interferencyjny. Interferencja między dwoma obwodami prądu powstaje wewnętrznie w urządzeniu. Modulacja amplitudy zachodzi tylko w jednym obwodzie (liniowa superprojekcja lub liniowa interferencja). Główną korzyścią wynikającą z techniki dwupolowej jest jej łatwość zastosowania. Właściwości interferencji liniowej niewiele różnią się od interferencji prostopadłej. Zasady kalkulowania częstotliwości, modulacja amplitudy i AMF są takie same. Więcej uwagi wymaga omówienie zmian natężenia prądu i głębokości modulacji. W interferencji liniowej maksymalna amplituda jest sumą dwóch oryginalnych amplitud Imax=2I. Gęstość jest większa pod elektrodami niż w tkankach głębiej położonych. W przypadku techniki czteropolowej maksymalne natężenie pod elektrodami jest nieznacznie niższe. Różnica ta nie ma większego znaczenia w terapii, gdyż generalnie pacjenci dobrze tolerują ten rodzaj prądu. Głębokość modulacji jest 100% we wszystkich kierunkach. Prąd ma wartość maksymalną wzdłuż linii łączących elektrody i wartość zero w kierunku prostopadłym do tych linii. Technika dwupolowa jest prostsza w użyciu ze względu na dużą łatwość objęcia działaniem leczniczym małego obszaru zmienionego chorobowo. Stosowanie wysokiego natężenia prądu nie powoduje niebezpieczeństwa uszkodzeń elektrochemicznych skóry.
Sposoby aplikacji
punkty bolesne lub spustowe
nerwy
przykręgosłupowa
transregionalna
na mięśnie
Rodzaje elektrod:
* elektrody płaskie
* elektrody podciśnieniowe
* elektrody płaskie czteropolowe
* elektrody czteropolowe podciśnieniowe
* kombinacja elektrod płaskich i podciśnieniowych w jednej terapii
Niebezpieczeństwa
nie należy ustawiać w pobliżu elektrostymulatorów urządzeń do diatermii krótkofalowej, min. odległość 2-3 metry, nie mogą pracować równocześnie.
oparzenia mogą wystąpić jedynie w wypadku zbyt dużej gęstości prądu np. w małych (7,5 cm2) elektrodach płaskich czteropolowych (stosować mniejsze natężenia). Prąd interferencyjny jest symetrycznym prądem zmiennym i nie powoduje w skórze zmian elektrochemicznych.
nie stosować u ciężarnych w rejonie brzucha i odcinka lędźwiowego,
w przypadku nieprawidłowej reakcji skóry,
w czasie infekcji,
jeżeli w obszarze leczenia występuje nowotwór lub rozrusznik serca,
u pacjentów z zakrzepowym zapaleniem żył (powstanie zatoru),
u pacjentów z chorobami serca w przypadku leczenia obszaru piersiowego kręgosłupa,
u pacjentów z zaburzeniami krążenia (wpływ na ciśnienie krwi przy aplikacji w odcinku szyjnym kręgosłupa),
w czasie krwawienia,
jeżeli u pacjenta występuje reakcja histeryczna,
przy powierzchownym krwiaku nie stosować elektrod podciśnieniowych,
u pacjentów z łuszczycą lub zapaleniem skóry może nastąpić pogorszenie jej stanu.
Środki ostrożności
Jest to relatywnie bezpieczna terapia, lecz należy zachować pewne środki ostrożności:
zawsze brać pod uwagę przeciwwskazania, sprawdzić stan pacjenta i skóry przed leczeniem, sprawdzić urządzenie (natężenie), sprawdzić czy nie możliwości interferencji z diatermią krótkofalową, sprawdzić elektrody, przygotować skórę do terapii, zabezpieczyć drobne uszkodzenia skóry wazeliną, przeprowadzić testy czucia skóry w obszarze leczenia, zabezpieczyć dobry kontakt elektrod ze skórą pacjenta, ostrzec przed występowaniem nieprawidłowych reakcji, pozycja komfortowa w czasie leczenia, odpowiednia, zrozumiana instrukcja dla pacjenta, w czasie pierwszego leczenia stosować raczej niższe dawki natężenia prądu.
Przeciwwskazania
Gorączka, aktywny nowotwór w obszarze leczenia, infekcja, rozrusznik (szczególnie „na żądanie”), ciąża, miesiączka, duże otwarte rany, wzmożona wrażliwość na elektroterapię, choroby serca, bardzo młodzi i starzy pacjenci, pacjenci, z którymi nie można porozumieć się, stany dermatologiczne, krwawienie w obszarze leczenia.
Wskazania
- zmniejszenie bólu - ostrego i chronicznego,
- zmniejszenie obrzęku - ostrego i chronicznego,
- reedukacja i wzmocnienie mięśni,
- usprawnienie funkcjonowania narządów w jamie brzusznej, szczególnie nietrzymania moczu,
- stymulacja i usprawnienie powierzchownego i głębokiego krążenia,
- generalnie przyspieszenie zdrowienia,
- jonoforeza (tylko prąd średniej częstotliwości, DC impulsowy)
TECHNIKI LECZNICZE
Terapia interferencyjna może być łączna z innymi terapiami np. krioterapia, UD (przed stymulacją), DKF, techniki manualne, ćwiczenia. Nie stosuje się dwóch sposobów leczniczych mających ten sam skutek terapeutyczny, a tym bardziej skutek przeciwny. Pozytywne wyniki leczenia można uzyskać w wyniku zastosowania co najmniej kilku sesji leczniczych. Każdy pacjent nawet z tym samym schorzeniem jest inny, dlatego też istnieją pewne ogólne zasady dobierania parametrów, lecz są one jedynie wskazówką a nie sztywną receptą. Informacje przydatne przy ustalaniu parametrów leczniczych.
NATĘŻENIE PRĄDU
Poziom natężenia Fizjologiczna reakcja
Bardzo wysoki 5 -silny ból, bardzo mocne skurcze mięśni, silne mrowienie, cierpnięcie.
Wysoki 4 - odczucia bólowe, mocne skurcze mięśni, mrowienie.
Średnie D - skurcze mięśni -silne
C - skurcze mięśni - średnie
3 B - mocne mrowienie i słabe skurcze
A - Umiarkowanie mocne mrowienie.
Niskie 2 - Odczuwalne mrowienie, miłe w odczuciach.
Bardzo niskie 1 Brak obserwowalnych lub subiektywnych reakcji.
Przejście od reakcji czuciowych do bolesnej stymulacji zależy od wielu czynników, szczególnie od rodzaju, rozmiaru i lokalizacji elektrod.
Tabela 2. Problemy kliniczne i niezbędne reakcje fizjologiczne w czasie stymulacji.
PROBLEM KLINICZNY |
FIZJOLOGICZNA REAKCJA |
ostry ból i obrzęk |
reakcja czuciowa |
chroniczny ból |
mocna reakcja czuciowa |
wzmożone napięcie mięśniowe i spastyczność |
ruchowa reakcja |
osłabienie mięśni |
reakcja ruchowa |
chroniczny obrzęk |
reakcja czuciowa i ruchowa |
nietrzymanie moczu |
reakcja czuciowa i ruchowa |
opóźniony zrost kostny |
reakcja czuciowa |
przyspieszenie zdrowienia |
reakcja czuciowa |
W czasie zabiegu możliwe jest zmniejszenie odczuć związane z występowaniem adaptacji (receptory na obwodzie) i habituacji (CNS). Należy ponownie dostosować natężenie do poziomu, przy którym występują odpowiednie reakcje fizjologiczne. Tej zasady nie stosuje się w czasie stymulacji nerwów motorycznych i punktów akupunkturowych.
CZĘSTOTLIWOŚĆ
Preferowane jest stosowanie rytmicznych zmian niż częstotliwości stałej, w celu przeciwdziałania adaptacji i habituacji, dzięki temu możliwe jest oddziaływanie na większy zakres włókien nerwowych. Wyższa częstotliwość powoduje wzbudzenie w grubych włóknach nerwowych. Biologiczny aktywny zakres działania leży w przedziale od 0.1 do 200 Hz.
Tabela 3.Dobór częstotliwości dla stymulacji lub blokowania neuronów.
Rodzaj włókien nerwowych |
Częstotliwość stymulacji |
Częstotliwość blokująca |
Duża średnica włókna czuciowe
|
Średnio 80-150 Hz |
Więcej niż 500Hz |
Cienkie wł. nerwowe A delta C |
1-30 Hz 0,1-10 Hz |
100 Hz 100 Hz |
Włókna ruchowe |
40-80 Hz (optymalny Skurcz tężcowy) |
Więcej niż 120 Hz |
CZAS TRWANIA ZABIEGU
20-30 minut, elektrody próżniowe 15 minut (dłuższy czas może spowodować siniaki, nie stosować w świeżym obrzęki, gdyż można spowodować jego zwiększenie)
ILOŚĆ SESJI
Efekt terapeutyczny 6-10 sesji, w niektórych sytuacjach wymagana jest większa ilość sesji leczniczych, w razie braku postępów po 2-3 sesjach należy zmienić terapię .
OGÓLNE ZALECENIE W DOBORZE PARAMETRÓW
Wysoka aktualność symptomów:
F>100Hz
spectrum: 10-50Hz czas leczenia: krótki
contour: powyżej 50% częstotliwość zabiegów: codziennie lub 2xdziennie
sweep time: około 5sec.lub dłuższy
Stan chroniczny może mieć wysoką bądź niską aktualność symptomów.
Niska aktualność symptomów:
F: 10-50Hz
spectrum: 10-50Hz czas leczenia: relatywnie długi
contour: poniżej 50% częstotliwość leczenia:3-4x w tygodniu
sweep time: 1-2 sec.
W stanie okreslanym jako chroniczny moze wystepować wysoka lub niska aktualność symptomów.
Ból ostry
W ostrym bólu przy braku reakcji na standardową terapię interferencyjną można zastosować prąd średniej częstotliwości o jednym kierunku przepływu, modulowany w amplitudzie. Ból ostry można zmniejszyć działając na mechanizmy modulowania reakcji bólowej, czyli mechanizm „bramki kontrolnej”, zstępujących mechanizmów tłumiących ból i wydzielanie endorfin, bezpośredni blok neuralny, stymulacja krążenia, efekt placebo. Fizjologiczne blokowanie aktywności we włóknach przewodzących ból (A delta, C).
Włókna C są zdolne do przewodzenia impulsacji przy stymulacji o częstotliwości mniejszej niż 15Hz, przekroczenie tej wartości powoduje całkowity blok przewodzenia tych włókien, a w przypadku włókien A delta częstotliwość powyżej 40Hz. Stosując częstotliwość 100Hz po początkowym krótkim wybuchu aktywności następuje zablokowanie przewodzenia i pacjent odczuwa zmniejszenie bólu. Bodziec o częstotliwości powyżej 500Hz powoduje czasowe znieczulenie w obszarze stymulacji.
W stanie ostrym nie stosuje się czynników termicznych, w postaci ciepłych okładów, lecz głównie okłady z lodu w celu odruchowego zwiększenia krążenia. Za pomocą elektroterapii: poprzez zmniejszenie aktywności układu sympatycznego (łatwiej zlokalizować nerwy sympatyczne położone na obwodzie), wywoływanie skurczów mięśniowych w stanie o mniejszych dolegliwościach bólowych.
Ból chroniczny
Produkcja endorfin, stymulacja zstępujących mechanizmów zmniejszających ból, obniżenie wrażliwości bolesnych punktów spustowych i akupunkturowych (krótki czas zabiegu, w razie zwiększenia bólu trwającego w czasie należy przerwać terapię, jeżeli odczucia są pozytywne zabieg trwa do 5 minut).
Częstotliwość: rytmiczne zmiany w zakresie do 15 Hz, lub 2Hz stała, widoczne skurcze mięśni w czasie zabiegu, czas 20-40 minut dla elektrod płaskich, 10-15 minut dla elektrod próżniowych.
MTP (sonda czterobiegunowa), częstotliwość: stała 10 Hz dla oceny, w terapii do 5Hz rytmiczna, lub stała 2 Hz, 80Hz.
Reedukacja i wzmocnienie mięśni
Korzyści wynikające z zastosowania terapii IF: przyjemne odczucia pacjenta, duża głębokość penetracji, łatwość dopasowania technik leczniczych, łatwość dostosowania natężenia prądu. Zastosowanie czasu „on” i „off” powoduje falowanie, jeżeli brak w urządzeniu możliwości automatycznej, należy sterować manualnie. Brak falowania nie wpływa na wybiórczo na określone rodzaje włókien nerwowych (szybkie , wolne).
Reedukacja: technika 2 elektrodowa, częstotliwość: 40-80Hz lub 50 Hz, lub 0,5Hz, 100 skurczów w grupach po 10, z przerwami.
Wzmocnienie: mocne skurcze, czas „on” 5-8 sec, czas „off” 15-25 sec, do 30 skurczów dziennie, 5 razy w tygodniu, przez trzy tygodnie.
Zmniejszenie obrzęku ostrego: nie stosować elektrod próżniowych, technika 4 elektrodowa lub 2 elektrodowa, częstotliwość: 80-100 Hz szybkie zmiany, 120-150 Hz wolne zmiany, 90-100Hz wolne zmiany, stała 100 Hz, reakcja czuciowa, lub bardzo delikatne skurcze, korzystne w celu usunięcia plazmy protein przez naczynia limfatyczne. Można zastosować leczenie kombinowane w połączeniu z zimna kąpielą (kostka). Działanie obejmujące wpływ na hamowanie pobudzenia układu sympatycznego.
Chroniczny obrzęk. Celem zabiegu jest stymulacja nerwów czuciowych w celu pobudzenia krążenia lub stymulacja nerwów ruchowych w celu aktywacji pompy mięśniowej.
Faza I. Technika 2 elektrodowa, może być w połączeniu z kąpielą ciepłą, częstotliwość: 80-150 Hz szybkie zmiany, reakcja czuciowa, czas zabiegu 20 minut, 8-12 sesji. Faza II. Częstotliwość: 40-80 Hz szybkie zmiany, wolne falowanie, czas „on” 2-3 sec, czas „off” 6-10 sec, lub 0,3 Hz, 0-10Hz bez falowania, natężenie wywołujące mocne mrowienie i niezbyt silne skurcze mięśni, 50-100 skurczów w grupach po 10. Ciepła kąpiel obniża zwiększoną lepkość płynów, pobudza ich usuwanie z zajętego obszaru. Ciepłej kąpieli nie stosować u pacjentów z zaburzeniem krążenia. Ogólna zasada w stymulacji skurczów (zwiększenie krążenia głębokiego)polega na działaniu na duże grupy mięśniowe w pobliżu zajętego obszaru.
Zmniejszenie napięcia mięśniowego. Hyper-stymulacja nerwów ruchowych. Technika: 2 elektrodowa, izometryczne skurcze, natężenie wywołujące bezbolesne skurcze mięśni, 100-150 Hz, bez falowania, 20-30 minut.
Zmniejszenie spastyczności. Działanie na mechanizmy hamujące wzmożoną aktywność mięśni. Stymulacja mięśni antagonistycznych. Technika 2elektrodowa, wolne zmiany w krótkim czasie, częstotliwość: 40-80Hz, wolne falowanie, długi odpoczynek, natężenie wywołujące mocne mrowienie i słabe skurcze należy zwiększać bardzo powoli, czas zabiegu: 20-30 minut lub dłużej, 15-20 sesji leczniczych.
Stymulacja krążenia. Techniki 2 elektrodowe lub 4 elektrodowe, elektrody próżniowe, płaskie. Faza A i B. Rytmiczne, szybkie zmiany częstotliwości: 80-150 Hz. A-zatkane arterie wymagają bardzo niskiego natężenia, bez reakcji ruchowej. B- choroby nerwowo-naczyniowe obejmujące odruchową dystrofię sympatyczną wymagają mocniejszej czuciowej stymulacji wywołującej wrażenie mocnego mrowienia lub słaby skurcz, czas trwania zabiegu: A- 5-10 minut codziennie, lub 3 razy w tygodniu, 10-12 sesji, B- 15-30 minut codziennie, 10-15 sesji.
Stymulacja narządów w jamie brzusznej. Narządy w jamie brzusznej są kontrolowane przez autonomiczny układ nerwowy, szczególnie przez układ parasympatyczny. Aktywność części sympatycznej jest przeciwstawna do parasympatycznej, wstrzymując normalna aktywność narządów w jamie brzusznej. Hamowanie wzmożonej aktywności układu sympatycznego powstaje dzięki stymulacji za pomocą wyższych częstotliwości, pod warunkiem, że włókna zlokalizowane są powierzchownie. Istnieje możliwość elekrostymulacji wywołującej odruch autonomiczny i pobudzającej działanie narządów. Wymaga to specyficznej aplikacji na tylnej powierzchni tułowia w strefach „Heada”. Technika: 4 elektrodowe i 2 elektrodowe, płaskie lub próżniowe, częstotliwość: 80-150 Hz rytmiczne, szybkie zmiany, natężenie relatywnie niskie wywołujące wrażenie mocnego mrowienia, bez skurczów mięśni, czas zabiegu: 10-15 minut, 2-3 razy w tygodniu, 10-12 sesji leczniczych. W praktyce fizjoterapeuci nie leczą chorób narządów wewnętrznych, lecz lekarze chorób wewnętrznych i chirurdzy. W czasie stymulacji konieczne jest monitorowanie reakcji pacjenta.
Wysiłkowe nietrzymanie moczu. Jest to sytuacja, w której pacjent nie jest w stanie biernie utrzymać moczu, szczególnie pod wpływem wysiłku (zwiększenie ciśnienia w jamie brzusznej), kichnięcia, kaszlnięcia, nawet przy prawidłowym unerwieniu pęcherza moczowego.
Zasady aplikacji:
1.aktywacja zewnętrznego (distal) zwieracza prążkowano komórkowego (działanie na cienkie autonomiczne włókna nerwowe dochodzące do zwieracza, częstotliwość: 1-10Hz lub 0,5-15Hz, wyższa częstotliwość może blokować transmisje przez te włókna)
2.aktywacja małych mięśni otaczających zwieracz (stymulacja autonomicznych włókien nerwowych dochodzących do tych mięśni, częstotliwość jak wyżej),
3.aktywacja mięśni około cewkowych w dnie miednicy (stymulacja relatywnie relatywnie grubych włókien ruchowych, te same zasady jak przy reedukacji mięśni, falowanie czas „on” 3 sec, czas „off” 4-6 sec.
Technika zabiegu: 4 elektrody płaskie lub próżniowe, 2 elektrody, krok 1: częstotliwość: 1-10 Hz lub niewiele większy do 15Hz, 0-100Hz , wolne rytmiczne zmiany; krok 2: częstotliwość: 40-80 Hz szybkie zmiany, falowanie, komfortowe skurcze mięśni. Natężenie: krok 1: mocna czuciowa reakcja, krok2: odpowiednie do wytwarzania skurczy w miednicy. Czas zabiegu: krok 1: 15-20 minut, elektrody płaskie, 10-15 minut elektrody próżniowe; krok 2: czas niezbędny do wykonania 40-50 skurczów w grupach po 10, 12-15 sesji leczniczych.
Przyspieszenie procesów zdrowienia. Technika: 4 elektrody płaskie lub próżniowe, 2 elektrody płaskie lub próżniowe, system elektrod czteropolowych, częstotliwość: faza 1: częstotliwość: 0.1-20 Hz rytmiczne, wolne zmiany, faza 2: szybkie, w szerokim zakresie zmiany częstotliwość 20-150 Hz, natężanie relatywnie niskie wywołujące odczucie mrowienia, czas: faza 1: 15-20 (próżniowe 5-10 minut), faza 2: 15-20 minut (5-10 próżniowe). 3 lub więcej razy w tygodniu, 12-15 sesji ogółem.
Prądy falujące średniej częstotliwości
Prąd falujący średniej częstotliwości jest to dwupolowy prąd interferencyjny, gdzie interferencja zachodzi wewnętrznie w elektrostymulatorze, zmodulowany do niskiej częstotliwości. Prąd ten jest często porównywany z falującym prądem neofaradycznym, lecz jest bardziej przyjazny dla pacjenta, gdyż nie ma komponentu galwanicznego i nie wywołuje w czasie stymulacji zmian elektrochemicznych pod elektrodami. Producenci w swoich urządzenich oferują użytkownikom dwa rodzaje falujących prądów średniej częstotliwości, różniące się częstotliwością prądu nośnego. Jeden prąd ma częstotliwość 4000Hz, drugi 2500Hz, zwany dalej prądem Kotza lub Rosyjską stymulacją.
Prąd falujący o częstotliwości nośnej 4000Hz powoduje zmniejszenie odczuć bólowych, usprawnia krążenie i wywołuje skurcze mięśni. Skurcze mięśniowe wyzwolone przez zmodulowaną do niskiej częstotliwość nośną 2500Hz, są silniejsze niż skurcze wyzwolone przez częstotliwość 4000Hz.
Prąd Kotza (rosyjska stymulacja jest opisany w dalszej części przy tematyce dotyczącej stymulacji mięśni prawidłowo unerwionych).
ZASTOSOWANIE ELEKTROTERAPII W ZMNIEJSZANIU BÓLU I LECZENIU ZABURZEŃ NEUROWEGETATYWNYCH
Efekty stymulacji prądami niskiej i średniej częstotliwości można podzielić następująco:
lokalne biochemiczne zmiany, powstałe w wyniku działania prądów o jednym kierunku przepływu,
wyładowania w receptorach i w nerwach, które zależnie od ich funkcji mogą powodować zmiany w różnych częściach ciała. Konsekwencją stymulacji włókien efferentnych jest skurcz mięśni. Skutki stymulacji włókien afferentnych omówię poniżej.
Afferentne przewodzenie potencjałów czynnościowych przez drogi wstępujące zwykle powoduje wzrost wrażeń czuciowych. Równocześnie inne czuciowe informacje, szczególnie związane z bólem, mogą być zmienione. W dodatku, przez mechanizmy odruchowe można wpływać na aktywność somatyczną i neurowegetatywną. Omawiając dokładnie różne formy elektroterapii należy rozróżnić kilka grup afferentnych włókien nerwowych. Określenie grube włókna nerwowe jest przeznaczone dla włókien typu Ia i Ib z grubą osłonką mielinową (mięśniowe). Średnio grube włókna nerwowe to włókna typu II i IIa. Cienkie włókna nerwowe to włókna typu IIIb z osłonką mielinową i włókna typu IV bez osłonki mielinowej.
Wpływ na ból i aktywność sympatycznego układu nerwowego
Obwodowa stymulacja grubych włókien nerwowych typu Ia i Ib nie działa na transmisję bólu i aktywność neurowegetatywną.
Stymulacja średnio-grubych włókien nerwowych hamuje transmisję bólową zgodnie z teorią „bramki kontrolnej” Malzacka i Walla. Stymulacja cienkich włókien nerwowych może wywołać efekt znieczulenia dzięki aktywacji zstępującego endogennego systemu, modulującego ból (aktywacja endorfin). Zmniejszenie przewodzenia informacji bólowej ma oddziaływanie na aktywność układu sympatycznego, na poziomie segmenternym i generalnie. Aktywność włókien typu IV może spowodować zwiększenie niespecyficznego pobudzenia w systemie nerwowym. Zmniejszenie aktywności włókien typu IV może ten stan pobudzenia zredukować. Jeżeli segmentarne rozregulowanie zmniejszy się, troficzny stan organów obwodowych ulegnie poprawie i zostanie zmniejszona wrażliwość receptorów. Dzięki tym zmianom zostanie zredukowany również ból.
MECHANIZMY ZMNIEJSZENIA BÓLU ZA POMOCĄ PRĄDU ELEKTRYCZNEGO - PODSUMOWANIE
Przez wzmożone ukrwienie hormony tkankowe (bradykinina, serotonina, histamina, prostaglandyna), pobudzające receptory bólowe, zostają szybciej usunięte z uszkodzonej tkanki.
Anolelektronus pod anodą (przy stosowaniu prądu stałego) wg starych teori powoduje zmniejszenie pobudliwości błon receptorów bólowych, wg nowych na zmniejszenie bólu wpływa odpychanie pod anodą jonów wodoru i potasu.
Teoria bramki kontrolnej wg Melzacka i Walla (1965) i jej modyfikacje. Hamowanie presynaptyczne - stymulacja mechanoreceptorów w skórze (wł.A β, niski próg pobudliwości) powoduje neuralne hamowanie impulsacji bólowej w rogach tylnych rdzenia kregowego przewodzonej przez włókna niemielinizowane, co w konsekwencji powoduje zmniejszenie bólu. Hamowanie postsynaptyczne, aktywacja zstępujących dróg hamujących i wytwarzanie enkefalin i zmniejszenie percepcji bólu.
Edogenne wytwarzanie substancji tłumiących ból (endorfin). Mechanizm SPA.
Zmniejszeine wzmożonej aktywności układu sympatycznego (podsystem odpowiadający za obkurczenie naczyń krwionośnych.
Zmniejszenie potencjału czynnosciowego we włóknach przewodzących ból (blok).
Efekt plateau prądów interferencyjnych może powodować stan trwałej deplaryzacji komórek, które nie będą reagować na bodźce.
Stymulacja mięśni (pojedyncze niezbyt silne skurcze)wytworzenie pompy mięśniowej, co usprawnia krążenie i pozbycie się substancji uwrazliwiających receptory bólowe.
W czasie zwiększenia aktywności układu sympatycznego (podsystemu zwężającego naczynia krwionośne) w skórze i w nie aktywnych mięśniach przepływ elektronów usprawnia w naczyniach włosowatych krążenie krwi.
WPŁYW NA LOKALNE KRĄŻENIE
Różne stany patofizjiologiczne mają źródło w słabym lokalnym krążeniu. Logiczne wydaję się z terapeutycznego punktu widzenia, że aby uzyskać efekt leczniczy należy usprawnić ten czynnik. Krążenie reaguje na różne czynniki zewnętrzne i jednym z nich jest również prąd. W wyniku działania różnych prądów naukowcy znaleźli wiele pozytywnych rezultatów elektrostymulacji. Należą do nich: zwiększenie temperatury w skórze, zwiększenie lokalnego krążenia, leczenie niedokrwienia przeszczepionej skóry, szybsze leczenie chronicznych wrzodów skóry, choroby Raynauda, polineuropatii cukrzycowej, zabezpieczenie przed odleżynami. Powyższe wyniki można wyjaśnić w różnorodny sposób.
Przekrwienie w wyniku zmian chemicznych powstające w czasie działania prądu o jednym kierunku przepływu jest bardzo dobrze znane. Działa głównie na skórę, w mniejszym stopniu na mięśnie położone głębiej.
Naczynia krwionośne są zwężone, kiedy aktywność sympatycznego układu nerwowego jest zwiększona. W wyniku działania bodźca elektrycznego aktywność zmniejszy się, zwężenie naczyń słabnie, co wpływa na relatywne zwiększenie krążenia w tkankach.
Inną konsekwencją normalizacji zwiększonej aktywności neurowegetatywnej jest redukcja napięcia unoszących mięśni szkieletowych. Ustąpienie ciśnienia krwi w naczyniach mięśni występuje głównie w kapilarach.
Powstałe w czasie stymulacji skurcze mięśni wpływają również pozytywnie na krążenie. Mechaniczne bodźce (rytmiczny ruch) i chemiczne bodźce (produkty metaboliczne) oddziaływają pozytywnie na poprawę krążenia.
Stymulacja powoduje wzrost wydzielania polipeptydu jelitowego działającego na naczynia (VIP) z pęcherzyków w obwodowych komórkach nerwowych. Ten ostatnio odkryty neurotransmiter powoduje relaksację w mięśniach gładkich ścian naczyń krwionośnych.
DOBÓR PRĄDÓW I PARAMETRÓW BODŹCÓW
Leczenie za pomocą elektroterapii chorób charakteryzujących się bólem lub zaburzeniami neurowegetatywnymi może zawierać stymulację wstępujących włókien nerwowych. Ma to hamujący działanie na przepływ informacji bólowej jak również chroniczne zwiększenie aktywności sympatycznego układu nerwowego.
W przypadku nieselektywnego działania systemu nerwowego (faza alarmu) wskazana jest stymulacja średnio-grubych włókien nerwowych. Stymulacja włókien bólowych nie jest wskazana, ponieważ mogłaby ona prawdopodobnie niespecyficzną aktywność w układzie nerwowym, ze wszystkimi towarzyszącymi efektami ubocznymi. Kiedy system nerwowy pracuje selektywnie można stymulować włókna bólowe, ale nie zawsze jest to konieczne. Bardzo ważne jest dobranie prądów do selektywnej stymulacji średnio-grubych włókien nerwowych. Mogą być one stymulowane selektywnie przez przerywane prądy o jednym kierunku przepływu i przez asymetryczne i symetryczne prądy zmienne. Preferowana jest stymulacja prądami zmiennymi, gdyż nie występuje ryzyko pieczenia, co może spowodować uszkodzenie tkanki i ból. Kształt pulsu przerywanego prądu o jednym kierunku przepływu, w tym wypadku nie ma dużego znaczenia. W porównaniu z prostokątnym impulsem, impuls trójkątny o tym samym czasie trwania wymaga wyższego natężenia prądu. Czas pulsu prąd o jednym kierunku przepływu i pulsów dwufazowych powinien być relatywnie krótki. Badacze podają różne czasy od 0,06 do 0,5ms. Stosując prąd zmienny preferowana jest częstotliwość od 50-100 Hz. Wiele doniesień wskazuje, że nawet dość niskie natężenia prądu jest wystarczające do selektywnej stymulacji średnio-grubych włókien nerwowych.
Stosując wysokie natężenia prądu może nastąpić równoczesna stymulacja średnio-grubych i cienkich włókien nerwowych, ale w czasie stymulacji potencjał czynnościowy grubszych włókien wpływa hamująco na cienkie włókna nerwowe. Właściwy prąd wyjściowy powinien wywoływać mniej lub bardziej odczuwalną reakcję w postaci wrażenia wibracji, brzęczenia, bez odczuć bólowych i ubocznych efektów neurowegetatywnych (pocenie się , gęsia skórka). Skurcz mięśni nie zawsze jest konieczny, ale dopuszczalny, bądź też niepożądany w ogóle. Ponieważ natężenia prądu jest dostosowywane do odczuć pacjenta, konieczne jest wykonanie testu wrażliwości przed leczeniem.
LOKALIZOWANIE MIEJSCA DO STOSOWANIA BODŹCÓW LECZNICZYCH
Chcąc zmniejszyć odczucie bólu, konieczne jest stymulowanie średnio-grubych włókien nerwowych wchodzących do rdzenia kręgowego po stronie, gdzie również wchodzą blokowane informacje bólowe ( stymulacja włókien nerwowych w tym samym segmencie, gdzie zlokalizowane jest źródło informacji bólowych).
W praktyce:
stosujemy leczenie po stronie, gdzie ból pojawia się i jest odczuwalny,
możemy również stosować leczenie na nerw bardziej proksymalnie, wrażenia odbierane przez pacjenta pojawiają się w „powierzchni bólowej”,
możemy stosować leczenie na nerwy segmentu, ale z innej powierzchni niż obszar bólu, np. w przypadku bólu przeniesionego; pożądane jest promieniowanie idące w kierunku powierzchni bólowej,
nie ma zaburzeń- stymulacja cienkich włókien nerwowych- strona nie ma znaczenia, gdyż efekt pojawia się w centralnym układzie nerwowym, nie stosowana w praktyce.
LECZENIE ZABURZEŃ NEUROWEGETATYWNYCH
Wpływanie na chroniczne zwiększenie aktywności w sympatycznym układzie nerwowym zachodzi odruchowo w komórkach rogów bocznych rdzenia kręgowego na poziomie C8 do L2. Dobór miejsca ułożenia elektrod zależy od selekcji nerwów obwodowych do stymulacji. W przypadku zaburzeń w segmentach powyżej C8 (głowa, szyja, obręcz barkowa, kończyny górne) i poniżej L2 (obręcz miedniczna, kończyny dolne), preferowana jest stymulacja nerwów obwodowych z zajętego obszaru, nawet przez te nerwy, które nie wchodzą do rdzenia kręgowego na poziomach, gdzie mają początek nerwy sympatyczne z dotkniętego obszaru. Na poziomie wejścia jakiejkolwiek transmisji bólowej informacja jest hamowana, co z kolei zmniejsza trwające reakcje pobudzenia. W tym samym czasie aktywowane są podłużne włókna łączące, występujące lokalnie między początkiem somatycznego poziomu i związanego z nim poziomu sympatycznego; co właściwie hamuje komórki w rogach bocznych. W omawianych schorzeniach możemy również stymulować średnio-grube włókna nerwowe wstępujące do rdzenia kręgowego na poziomie, gdzie mają początek włókna sympatyczne z zajętego obszaru, co także hamuje wzmożoną aktywność układu sympatycznego. Metoda ta jest szczególnie wskazana przy zaburzeniach w narządach unerwianych z segmentu C8 - L2. Obie metody mogą być stosowane równocześnie lub jedna po drugiej.
W związku z rozwojem metod terapeutycznych (techniki czteropolowe) oraz elektroniki produkuje się aparaturę z dwoma lub większą ilością kanałów, co umożliwia wprowadzenie kombinowanego leczenia. Polega ona na leczeniu obszaru bolesnego w połączeniu ze stymulacją nerwów na tułowiu na odpowiednim poziomie. Trudnością w tej terapii jest dobranie odpowiedniego natężenia (balans, jeżeli są trudności w dostrojeniu, zastosować na początku leczenia dwa oddzielne aparaty).
ADAPTACJA
Jeżeli przez jakiś czas będzie kontynuowana niezmienna stymulacja włókien czuciowych, to wrażenia czuciowe generowane przez nią zmniejszą się, strumień impulsów płynących przez drogi nerwowe zatrzyma się. Zjawisko to zwane „centralną adaptacją” jest niekorzystne z terapeutycznego punktu widzenia. Strumień potencjałów czynnościowych musi być utrzymany na tym samym poziomie.
W praktyce, najlepiej sprawdzić to ciągle pytając pacjenta, czy ciągle czuje prąd. Jeżeli wrażenia maleją lub zanikają, zwiększenie natężenia prądu może wznowić stymulację. Jest to najłatwiejszy sposób przeciwdziałania adaptacji. Jeżeli pacjent przystosowuje się do prądu bardzo łatwo, natężenie prądu musi być często zwiększane. Nie można tego robić bez końca, gdyż mogą powstać skurcze mięśniowe lub w przypadku prądów o jednym kierunku przepływu odczucie pieczenia. Rozwinęły się inne metody, które mniej lub bardziej zapobiegają adaptacji. Najczęściej stosowanym sposobem jest zmienność częstotliwości stymulacji (modulacja częstotliwości). Inne modulacje stosowane w aparaturze do elektroterapii zawierają:
nieregularna prądy, z nieregularnym czasem przerwy z ustaloną ilością impulsów na sekundę (prąd zwany „stochastic”),
prądy z regularnymi przerwami między wybuchami impulsów (burst),
zwiększenia lub zmniejszanie natężenia prądu (modulacja amplitudy),
zwiększanie lub zmniejszanie szerokości pulsu,
kombinacja wszystkich modulacji.
DAWKA I CZĘSTOTLIWOŚĆ LECZENIA
Dokładne określenie dawki natężenia pojedynczego leczenia lub serii nie jest możliwe. Autorzy opisujący różne metody lecznicze dają zwykle propozycje dawek, bez dokładnych argumentów dla nich. Wartości dawek dla prądów są bez znaczenia, gdyż zależą od powierzchni elektrod oraz także od indywidualnych różnic w pobudliwości. Użyteczne kryteria do formułowania zasad doboru dawki natężenia prądu zależą od stopnia selektywności w układzie nerwowym pacjenta oraz od aktualności symptomów. W przypadku nieselektywnie działającego systemu nerwowego leczenie powinno cechować się:
relatywnie niskim natężeniem prądu ( podprogowe, progowe),
relatywnie krótki czas trwania,
łagodne formy modulacji, jeżeli modulacja jest konieczna,
wysoka częstotliwość leczenia ( raz dziennie lub częściej).
Podobny typ leczenia jest preferowany dla pacjentów z selektywnie działającym systemem nerwowym, gdzie symptomy mają wysoką aktualność, ale wymagania mogą być mniej dokładne.
Zaburzenia z niską aktualnością symptomów wymagają leczenia z:
relatywnie wysokim natężeniem,
długim czasem leczenia,
agresywnymi formami modulacji,
niską częstotliwością leczenia.
RODZAJE APLIKACJI
Stymulacja punktów wrażliwych.
MTP (powierzchowne punkty spostowe)
punkty akupunkturowe
Stymulacja nerwów (punkty stymulacyjne nerwów).
Stymulacja mięśni (punkty motoryczne mięśni. Poprzeczna, podłużna).
Stymulacja segmentarna.
Stymulacja transregionalna (przykręgosłupowa, lokalna np. stawów, przykurcze, stany przeciążeniowe tkanek miękkich).
STYMULACJA MIĘŚNI PRAWIDŁOWO UNERWIONYCH
Elektryczna stymulacja normalnie unerwionych mięśni może mieć podobny skutki na mięśnie, inne tkanki i układy jako równoważnik aktywnych ćwiczeń, w momencie, gdy są one ograniczone. Zwykle stosuje się prądy falujące, o krótkim czasie impulsu z częstotliwością około 50-100Hz, np. prądy typu faradycznego. Długość fali, tempo wzrostu i spadku amplitudy, przerwy między falami mogą być różnorodne. Stymulacja elektryczna ze stałą częstotliwością może wyzwolić coraz mocniejsze skurcze mięśni tylko przez pobudzenie większej ilości jednostek motorycznych z użyciem większego natężenia prądu. Ma różne terapeutyczne zastosowanie, które można pogrupować następująco:
Wzmacnianie siły mięśniowej.
Pobudzanie kontroli mięśniowej:
inicjowanie i pobudzanie skurczu mięśni zahamowanego przez ból lub zabieg chirurgiczny,
inicjowanie prawidłowych skurczy (płaskostopie),
inicjowanie nowych skurczy (po transplantacji nerwu),
w czasie zdrowienia uszkodzeń nerwów obwodowych,
w sytuacji, gdzie jest konieczne przedstawienie pacjentowi, że skurcze mięśni mogą być normalne (histerical paralysis).
Utrzymywanie lub zwiększanie zakresu ruchu w stawach:
stymulacja przykurczonych tkanek miękkich i blizn,
utrata możliwości ruchu w wyniku spastyczności lub w innych stanach neurologicznych,
stymulacja mięśni w skoliozach.
Działanie na metabolizm mięśni i przepływ krwi ( pompa mięśniowa).
Zmiany w strukturze- eutroficzna elektroterapia (dobór częstotliwości stymulacji zależy od częstotliwości potencjałów czynnościowych jednostek motorycznych, co jest badane przez EMG).
Stymulacja unieruchomionych mięśni.
Stymulacja dla kontroli spastyczności.
STYMULACJA MIĘŚNI PRAWIDŁOWO UNERWIONYCH
Elektryczna stymulacja normalnie unerwionych mięśni może mieć podobny skutki na mięśnie, inne tkanki i układy jako równoważnik aktywnych ćwiczeń, w momencie, gdy są one ograniczone. Zwykle stosuje się prądy falujące, o krótkim czasie impulsu z częstotliwością około 50-100Hz, np. prądy typu faradycznego. Długość fali, tempo wzrostu i spadku amplitudy, przerwy między falami mogą być różnorodne. Stymulacja elektryczna ze stałą częstotliwością może wyzwolić coraz mocniejsze skurcze mięśni tylko przez pobudzenie większej ilości jednostek motorycznych z użyciem większego natężenia prądu. Ma różne terapeutyczne zastosowanie, które można pogrupować następująco:
Wzmacnianie siły mięśniowej.
Pobudzanie kontroli mięśniowej:
inicjowanie i pobudzanie skurczu mięśni zahamowanego przez ból lub zabieg chirurgiczny,
inicjowanie prawidłowych skurczy (płaskostopie),
inicjowanie nowych skurczy (po transplantacji nerwu),
w czasie zdrowienia uszkodzeń nerwów obwodowych,
w sytuacji, gdzie jest konieczne przedstawienie pacjentowi, że skurcze mięśni mogą być normalne (histerical paralysis).
Utrzymywanie lub zwiększanie zakresu ruchu w stawach:
stymulacja przykurczonych tkanek miękkich i blizn,
utrata możliwości ruchu w wyniku spastyczności lub w innych stanach neurologicznych,
stymulacja mięśni w skoliozach.
Działanie na metabolizm mięśni i przepływ krwi ( pompa mięśniowa).
Zmiany w strukturze- eutroficzna elektroterapia (dobór częstotliwości stymulacji zależy od częstotliwości potencjałów czynnościowych jednostek motorycznych, co jest badane przez EMG).
Stymulacja unieruchomionych mięśni.
Stymulacja dla kontroli spastyczności.
.
W medycynie sportowej NMES można stosować jako techniki treningowe, których celem jest przyrost siły i masy mięśniowej, w celu zapobiegania urazom, zwiększenia odporności na zmęczenie oraz zmniejszenia atrofii w czasie unieruchomienia.
Mięśnie jako najobfitsza tkanka organizmu ludzkiego, wyspecjalizowane są w kierunku wykonywania ruchu i zamiany potencjalnej energii chemicznej substancji organicznych (glukoza, kwasy tłuszczowe) w energię mechaniczną- kinetyczną ruchu. W odróżnieniu od mięśni gładkich i mięśnia sercowego, kurczących się pod wpływem impulsów generowanych przez komórki rozrusznikowe i mediatorów uwalnianych na zakończeniach układu autonomicznego, a więc są typu miogennego, mięśnie szkieletowe kurczą się wyłącznie pod wpływem pobudzeń pochodzących z OUN i przekazywanych przez nerwy somatyczne, a więc typu neurogennego. Mięśnie szkieletowe są przyczepione za pośrednictwem ścięgien do kości i swoimi skurczami mogą przemieszczać poszczególne kości względem siebie, warunkując ruchy kończyn lub poszczególnych części ciała. Wszelka aktywność mechaniczna organizmu jest przejawem czynności mięśni.
Ludzkie mięśnie składają się z dwóch rodzajów włókien mięśniowych mających różne właściwości skurczowe:
- włókna wolne I typu (czerwone, α 2, toniczne, są odporne na zmęczenie, głównie ze względu na ich metabolizm tlenowy)
- włókna szybkie II typu (białe, α1, fazowe,większa prędkość skurczu, ograniczona odporność na zmęczenie, ze względu na metabolizm beztlenowy).
Neuron ruchowy „alfa” unerwia jednorodną wiązkę włókien albo wolnych albo szybkich i razem z nimi tworzy odpowiednio jednostki ruchowe toniczne lub fazowe. Liczba włókien mięśniowych unerwionych neuronem „alfa” jest większa w jednostce ruchowej tonicznej i mniejsza w jednostce ruchowej fazowej. Jednostka ruchowa toniczna odznacza się niskim progiem pobudliwości i częstotliwością wyładowania 10-20 Hz, jednostka ruchowa fazowa 30-60 Hz. Działanie neuronu ruchowego „alfa” kontroluje właściwości skurczowe włókien mięśniowych. Odpowiada też za odżywianie się włókien mięśniowych i odgrywa główną rolę w mechanizmach kontrolujących siłę. Siła skurczu może być kontrolowana przez neurony ruchowe na dwa sposoby:
poprzez zwiększanie częstotliwości wyładowania pobudzającego daną jednostkę, aż do całkowitego skurczu tężcowego,
poprzez pobudzenie nowych jednostek motorycznych.
Istnieją dwa rodzaje kontroli napięcia mięśni przez alfa motoneurony: przy niskim napięciu mięśniowym alfa motoneurony obniżają próg całkowitego skurczu tężcowego, a przy skurczach maksymalnych, zwłaszcza w krótkim czasie, podwyższają ten próg. Aktywacja jednostek motorycznych zależy od rodzaju wykonywanego ruchu. Jednostki te mogą być uaktywnione poprzez powtarzanie ruchów lub elektrostymulację prądem o odpowiednio wysokim natężeniu. Jednostki motoryczne działają zgodnie z pewną hierarchią „włączania”. Na początku ruchu włączane są małe jednostki, większe dopiero przy mocniejszych pobudzeniach. Na mechanizm włączeniowy, w pewnych granicach, ma wpływ ilość siły potrzebnej mięśniowi. Na niskich poziomach napięcia stopniowanie odbywa się poprzez włączanie/wyłączanie nowych jednostek ruchowych, które wyładowują się w stosunkowo niskich częstotliwościach. Dla maksymalnych skurczów mechanizmem zwiększania napięcia jest podwyższenie częstotliwości wyładowań fazowych jednostek ruchowych. Plan aktywacji jednostek motorycznych zależy od wymagań ruchowych:
długotrwały skurcz o średnim natężeniu nastąpi w efekcie włączania powolnych jednostek ruchowych złożonych z włókien o metabolizmie tlenowym, wysoce odpornych na zmęczenie,
podczas krótkiego, intensywnego skurczu lub w początkowej fazie słabego skurczu, gdy przezwyciężony musi być bezwład układu, włączane zostaną jednostki szybkie składające się z fazowych neuronów ruchowych jednostki alfa (wyładowania o wysokiej częstotliwości) oraz z włókien o dużej prędkości skurczu (wolnych od metabolizmu tlenowego i mało odpornych na zmęczenie). Podczas maksymalnego skurczu dowolnego pewne jednostki motoryczne nie są uaktywnione, gdyż występuje hamowanie na poziomie centralnego i obwodowego układu nerwowego (asynchroniczne włączanie jednostek motorycznych). Uważa się, że ćwiczenia terapeutyczne, takie jak neromięśniowa elektrostymulacja, wspomagają odruchowy mechanizm uczenia się, który umożliwia aktywację większej liczby jednostek ruchowych (synchroniczne włączanie jednostek motorycznych), a tym samym wzrost siły.
Na kształtowanie się siły wpływają skomplikowane procesy obwodowe i ośrodkowe. Dodatkowe włączanie jednostek motorycznych oraz wzrost ich obciążenia cieplnego (proces ośrodkowy) stanowi przeciwwagę spadku siły poszczególnych jednostek motorycznych (proces obwodowy) podczas zmęczenia. Wykazano w wielu badaniach, że mięsień szkieletowy adoptuje się do poziomu wykonywanej pracy. Przy odpowiednich ćwiczeniach może nastąpić zarówno hipertrofia włókien mięśniowych, jak również przyrost gęstości kapilarnej. W zależności od rodzaju wykonywanej pracy przeważa określony mechanizm.
Maksymalne ćwiczenia izometryczne powodują wzrost siły izometrycznej. Wytrzymałość mięśni oznacza zdolność włókien mięśniowych do utrzymania wysokiego napięcia, co jest ściśle związane z między włókienkowym obiegiem krwi. Podczas skurczu izometrycznego przepływ krwi zmniejsza się, zanim zostanie osiągnięte napięcie maksymalne, co znacznie spowalnia metabolizm. Dlatego też głównym skutkiem ćw. izometrycznych jest hipertrofia mięśniowa (włókna typu II o małej odporności na zmęczenie). Uważa się, że sub-maksymalne ćwiczenia dynamiczne zwiększają przepływ krwi, i tym samym wytrzymałość mięśni. Koniecznym wydaje się, aby podczas ES rozróżniać zabiegi na szybkich i wolnych włóknach mięśniowych, normalnych i atroficznych.
FIZJOLOGICZNE ZMIANY W MIĘŚNIACH POD WPŁYWEM NEUROMIĘŚNIOWEJ ELEKTROSTYMULACJI (NMES)
Neuromięśniowa elekrostymulacja stosowana odpowiednio długo może wpłynąć na odwracalna zmianę rozkładu włókien mięśniowych w stymulowanym mięśniu ze względu na plastyczność rozmieszczenia włókien. NMES powoduje znaczne zwiększenie poziomu SDH (dehydrogenaza bursztynowa, enzym wskazujący zdolność utleniania w mitochondriach). Wzrost SDH powoduje wzrost zdolności mięśni do metabolizmu tlenowego. Połączenie ćwiczeń + NMES powoduje wzrost ATP i dzięki temu wyższy poziom aktywności mięśni. W wyniku unieruchomienia powstaje większa atrofia (zmniejszenie rozmiaru nie ilości) włókien typu I (czerwone, wolnokurczliwe) niż typu II. Sytuacja ta ma miejsce szczególnie w I tygodniu unieruchomienia np. mięśnia czworogłowego, nawet jeżeli wykonuje pacjent ćwiczenia izometryczne. Atrofia włókien typu II jest stopniowa. NMES jeżeli nie zapobiega to opóźnia skutki powstałe w wyniku unieruchomienia (zmniejszenie siły i wytrzymałości, odruchowe hamowanie u pogorszenie koordynacji). NMES jest również skuteczna w zmniejszaniu ilości szkodliwych produktów metabolicznych i obrzęku.
PARAMETRY PRĄDÓW STOSOWANE W CZASIE NMES
KSZTAŁT IMPULSU: Dobierając kształt impulsu prądu celem jest zawsze komfortowe odczucie pacjenta. Za Bowmanem i Bakerem z Ośrodka Badawczego w Rancho Los Amigos (USA) stosuje się w stymulacji dużych grup mięśniowych impuls symetryczny, dwufazowy, w kształcie prostokąta, dla małych grup mięśniowych: asymetryczny, dwufazowy.
AMPLITUDA: W czasie zabiegu natężenie należy stopniowo zwiększać, aż do uzyskania określonej reakcji mięśni, bez odczuć bólowych. Jakość skurczu określa również wiele innych parametrów takich jak: czas trwania impulsu, częstotliwość powtarzania impulsu, cykl pracy on/off. Zwiększając natężenie powodujemy włączenie dodatkowych włókien nerwowych oddalonych od elektrody- co powoduje zwiększenie siły skurczu. Należy stosować indywidualne dawki natężenia ze względu na różną oporność skóry pacjentów. W terapii problem stanowią pacjenci otłuszczeni.
CZAS TRWANIA IMPULSU: ma ścisły związek z amplitudą. Im krótszy czas impulsu (poniżej 40 mikrosekund) tym wyższe natężenie prądu należy zastosować w celu uzyskania reakcji ruchowej. Związek między czasem impulsu a natężeniem w graficzny sposób przedstawia krzywa I/t. Optymalny czas impulsu dla całego zakresu reakcji mięśnia wynosi od 40 do 500 mikrosekund. Istnieje różnorodność w ww. zakresie w różnych urządzeniach.
CZĘSTOTLIWOŚĆ: określa ile razy na sekundę generowany jest potencjał czynnościowy.
Zwiększenie częstotliwości wpływa na tempo pobudzania nerwów motorycznych powoduje mocniejszy skurcz. Za pomocą ES następuje synchroniczne włączanie MU (jednostek motorycznych), w skurczach dowolnych występuje asynchroniczne włączanie jednostek motorycznych. Wyższa częstotliwość -szybsze zmęczenie mięśni, aby je zminimalizować obniża się częstotliwość. Niskie częstotliwości stymulacji 20-30 Hz wytwarzają odmianę włókien nerwowych z większą koncentracją wolnych włókien, wysokie częstotliwości do 100Hz powodują przyrost szybkich włókien mięśniowych.
Wstawić 2 wykresy zależności siły od częstotliwości impulsu
CZAS MODULACJI ON/OFF
Zmniejsza zmęczenie mięśni w czasie stymulacji. Określany jest jako „stosunek czasu „on” włączenia do całego czasu łańcucha pulsów lub wybuchów”. [4 on, 12 off, stosunek 1:3]. „off” czas , w czasie którego mięśnie odpoczywają przed kolejnym skurczem. Nieodpowiedni stosunek zastosowany w stymulacji powoduje szybkie zmęczenie mięśni. 1:3, 1:5→siła, wytrzymałość; 1:1, 1:2→krążenie, metabolizm. Dobór czasu „on” zależy od celu zabiegu. „on” równe 5 sekund nie powoduje całkowitego skurczu mięśniowego.
POZYCJA
Komfortowa dla pacjenta, aby widział on wyniki stymulacji, jeżeli jest to możliwe. W stymulacji osłabionych mięśni zwrócić uwagę na pozycję kończyn (stosunek długości do napięcia) wzrost długości o 20% zwiększa siłę skurczu.
ELEKTRODY
Typ i rozmiar zależy od miejsca stymulacji.
CZAS TRWANIA I CZĘSTOŚĆ LECZENIA
Cele krótkoterminowe zależą od reakcji na leczenie. Zastosowanie leczenia powyżej 6 tygodni powoduje wzrost wytrzymałości. Czas trwania każdej terapii (10-50) skurczów należy oszacować indywidualnie, w każdym przypadku w zależności od celu stymulacji i objawów zmęczenia. Ból mięśni i sztywność w następstwie stymulacji oznacza zmęczenie mięśnia. Tam, gdzie jest to możliwe stymulację należy wykonywać codziennie, 5 razy w tygodniu przez okres minimum 2 tygodni, wydłużając zależnie od reakcji i celów leczenia.
ROSYJSKA STYMULACJA- PRĄD KOTSA
Przez wiele lat do NMES mięśni normalnie unerwionych stosowano prąd neofaradyczny (prąd typu faradycznego, czas pulsu 0.5-1 msec). Dr Kots wygłosił szereg wykładów i przeprowadził również wiele ćwiczeń praktycznych będąc na wymianie naukowej na Uniwersytecie Concordia w Kanadzie (Sympozjum ES mięśni szkieletowych, 6-15 grudzień 1977). W swoim doniesieniu dr Kots przedstawił zastosowanie prądu zmiennego o sinusoidalnym kształcie fali, f=2500 Hz zmodulowanej do częstotliwości 50Hz, tzn. 10ms wybuch, 10 ms przerwa między każdym wybuchem, każdy dwufazowy puls trwa 0,4 msec.
Dr Kots jako pierwszy zastosował do stymulacji mięśni prawidłowo unerwionych prądu zmiennego średniej częstotliwości. W porównaniu z poprzednią stymulacją za pomocą prądu typu faradycznego, dzięki stymulacji za pomocą prądu zwanego prądem Kotsa lub „Rosyjską stymulacją” uzyskuje się silny skurcz mięśniowy (10-30% silniejszy niż skurcz dowolny), stymulacja jest odbierana przez pacjenta bez uczucia dyskomfortu, gdyż jest to prąd dwufazowy i nie występuje polaryzacja.
Zastosowanie do stymulacji mięśni prądu średniej częstotliwości 2500Hz, zmodulowanej do częstotliwości 50 Hz, wyzwala silny skurcz mięśnia lub grupy mięśni poprzez aktywację grubych zstępujących włókien nerwowych oraz dzięki zablokowaniu cienkich wstępujących włókien nerwowych ma działanie przeciwbólowe w obszarze stymulacji. Efekt przeciwbólowy nie łączy się z wrażeniami związanymi ze skurczem stymulowanych mięśni. Maksymalne skurcze mięśniowe powinny trwać 10-15 sekund, dlatego też dr Kots zastosował czas „on” wynoszący 10 sekund, a optymalny czas przerwy „off” 50 sekund. Podstawową zasadę stymulacji dr Kotsa zawiera reguła: czas skurczu 10 sec, czas odpoczynku 50 sec, 10 skurczów w czasie stymulacji. Głębokość penetracji zależy od zastosowanego natężenia prądu. Zabiegi należy wykonywać 5 razy w tygodniu, najlepiej przed snem. Nie stosować przed ćwiczeniami, gdyż można spowodować zmęczenia mięśni. Za pomocą elektrostymulacji próbujemy zwiększyć pojemność CUN przez rekrutację większej ilości dróg nerwowych do mięśni. Ilość sesji leczniczych zależy od celu terapii.
Dr Kots w celu zwiększenia szybkości ruchu mięśni zdrowych zaproponował 10-15 sesji leczniczych, w celu zwiększenia siły 20-25 sesji, w celu zwiększenia wytrzymałości 35 lub więcej sesji. Każda z nich zawiera 10 skurczów według wcześniej podanej formuły.
„Rosyjską stymulację” można również stosować w leczeniu urazów tkanek w celu osiągnięcia efektu przeciwbólowego lub przekrwienia. Jeżeli celem zabiegu jest działanie przeciwbólowe należy stosować formułę: czas „on” 12 sec, czas „off” 8 sec, czas zabiegu 15- 20 minut, natężenie zwiększane jest do momentu uzyskania słabych skurczów. Poprawę krążenia uzyska się stosując: czas „on”2 sec, czas „off” 2 sec, czas stymulacji 7-10 minut, natężenie zwiększane jest do momentu uzyskania słabych skurczów (zrost kości). Czasy „on” i „off” mogą być nieznacznie dłuższe, jeżeli stymulujemy większą partię mięśni. NMES za pomocą prądu Kotsa może być również stosowana w leczeniu płaskostopia i skolioz (niewielki kąt skrzywienia do 15 stopni, bez rotacji). Połączenie NMES z innymi metodami leczniczymi, szczególnie z ćwiczeniami leczniczymi zwiększa skuteczność stosowanych metod leczniczych i przyspiesza czas powrotu do zdrowia i sprawności pacjenta.
Tabela 5. Przykładowe parametry lecznicze stymulacji mięśni w przypadku atrofii.
STOPNIE ATROFII |
SILNA |
ŚREDNIA |
MAŁA |
CZĘSTOTLIWOŚĆ w Hz |
3-10 |
10-30 |
30-50 |
„ON” TIME |
5 |
5-10 |
10-15 |
„OF” TIME |
25-50 |
20-30 |
10-30 |
CZAS ZABIEGU |
5-10 |
15 |
15 |
ILOŚĆ SESJI DZIENNIE |
3-4 |
3-4 |
1-2 |
Inne nowoczesne sposoby NMES
Producenci nowoczesncyh urządzeń do elektroterapii proponują zastosowanie do NMES również prądy niskiej częstotliwości (typu Tens: impuls dwukierunkowy, prostokątny, symetryczny). Programy składają się z impulsów generowanych z określoną częstotliwością lub sekwencją impulsów generowanych z różną częstotliwością. W związku z faktem, że aktywność włókien jest różnorodna lepsze wydaje się zastosowanie F zmiennej niż stałej. Program wstępny czas impulsu 0,2 msec. F=30 Hz. I > I set - automatyczny wzrost natężenia prądu w programie, I=I set - utrzymanie, I < I set - automatyczne zmniejszenie natężenia w programie. Duże litery dla kończyn dolnych I set = 75% maksymalnego efektu mechanicznego, małe litery - programy dla kończyn dolnych. Programy: rozgrzewka, faza rozluźnienia - aktywna przerwa, osiągane napięcie nigdy nie ma wartości maksymalnej. Dzięki tej opcji można indywidualnie dobrać konkretny program dostosowany do stanu pacjenta, wieku, patologii, stanu mięśnia, celu zabiegu, na pojedyncze mięśnie lub grupę mięśni. Stopniowe, podobne do fizjologicznego włączanie włókien mięśniowych różnicuje również zabiegi na włóknach szybko i wolno kurczliwych. Za pomocą tego typu NMES realizowane są cele od leczniczych do sportowych (trening).
STYMULACJA ODNERWIONYCH MIĘŚNI
Odnerwione mięśnie różnią się od mięśni unerwionych min. reakcją na bodziec elektryczny. Mięsień bez funkcjonalnego zabezpieczenia przez nerw, do skurczu może być pobudzony przez bezpośrednią stymulację włókien mięśniowych. W związku z tym istnieją różnice między stymulacją przez nerw i bezpośrednią stymulacją odnerwionego mięśnia.
Tkanka mięśniowa jest mniej pobudliwa niż nerw, więc konieczny jest większy ładunek elektryczny do jej stymulacji. Potwierdzeniem tej tezy jest krzywa I\t dla odnerwionych mięśni. Impuls prostokątny z dostosowanym natężeniem prądu będzie stymulował odnerwione mięśni, jeżeli będzie miał odpowiedni czas trwania np. więcej niż 30ms. Większy prąd jest konieczny dla krótszego czasu pulsu, aby wywołał on skurcz mięśni.
Jeżeli wiązka nerwów motorycznych stymulowana jest w punkcie motorycznym powoduje ona równoczesną stymulację wielu jednostek motorycznych, każda z nich aktywuje wiele włókien mięśniowych co z kolei wyzwala synchroniczny skurcz dużej partii mięśnia. Dowodem na to jest pojedyncze drgnięcie, seria drgnięć lub skurcze tężcowe, jeżeli natężenie jest wystarczająco wysokie. Jeżeli nie ma unerwienia, pojedyncze włókna mięśniowe są stymulowane, gdy gęstość prądu płynącego przez nie osiągnie odpowiednią intensywność, więc skurcz powoli rozciągnie się przez mięsień. Zakres skurczu i relaksacji w odnerwionych włóknach mięśniowych jest niższy niż w normalnych mięśniach. Skutki te przyczyniają się do rozróżnienia jakości skurczu zwanego czasem „pełzanie jak skurcz”.
Nerw jest zdolny do akomodacji zmian jonowych przez błonę komórkową, pod warunkiem, że zmiany te nie są zbyt szybkie. Tkanka mięśniowa ma mniejszą zdolność do akomodacji niż tkanka nerwowa, także całkiem powolne zmiany mogą stymulować włókna mięśniowe. Właściwość ta umożliwia selektywną stymulację mięśni, w przeciwieństwie do stymulacji tkanki nerwowej, stosując wolnowzrastający puls o kształcie trójkąta.
PRZYCZYNY REDUKCJI LUB UTRATY WOLNEJ SIŁY MIĘŚNIOWEJ
Uszkodzenie górnego neuronu ruchowego.
2. Uszkodzenie dolnego neuronu ruchowego.
3. Uszkodzenie mięśni.
4. Brak połączenia nerwowo mięśniowego.
5. Funkcjonalne zaburzenia.
ad.1. W przypadku uszkodzenia górnego neuronu ruchowego nie ma zmian w dolnym neuronie lub w mięśniach, które mogłyby zmieniać reakcje elektryczne. Czasami nerwy lub mięśnie mają wzmożoną pobudliwość i reagują na niższe natężenie prądu.
ad.2. Uszkodzenie dolnego neuronu ruchowego może obejmować zarówno komórki rogów przednich, włókna korzeni nerwowych lub nerwy obwodowe. Uszkodzenia obejmujące włókna nerwowe można podzielić na trzy grupy:
Neuropraxia (pierwszy stopień uszkodzenia)- jest czasowa utrata funkcji nerwu bez trwałych zmian strukturalnych, powstała w wyniku ucisku lub zgniecenia. Stymulacja w proksymalnej części od uszkodzenia nie daje reakcji w postaci skurczu, stymulacja w dystalnej części od uszkodzenia powoduje skurcz mięśnia unerwianego przez dany nerw. Rodzaje neuropraxii: fizjologiczny blok, fizjologiczny blok i odnerwienie.
Axonotmesis ( drugi stopień uszkodzenia) powstaje, jeżeli ucisk na nerw jest długotrwały i silny, następuje przerwanie wypustek osiowych bez naruszenia osłonek, co daje dobre warunki do regeneracji. Może być ona utrudniona, jeżeli powstaną zwłóknienia w osłonkach nerwu. Reakcja zwyrodnienia. Skurcz mięśni może być wyzwolony przez bezpośrednią stymulację mięśni stosując długi czas impulsu.
Neurotmesis ( trzeci stopień uszkodzenia) przerwanie ciągłości włókien i osłonki nerwu. Obwodowy odcinek aksonu ulega zwyrodnieniu (wallerowskie).Reakcja zwyrodnienia.
Wszystkie typy uszkodzeń nerwów mogą być częściowe lub całkowite, mogą występować w kombinacji np. neoropraxia i axonotmesis. Jeżeli wszystkie włókna nerwowe zaopatrujące mięsień są uszkodzone występuje reakcja charakteryzująca całkowite odnerwienie, jeśli tylko część włókien jest uszkodzonych występuje reakcja częściowego odnerwienia. Reakcje obserwowane w wyniku uszkodzenia rogów przednich rdzenia kręgowego zależą od rozległości uszkodzenia.
ad.3. Redukcja lub osłabienie dowolnych skurczy mięśni może wynikać z osłabienia lub uszkodzenia mięśni bez zwyrodnienia nerwów ruchowych. Reakcja na elektrostymulację jest normalnego typu, ale o mniejszej sile. Jeżeli w czasie uszkodzenia nastąpi utrata tkanki mięśniowej, nie ma reakcji na prąd elektryczny. Brak reakcji może powstać w takich stanach jak: niedotlenienie z przykurczu lub w miopatiach.
ad.4. Brak połączenia nerwowo mięśniowego może powstać w myasthenia gravis, zmniejszając dowoloną siłę w wyniku braku przewodzenia. Stosujemy inne metody niż elektrostymulację.
ad.5. Utrata zdolności dowolnych skurczy może wynikać z histerycznego porażenia co nie zmienia reakcji.
STAN ODNERWIENIA
Kiedy jest przerwana ciągłość włókna nerwowego powstaje zwyrodnienie wallerowskie poniżej od miejsca uszkodzenia i powyżej do pierwszego węzła Ranviera ( około 14 dni). Jeżeli będziemy stymulować nerw poniżej uszkodzenia przed upływem powstania całkowitej degeneracji, bodziec może spowodować powstanie normalnej reakcji w mięśniu w postaci skurczu. W związku z tym, nie jest możliwe przeprowadzenie pełnego badania uszkodzenia przed upływem 3 tygodni od podejrzewanego czasu uszkodzenia. Testy przeprowadzane przed tą datą mogą dać użyteczne informacje. Jeżeli występuje degeneracja włókna nerwowego jego reakcja 3-4 dni po uszkodzeniu jest zmniejszona lub jej nie ma. Zmiany reakcji w czasie stymulacji mięśni mogą być obserwowane pod koniec pierwszego tygodnia i wskazują, że w nerwie powstają zmiany degeneracyjne. Ostateczna rozległość uszkodzenia w tym stanie nie może być oceniona. Reakcja wskazująca częściowe odnerwienie pokazuje, że jakieś włókna nerwowe degenerują, ale nie pokazuje jak wiele włókien jest objętych tym procesem i kiedy zostanie zakończony.
ELEKTRODIAGNOSTYKA UKŁADU NERWOWO-MIĘŚNIOWEGO
Definicja elektrodiagnostyki
Elektrodiagnostyka jest metodą diagnostyczną obejmującą badanie pobudliwości nerwów
i mięśni przy użyciu prądu stałego i prądów impulsowych. Celem elektrodiagnostyki jest wykazanie zmian pobudliwości zachodzących w nerwie lub w mięśniu w stanach chorobowych. Na podstawie badań elektrodiagnostycznych można :
ustalić lokalizację procesu chorobowego (czy proces chorobowy dotyczy nerwu czy mięśnia)
ocenić stopień uszkodzenia układu nerwowo-mięśniowego
wnioskować o rokowaniu
ustalić dobór właściwego leczenia
monitorować proces leczenia
ocenić ciągłość nerwu
ocenić ciągłość ścięgna mięśnia przy świeżych urazach.
Fizjologiczne podstawy elektrodiagnostyki
Wszystkie komórki organizmu wykazują zjawiska elektryczne, głównie w obrębie błony komórkowej. Błona komórkowa wykazuje dużą oporność dla przepływu przez nią prądów jonowych z uwagi na swoją warstwę lipidową. W wyniku swojej izolacyjnej funkcji błona komórkowa stanowi miejsce rozdziału ładunków dodatnich (na zewnątrz błony) i ładunków ujemnych (wewnątrz komórki). Ta różnica potencjału elektrycznego zwana krótko potencjałem błonowym występuje we wszystkich komórkach, a w komórkach nerwowych i mięśniowych określanych mianem komórek pobudliwych jest podstawą właściwości fizjologicznych związanych z ich pobudliwością. Przez pobudliwość rozumie się zdolność komórki do reagowania na bodźce. Ujemny potencjał spoczynkowy komórki nerwowej wynosi średnio -70 mV, a w komórkach mięśni poprzecznie prążkowanych wynosi od-80 mV do -90 mV.
Komórki nerwowe i mięśniowe nie tylko wykazują potencjał spoczynkowy, ale ponadto posiadają zdolność zmiany potencjału błonowego pod wpływem różnych bodźców działających na błonę komórkową. W miejscu zadziałania bodźca błona komórkowa ulega depolaryzacji. Jeżeli depolaryzacja błony komórkowej osiągnie wartość progową (-55 mV) to dochodzi do wyzwolenia potencjału czynnościowego, którego wartość szczytowa wynosi +35 mV. Samoczynnie rozprzestrzeniający się potencjał czynnościowy wzdłuż włókna nerwowego nosi nazwę impulsu nerwowego.
W zasadzie każde bodźce chemiczne lub fizyczne (w tym impulsy elektryczne) jeśli tylko działają odpowiednio długo i z odpowiednim natężeniem powodują pobudzenie komórki czyli zmianę polaryzacji błony komórkowej. Jest to fundamentalna zasada na której opiera się elektrodiagnostyka.
Wskazania do elektrodiagnostyki
pourazowe uszkodzenia splotów i nerwów obwodowych
uszkodzenia nerwów w czasie leczenia zachowawczego np. repozycja złamanej kości ramiennej z towarzyszącym jej zakleszczeniem nerwu promieniowego lub łokciowego
niedowłady lub porażenia po założeniu opatrunku gipsowego w wyniku narastającego obrzęku kończyny
niezamierzone uszkodzenia nerwów obwodowych jako powikłania operacyjne np. przy osteotomii kości strzałkowej często ulega uszkodzeniu nerw strzałkowy wspólny
zaburzenia w czynności nerwów w wyniku źle dopasowanych protez lub ortez
ucisk na nerwy obwodowe (np. zespół sobotniej nocy)
ocena reinerwacji mięśnia po leczeniu chirurgicznym
neuropatie uciskowe np. ucisk nerwu na skutek procesu nowotworowego, zespół kanału nadgarstka (przyciśnięcie nerwu pośrodkowego do więzadła poprzecznego dłoni)
choroby neurologiczne np. miotonie, miastenia, dystrofie mięśniowe, polineuropatie
zespół Volkmanna
Przeciwwskazania do elektrodiagnostyki
okolice serca u pacjentów z zaburzeniami pracy serca
ciąża - okolice nadbrzusza
po całkowitym przecięciu nerwu i chirurgicznym jego zespoleniu pierwsze badania elektrodiagnostyczne powinny być wykonywane nie wcześniej niż 2 - 3 tygodnie po operacji. Do tego czasu impulsy elektryczne mogą wpływać hamująco na procesy reinerwacji.
Ważniejsze terminy z elektrodiagnostyki
Punkt motoryczny nerwu (tzw. punkt stymulacji pośredniej) odpowiada miejscy na skórze,
w którym nerw znajduje się najbliżej jej powierzchni. Z uwagi na cienką warstwę tkanek dzielącą elektrodę stymulującą od punktu motorycznego nerwu płynący prąd nie napotyka dużego oporu.
Punkt motoryczny mięśnia (tzw. punkt stymulacji bezpośredniej) odpowiada miejscu,
w którym nerw ruchowy tworzy synaptyczne zakończenie nerwowo-mięśniowe. Akson nerwu ruchowego w pobliżu komórki mięśniowej traci osłonkę mielinową i rozdziela się tworząc wiele tzw. stopek końcowych. Impuls nerwowy przesuwając się wzdłuż włókna nerwowego obejmuje stopki końcowe depolaryzując ich błonę presynaptyczną. Następnie błona postsynaptyczna komórki mięśniowej ulega depolaryzacji, która rozchodzi się wzdłuż komórki mięśniowej wyzwalając jej skurcz. Pod wpływem działającego na komórkę mięśniową pojedynczego bodźca o sile progowej lub wyższej od progowej jej błona komórkowa ulega depolaryzacji, po której następuje skurcz całej komórki. Komórka mięśniowa odpowiada na bodziec zgodnie z prawem „ wszystko albo nic”, tzn. pod wpływem każdego bodźca o intensywności progowej lub wyższej reagując maksymalnym skurczem. Punkt motoryczny jest to strategiczne miejsce do pobudzenia impulsem elektrycznym całego mięśnia z uwagi na fakt, że włókno nerwowe jest strukturą bardziej pobudliwą (-70mV) w stosunku do włókna mięśniowego (- 90 mV).
Elektrostymulacja elektrodą czynną (inaczej metoda jednoelektrodowa) Badanie wykonuje się elektrodą o małej powierzchni (płaskiej o średnicy 12 lub 20 mm, lub kulkowej) inaczej czynną, połączoną z katodą, którą drażni się punkty motoryczne nerwu lub mięśnia. Główka elektrody czynnej powinna być zawsze skierowana prostopadle do powierzchni skóry. Elektrodę bierną, o większej powierzchni połączoną z anodą, umieszcza się przy badaniu mięśni obręczy barkowej na karku, a badając mięśnie kończyn dolnych w okolicy lędźwiowej.
Elektrostymulacja dwuelektrodowa Metoda ta polega na ułożeniu dwóch płaskich elektrod, których powierzchnia dostosowana jest do wielkości mięśnia, na przeciwległych końcach brzuśca mięśniowego. Elektroda ułożona obwodowo połączona jest z ujemnym biegunem (katodą) źródła prądu. Metoda stosowana jest w przypadku dużych mięśni (posiadających kilka punktów motorycznych) lub grup mięśniowych.
Współczesne techniki elektrodiagnostyczne
Współczesne techniki diagnostyczne dają możliwość wykorzystania dwóch sposobów oceny funkcjonowania tkanek pobudliwych : poprzez pomiar potencjałów generowanych w trakcie pobudzenia tkanki nerwowej i mięśniowej (EKG, EEG, EMG) oraz poprzez stymulację tych tkanek odpowiednimi impulsami elektrycznymi i ocenę rezultatów tej stymulacji. Obecnie elektromiografia należy do rutynowo stosowanych metod diagnostycznych. Rozkwit metod elektrodiagnostycznych opartych na stymulacji tkanek pobudliwych impulsami prądu elektrycznego nastąpił po II wojnie światowej. Metody te są znacznie tańsze, prostsze i doskonale nadające się do wstępnej diagnozy oraz monitorowania procesu leczenia. Spośród wielu stosowanych testów na uwagę zasługuje kilka, które
w praktyce lekarskiej i rehabilitacyjnej dostarczają wielu cennych informacji dotyczących wstępnej diagnostyki, prognozowania oraz oceny postępów procesu leczniczo-rehabilitacyjnego.
Wszystkie metody stosowane w elektrodiagnostyce układu nerwowo-mięśniowego można podzielić na metody jakościowe i ilościowe.
METODY JAKOŚCIOWE.
Metody jakościowe polegają na obserwacji rodzaju i siły skurczu mięśnia w odpowiedzi na określony impuls elektryczny.
A.1. Reakcje tkanek pobudliwych na prąd stały
Zgodnie z prawem Du Bois Reymonda nie sam przepływ prądu stałego tylko nagła zmiana jego natężenia, która występuje podczas zamykania i otwierania obwodu prądu galwanicznego o odpowiedniej sile jest bodźcem wyzwalającym skurcz mięśnia.
Zdrowy mięsień na stymulację prądem stałym powinien reagować zgodnie z wzorem Erba, które brzmi następująco :
najsilniejszy skurcz mięśnia uzyskuje się przy zamykaniu obwodu prądu stałego pod katodą (KZS = katoda, zamknięcie, skurcz) w sytuacji gdy elektrodą czynną jest katoda
jeżeli elektrodą czynną jest anoda to przy zamykaniu obwodu prądu stałego pod anodą uzyskuje się również skurcz (AZS = anoda, zamknięcie, skurcz) ale słabszy niż ten pod katodą
KZS > AZS
przy otwieraniu obwodu prądu stałego, w sytuacji gdy elektrodą czynną jest anoda, skurcz pod anodą jest silniejszy (AOS = anoda, otwarcie, skurcz) niż skurcz od katodą (KOS = katoda, otwarcie, skurcz) przy otwieraniu obwodu prądu stałego gdy elektrodą czynną jest katoda
AOS > KOS
W stanach patologicznych nerwów i mięśni występują odchylenia od wzoru Erba, wyrażające się jego odwróceniem np. : AZS > KZS
Rozszerzoną postacią wzoru Erba jest tzw. prawo skurczu Pflugera w opracowaniu Erba :
zastosowanie prądu stałego o bardzo małym natężeniu pozwala uzyskać skurcz mięśnia tylko przy zamknięciu obwodu prądu w którym elektrodą czynną jest katoda (KZS)
w celu uzyskania skurczu mięśnia również pod anodą przy zamykaniu lub otwieraniu obwodu (AZS, AOS), w którym elektrodą czynną jest anoda konieczne jest użycie prądu o większym niż poprzednio natężeniu
wywołanie skurczu pod katodą przy otwieraniu obwodu prądu stałego (KOS), w którym elektrodą czynną jest katoda wymaga użycia prądu o jeszcze wyższym natężeniu.
Praktyczna ocena jakościowa wpływu stymulacji nerwów i mięśni przez prąd stały opiera się na :
określeniu natężenia prądu, który wywołuje najmniejszy skurcz - w warunkach fizjologicznych, w zależności od rodzaju mięśnia, pobudliwość na prąd galwaniczny wynosi od 2 do 18 mA
określeniu jakości skurczu mięśniowego np. tężcowy skurcz mięśnia utrzymujący się podczas przerw w przepływie prądu galwanicznego świadczy albo o zbyt silnym prądzie użytym do badania, albo o nadmiernej pobudliwości mięśnia tzw. galwanotonusie. Zjawisko to występuje w ostrych stanach zapalnych nerwów ruchowych i w tężyczce.
A.2. Ocena pobudliwości obwodowych nerwów ruchowych za pomocą prądu galwanicznego.
Jest to badanie pozwalające ocenić stan nerwów obwodowych (pomaga odróżnić aksonotmesis od neurotmesis) i ewentualnie ustalić stopień odnerwienia mięśnia. Badanie wykonuje się techniką jednobiegunową, za pomocą elektrody o małej powierzchni, połączoną z katodą, którą drażni się punkty motoryczne nerwu. Elektrodę bierną anodę, umieszcza się przy badaniu mięśni obręczy barkowej na karku, a badając mięśnie kończyn dolnych w okolicy lędźwiowej. Stosuje się krótkie impulsy prostokątne, o czasie trwania 1 ms lub 0.1 ms. Test należy wykonywać po obu stronach ciała a wyniki porównać.
Jeżeli próg pobudliwości badanego mięśnia jest po jednej stronie ciała wyższy niż po przeciwnej, świadczy to o tym, że mięsień ten jest częściowo odnerwiony (różnice pobudliwości powinny sięgać rzędu kilku mA). W przypadku całkowitego odnerwienia mięśnia nie stwierdza się jego skurczu przy pośrednim drażnieniu. Zawsze jednak dla wykluczenia pomyłki, np. w skutek podrażnienia sąsiednich nerwów zaleca się wykonanie innych badań takich jak: krzywa I/t lub EMG.
Uzupełnieniem podanego testu jest test Langego, który polega na drażnieniu mięśnia prądem impulsowym średniej częstotliwości 4 kHz . Na prąd o tych parametrach skurczem reagują tylko prawidłowo unerwione mięśnie.
A.3. Reakcje układu nerwowo-mięśniowego na prąd faradyczny i neofaradyczny
Prąd faradyczny jest to prąd impulsowy małej częstotliwości. Jest on asymetrycznym prądem indukcyjnym złożonym z impulsów trójkątnych o częstotliwości od 50 do 100 Hz. Prąd ten wywołuje tężcowy skurcz mięśni zdrowych, który utrzymuje się w czasie jego przepływu. Jest to spowodowane faktem, iż impulsy działają na mięsień w krótkich odstępach czasu uniemożliwiając jego rozkurcz. Należy wspomnieć, że podstawową wadą prądu faradycznego jest przypadkowa nierównomierność amplitudy (natężenia) oraz czasu trwania impulsów i przerw między nimi.
Obecnie prąd faradyczny w elektrodiagnostyce jest zastępowany jego odmianą
- prądem neofaradycznym, który jest złożony z impulsów o przebiegu trójkątnym, czasie trwania impulsu wynoszącym 1 ms i czasie przerwy wynoszącej 19 ms i częstotliwości 50 Hz. Cenną zaletą tego prądu jest fakt, że zdrowe mięśnie pod jego wpływem odpowiadają również skurczem tężcowym, a jednoczesna stabilność parametrów prądu umożliwia pomiar wartości natężenia prądu co w przypadku prądu faradycznego było niedokładne.
A.4. Galwaniczno - faradyczny test Erba
Test ten składa się z dwóch części. W pierwszej badadanie pobudliwości układu nerwowo-mięśniowego przeprowadza się z zastosowaniem prądu galwanicznego, w drugiej prądu neofaradyczego. Zazwyczaj w każdej z tych części drażni się mięśnie bezpośrednio
i pośrednio. Drażnienie bezpośrednie wykonuje się w punkcie ruchowym odpowiadającym miejscu wniknięcia nerwu ruchowego i jego wypustki do płytki ruchowej mięśnia (punkt motoryczny mięśnia). To miejsce cechuje się najmniejszym progiem pobudliwości, mniejszym od progu pobudliwości włókien mięśniowych. Zawsze też należy drażnić mięsień pośrednio w miejscach najbardziej powierzchownego przebiegu nerwu zaopatrującego dany mięsień (punkt motoryczny nerwu).
Test wykonuje się metodą jednoelektrodową :
drażnienie pośrednie i bezpośrednie mięśnia przy zastosowaniu impulsów prostokątnych
o dłuższym czasie trwania (np. 300 ms);drażnienie pośrednie i bezpośrednie mięśnia prądem neofaradycznym.
Ocenie jakościowej i ilościowej podlega skurcz mięśnia pod kątem jego pobudliwości (jakie jest progowe natężenie prądu wywołujące skurcz minimalny) i jego charakteru
(czy skurcz jest błyskawiczny w skutek równoczesnego udziału w nim wszystkich włókien mięśniowych czy też leniwy w skutek częściowego ich odnerwienia ). Skurcz mięśnia ocenia się przede wszystkim wzrokowo. W przypadku częściowego odnerwienia należy porównać próg pobudliwości danego mięśnia z wynikami tego samego badania przeprowadzonego na mięśniu przeciwnej strony ciała.
Wyniki badania można streścić następująco :
prawidłowo unerwione mięśnie zostają pobudzone do skurczu pod wpływem drażnienia pośredniego i bezpośredniego zarówno prądem galwanicznym jak i impulsami neofaradycznymi
mięśnie odnerwione nie ulegają obudzeniu ani prądem galwanicznym ani prądem neofaradycznym przy drażnieniu pośrednim - przez nerw ruchowy
odnerwione mięśnie nie ulegają pobudzeniu również pod wpływem bezpośredniego drażnienia prądem neofaradycznym, ale drażnienie bezpośrednie (przez punkt motoryczny) przez długie impulsy prądu jednokierunkowego powoduje pobudzenie mięśnia.
Tabela 6. Wykrywanie reakcji degeneracji
Impuls |
Reakcja |
Diagnoza |
1ms puls prostokątny |
żwawy skurcz |
nie ma RD |
1ms puls prostokątny |
brak skurczu |
obecność RD |
100ms puls prostokątny |
żwawy skurcz (brak reakcji na puls 1ms) |
RD |
1000ms puls trójkątny |
żwawy ( słaba reakcja na puls 100ms, brak reakcji na puls 1ms) |
CRD |
Na podstawie testu Erba określić można, czy badany mięsień jest częściowo czy też całkowicie odnerwiony.
Częściowe odnerwienie mięśnia (częściowy odczyn zwyrodnienia) charakteryzuje się :
zmniejszeniem pobudliwości mięśnia przy bezpośrednim i pośrednim drażnieniu go prądem galwanicznym
zmniejszeniem pobudliwości mięśnia przy bezpośrednim i pośrednim drażnieniu go prądem neofaradycznym
Całkowite odnerwienie mięśnia (całkowity odczyn zwyrodnienia) charakteryzuje się :
wywołaniem leniwego, robaczkowego skurczu mięśnia przez bezpośrednie drażnienie prądem galwanicznym
brakiem pobudliwości mięśnia przy pośrednim drażnieniu prądem galwanicznym
brakiem pobudliwości mięśnia przy bezpośrednim i pośrednim drażnieniu prądem neofaradycznym
Częściowy odczyn lepiej rokuje niż całkowity; w pierwszym przypadku porażenia mogą ustąpić w ciągu 6-7 tygodni; podczas gdy w drugim mogą trwać miesiącami, a nawet pozostać na stałe.
Odczyn zwyrodnienia występuje m.in. :
po urazach powodujących uszkodzenie nerwu
w zmianach zapalnych nerwu
w zmianach zwyrodnieniowych nerwów obwodowych
w zapaleniach korzeni nerwowych
w uszkodzeniach komórek nerwowych rogów przednich rdzenia kręgowego z powodu procesów zapalnych.
Jest to test mający słabą wartość diagnostyczną, gdyż wiele czynników może wpłynąć na oczekiwaną reakcję. Takie czynniki jak: temperatura, opuchlizna, suchość skóry, ból czy infekcje mogą zmniejszać pobudliwość.
A.5. Ocena ciągłości nerwów
Jeżeli będziemy stymulować nerw motoryczny ponad progowym impulsem elektrycznym w punkcie oddalonym od odpowiedniego mięśnia i stwierdzimy skurcz tegoż mięśnia, to dowodzi to niezbicie że zachowana jest ciągłość nerwu w odcinku pomiędzy punktem stymulacji a odpowiednim mięśniem. Test jest użyteczny w praktyce traumatologicznej i neurologicznej w ocenie skutków urazów, a także w identyfikacji przebiegu pnia nerwu.
B. METODY ILOŚCIOWE
Metody ilościowe oparte są na ilościowym określeniu wielkości fizycznych (natężenia impulsu i czasu jego trwania), które stanowią miarę pobudliwości mięśnia i nerwu. Do metod ilościowych zalicza się chronaksymetrię, wyznaczenie krzywej i/t oraz współczynnika akomodacji.
B.1. Chronaksymetria
Metoda polega na oznaczaniu chronaksji tkanek pobudliwych przy użyciu specjalnego urządzenia, zwanego chronaksymetrem lub elektrostymulatora wyposażonego w obwód do pomiaru wartości szczytowej natężenia.
Reobaza jest miarą pobudliwości tkanki odpowiadającą najmniejszej wartości natężenia impulsu prostokątnego o czasie trwania 1000 ms, która powoduje reakcję tkanki pobudliwej. Wartość reobazy wyraża się w mA (C.C w obwodzie pacjenta prąd jest niezależny w pewnych zakresach od rezystancji skóry i tkanek). Duże wartości reobazy świadczą o małej pobudliwości.. Reobaza wyznacza się stosując katodę w punkcie motorycznym nerwu lub stosując technikę dwupolową. Normalna wartość reobazy wynosi od 2 do 18mA. Przykładowe wartości reobazy w różnych mięśniach: deltoid 5mA, triceps 5mA, frontalis 4mA. Wartość reobazy zależy od wielu czynników:
oporność skóry i tkanek podskórnych: dłoniowa część ręki i podeszwowa część stopy, mają dużą oporność skóry i potrzebują większego natężenia prądu. Powstające zmiany troficzne pod wpływem odnerwienia w skórze w wyniku utraty nerwów sympatycznych powodują, że skóra staje się sucha i łuskowata, co powoduje wzrost wartości reobazy.
opuchlizna i zapalenie powodują utrudnione przejście impulsu nerwowego do błony mięśniowej. Zbyt wysokie natężenie prądu powoduje nieprzyjemne odczucia pacjenta.
temperatura zmienia wartość reobazy. Ciepło obniża a zimno zwiększa wartość reobazy.
pozycja stymulującej elektrody- reobaza ma minimalną wartość, jeżeli elektroda czynna- katoda znajduje się w punkcie motorycznym lub umieszczona jest w dystalnej części mięśnia w technice dwupolowej.
Z badań klinicznych można wysnuć następujące wnioski:
degeneracja-po około10 do 15 dni po uszkodzeniu wartość reobazy zwiększa się.
odnerwienie obniża wartość reobazy do około 60% normalnej wartości. Często zdarza się, że wartość reobazy jest podwyższona, co jest wynikiem działania wielu czynników powodujących wzrost reobazy.
częściowe odnerwienie- generalnie nie powoduje zmian reobazy.
Chronaksja jest miarą pobudliwości tkanek wyrażającą się najkrótszym czasem impulsu prądu stałego o natężeniu równym podwójnej reobazie, który powoduje reakcję tkanki np. skurcz mięśnia lub powstanie impulsu w nerwie. Wartość chronaksji wyrażamy w ms. Im wartość chronaksji jest większa tym pobudliwość tkanki jest mniejsza. Oba parametry można odczytać z krzywej I/t. To właśnie wartość chronaksji ma kolosalny wpływ na obraz przebiegu krzywej I/t. Normalne wartości chronaksji są mniejsze niż 1ms ( stosując do badań aparaturę o stałym prądzie w obwodzie pacjenta). Nerwy obwodowe mają wyższą chronaksję, ponieważ zawierają włókna czuciowe i ruchowe. Po urodzeniu chronaksja jest 10 -krotnie wyższa od normalnej wartości. W 3 miesiącu życia jej wartość obniża się, potem znów staje się wyższa. Między 18 a 20 miesiącem życia chronaksja powraca do normalnej wartości. Mięśnie proksymalne mają wyższą chronaksję niż mięśnie dystalne. Mięśnie twarzy mają bardzo niski ten wskaźnik. Wiele różnych czynników może wpływać na wartość tego wskaźnika pobudliwości:
struktura skóry- zmienia wartość chronaksji oraz powoduje trudność w jej określeniu.
ischemia podnosi próg pobudliwości i obniża pobudliwość mięśni. Chronaksja wzrost o 100% pod wpływem tego stanu.
opuchlizna powoduje trudności w określeniu chronaksji.
zmęczenie-jeżeli mięsień jest zmęczony, wartość chronaksji zwiększa się podwójnie, potem powraca do normalnej wartości.
pozycja stymulującej elektrody- jeżeli nie jest ona umieszczona w punkcie motorycznym nerwu, to wartość chronaksji jest około 10 razy większa , niż w wypadku umieszczenia elektrody w punkcie motorycznym nerwu. Szczególnie w małych mięśniach niepoprawne umieszczenie elektrody powoduje zmianę wartości chronaksji.
Z klinicznych studiów można wysnuć następujące wnioski:
fizjologiczny blok nie pokazuje zmian, jeżeli nie jest długotrwający.
odnerwienie powoduje wzrost chronaksji w całym zajętym mięśniu. Wzrost chronaksji sięga od 50 do 200 razy w stosunku do normalnej wartości, czyli do 25ms. Jej wartość spada do 15ms przez 30-40 dni po odnerwieniu.
re-inerwacja- progresywny spadek wartości chronaksji, nie poprzedza on zdrowienia i nie daje wskazań zdrowienia.
uszkodzenie korzeni nerwowych- wzrost chronaksji w mięśniach unerwianych przez dany korzeń.
obwodowa neuropatia spowodowana infekcją, toksycznymi substancjami, przemysłowymi uszkodzeniami przyczynia się do zwiększenia pobudliwości nerwu następującego przez obniżenie poziomu pobudliwości.
miopatie- nie powodują znaczących zmian.
B.2. Krzywa I/t.
Krzywa I/t jest graficzną formą przedstawienia zależności pobudliwości od natężenia prądu i czasu jego przepływu. Krzywą I/t wyznaczamy dzięki zastosowaniu prądów impulsowych o przebiegu prostokątnym i trójkątnym. Ponieważ większość metod jakościowych bazuje na obserwacji reaktywności tkanki nerwowej i mięśniowej na działanie prądu stałego, które są badaniem bardzo subiektywnym, i mało przyjemnym dla pacjenta, wydaje się że krzywa I/t jest najlepszym badaniem spośród metod elektrodiagnostycznych. Jest to nieinwazyjna forma oceny reaktywności tkanek pobudliwych dostarczająca cennych informacji o stopniu uszkodzenia układu nerwowo-mięśniowego oraz pomagająca monitorować przebieg procesu zdrowienia. Wykonywanie testu i interpretacja wyników wymaga od terapeuty dużej wiedzy i praktyki.
Przypomnijmy, że depolaryzacja błony komórkowej jest wynikiem stymulacji ponadprogowym bodźcem. W przypadku elektrodiagnostyki ilościowej czynnikiem depolaryzującym błonę komórkową jest impuls elektryczny o określonym czasie trwania (szerokość impulsu) oraz amplitudzie (natężeniu prądu). Aby impuls mógł spełnić kryteria bodźca ponadprogowego musi charakteryzować się odpowiednią energią, a ściślej mówiąc ładunkiem elektrycznym tzn. iloczynem natężenia i czasu trwania.
Wiele czynników wpływa na rzetelność krzywej I\t:
temperatura skóry zmienia wartość reobazy
wilgotność powietrza zmienia wartość reobazy
głęboko położone mięśnie trudno zlokalizować, stąd też ich badanie daje zubożone wyniki
opuchlizna sprawia trudności do uzyskania wartości reboazy
ischemia powoduje wzrost progu wartości krzywej i może spowodować duży dyskomfort i ból u pacjenta, gdyż należy użyć wysokich wartości natężenia
ilość powierzchownych tkanek i tłuszczu otaczającego mięśnie powoduje wzrost oporności dla przejścia prądu
duże mięśnie takie jak deltoid and quadriceps muszą być badane częściowo. Tylko małe mięśnie mogą być badane całościowo
pozycja stymulującej elektrody. Obie techniki są korzystne, ale musi być zachowana ostrożność, aby nie stymulować przyległych lub głębiej położonych mięśni.
w czasie badania należy trzymywać elektrodę ze stałym naciskiem.
Optymalny czas dla badania krzywej I\t wynosi 10-14 dni od uszkodzenia.
Wartość diagnostyczna krzywej I\t:
wykrywanie obecności lub niebecności pobudliwych włókien nerwowych w mięśniu
(określony kształt krzywej, obecność węzła, jego pozycja jest odbiciem ilości odnerwionych włókien).
wykrywanie sygnałów reinerwacji w mięśniu.
określenie wartości chronaksji i reobazy .
monitorowanie progresji uszkodzenia ( zdrowienie lub regresja).
określanie czasu użytecznego (najkrótszy czas trwania impulsu o danym natężeniu, powodujący min. skurcz mięśnia).
Krzywą I/t wyznacza się stymulując tkanki pobudliwe impulsami prostokątnymi oraz trójkątnymi przy czym oba wykresy nanosimy na ten sam formularz, celem porównania przebiegu obu krzywych. Przygotowanie pacjenta do zabiegu :
część ciała poddana testowi powinna być dobrze ustabilizowana a mięśnie rozluźnione
mięsień poddawany testowi powinien być ogrzany (ciepła woda, ruchy bierne lub czynne)
skóra pod elektrodami powinna być odtłuszczona (np. spirtusem salicylowym)
przebarwienia i niewielkie ubytki skórne należy okryć warstwa wazeliny kosmetycznej
podkłady pod elektrodami dobrze zwilżone w celu zmniejszenia oporności skóry
elektrodą czynną jest zwykle elektroda punktowa połączona z katodą, którą za pośrednictwem podkładu lub żelu przewodzącego pobudza się punkty motoryczne mięśni lub nerwów
główka elektrody czynnej (płaska o średnicy 12 lub 20 mm, lub kulkowa) powinna być zawsze skierowana prostopadle do powierzchni skóry
przesuwając elektrodę po skórze powinno się wywierać równomierny docisk, gdyż
w przypadku niewłaściwego dolegania może nastąpić miejscowe nadmierne zagęszczenie prądu odczuwane przez pacjenta jako bardzo nieprzyjemny bodziecelektrodę bierną połączoną z anodą, umieszcza się przy badaniu mięśni w obrębie kończyny górnej na obręczy barkowej lub karku, a badając mięśnie kończyny dolnej w okolicy lędźwiowej
W tym miejscu należy wspomnieć, że do wyznaczenia krzywej I/t w przypadku dużych mięśni (posiadających kilka punktów motorycznych) lub grup mięśniowych stosuje się metodę dwubiegunową. Metoda ta polega na ułożeniu dwóch płaskich, wielkością dobranych do wielkości mięśnia elektrod na przeciwległych biegunach brzuśca mięśniowego. Elektroda ułożona obwodowo połączona jest z ujemnym biegunem źródła prądu (katoda).
Przed przystąpieniem do właściwego zabiegu musimy ustalić lokalizację punktu motorycznego. W tym celu używamy impulsu prostokątnego o czasie trwania 100 - 300 ms. Miejsce stymulacji gdzie najłatwiej uzyskujemy skurcz mięśnia bez zbytniego dociskania elektrody czynnej określamy jako punkt motoryczny. Bardzo pomocne jest zaznaczenie flamastrem położenia punktu aby przy każdej próbie stymulować to samo miejsce. Jest rzeczą niezwykle istotną aby zachować stały docisk i umiejscowienie elektrody czynnej w trakcie testu, który składa się z kilku prób. Przy znalezieniu punktu motorycznego nerwu lub mięśnia pomocne mogą być tablice topograficzne punktów motorycznych. Badanie rozpoczyna się od impulsu o szerokości 1000 lub 500 ms. Zdaniem wielu autorów można jednak zrezygnować z drażnienia impulsami prostokątnymi o wartości czasu impulsu powyżej 300 ms, gdyż nie zaobserwowano różnic w poziomie reobazy dla przedziału czasu impulsu od 250 - 1000 ms. Jako stałe kryterium przyjmuje się stwierdzony wizualnie lub wyczuwalny palpacyjnie minimalny skurcz mięśnia. Minimalny skurcz mięśnia wskazuje na najmniejszą wartość natężenia prądu przy danym czasie trwania impulsu. Te zależne od siebie wartości nanosi się na układ współrzędnych gdzie na osi odciętych (Y) znajdują się wartości natężenia prądu wyrażone w mA a na osi rzędnych (X) znajdują się wartości czasu impulsu wyrażone w ms. W celu dokładnego wyznaczenia przebiegu krzywej I/t nanosi się na wspomniany układ współrzędnych co najmniej 6 pomiarów wartości natężenia prądu dla czasów impulsów w zakresie od 300 do 0,1 ms.
C. Współczynnik akomodacji
Różnice jakie obserwuje się w reakcji mięśnia na impulsy prostokątne i trójkątne są podstawa do oznaczenie tzw. współczynnika akomodacji. Współczynnik ten określa zdolność do przystosowania (akomodacji) mięśnia do wolno narastającego prądu w impulsie trójkątnym. Innymi słowy mówi on ile razy większego natężenia impulsu trójkątnego należy użyć w stosunku do impulsu prostokątnego aby uzyskać progowy skurcz mięśnia przy czasie trwania obu impulsów równym 1000 ms. Współczynnik akomodacji to iloraz wartości progowej akomodacji (mA) przez reobazę (mA). Wartość współczynnika akomodacji dla zdrowego mięśnia mieści się w zakresie 4 - 6, dla mięśnia częściowo odnerwionego między 2 - 4, a dla całkowicie odnerwionego wynosi 1 - 2.
KRZYWA I/t MIĘŚNIA PRAWIDŁOWO UNERWIONEGO
poziomym przebiegiem krzywej określającym wartość reobazy w zakresie impulsów długich
przy wartościach impulsów 10 - 30 ms krzywa wznosi się tworząc hiperbolę, gdyż impulsom krótkim czasie trwania do wywołania skurczu mięśnia potrzebne są wyższe wartości natężenia prądu
kąt hiperboli jest rozwarty
wartość czasu użytecznego, czyli graniczna wartość impulsu o natężeniu reobazy, który jeszcze wywołuje skurcz mięśnia przesunięta jest w lewą stronę na osi rzędnych
z przebiegu krzywej i/t wyznaczonej za pomocą impulsów trójkątnych odczytujemy progową wartość akomodacji, czyli minimalne natężenie prądu potrzebne do wywołania skurczu przy czasie trwania impulsu wynoszącym 1000 ms (tzw. reobaza dla trójkąta). Wartość tego parametru dla zdrowego mięśnia jest trzy-, czterokrotnie większa od wartości reobazy wyznaczonej prze impulsy prostokątne, ponieważ prawidłowo unerwione włókna mięśniowe posiadają zdolność akomodacji, czyli niereagowania skurczem na wolno narastającą wartość natężenia w impulsach trójkątnych
impulsy trójkątne o czasie trwania 10 - 30 ms tracą swoje właściwości eksponencjonalne czyli upodabniają się do impulsów prostokątnych. Przy tak krótkich czasach narastania prądu w impulsach trójkątnych zdrowy mięsień będzie odpowiadał skurczem podobnie jak na impulsy prostokątne dlatego od tego momentu obie krzywe będą przebiegać podobnie.
wartości parametrów dla prawidłowo unerwionego mięśnia : reobaza 2 - 10 mA, chronaksja 0.1 - 1 ms, czas użyteczny 10 - 30 ms.
KRZYWA I/t MIĘŚNIA CZĘŚCIOWO ODNERWIONEGO
wykres powstaje z nałożenia na siebie dwóch krzywych : patologicznej i fizjologicznej, co świadczy o występowaniu tylko częściowego uszkodzenia unerwienia mięśnia
początkowo niska reobaza jest wynikiem obniżenia progu pobudliwości ulegających degeneracji odnerwionych włókien mięśniowych, które na impulsy elektryczne o niższych wartościach reagują wcześniej w stosunku do miocytów prawidłowo unerwionych
na wykresie krzywej obserwujemy próg załamania zwany węzłem krzywej patologicznej
część wykresu na prawo od węzła ilustruje odnerwione włókna mięśniowe
część wykresu na lewo od węzła ilustruje włókna unerwione prawidłowo
stosunek jednej części do drugiej określa w przybliżeniu stopień degeneracji mięśnia
położenie węzła niesie ze sobą bardzo ważną informacje diagnostyczną tzn. im bardziej na prawo zlokalizowany jest węzeł tym lepsze rokowanie i odwrotnie
w trakcie leczenia można przeprowadzać za pomocą krzywej i/t monitorowanie efektów terapii, tzn. przemieszczenie węzła w prawo świadczy o reinerwacji mięśnia, zaś przemieszczenie w lewo sugeruje dalej postępującą degenerację
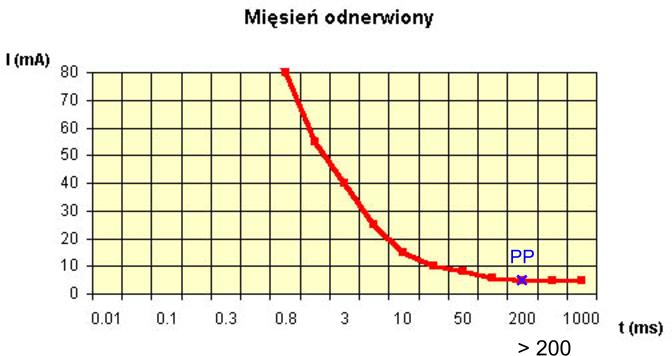
KRZYWA I/t MIĘŚNIA ODNERWIONEGO
wykres krzywej przesunięty jest w prawo i ku górze
wartości reobazy i chronaksji są podwyższone ponieważ do pobudzenia odnerwionych miocytów potrzebne są bodźce o większym ładunku elektrycznym
czas użyteczny przesunięty jest w prawo i może wynosić nawet 250 ms
stymulacja impulsami o czasie trwania mniejszym niż 50 ms może okazać się niemożliwa, ponieważ wysokie natężenie prądu potrzebnego do wywołania skurczu mięśnia będzie boleśnie odczuwane przez pacjenta
krzywa dla impulsów trójkątnych, będzie wykazywać obniżenie wartości progu akomodacji, ponieważ odnerwione miocyty wykazują słabszą zdolność adaptacyjną
w stosunku do narastających wartości natężenia prądu
DOKUMENTACJA
W celu uzyskania informacji dotyczących progresji unerwienia lub odnerwienia (monitorowanie procesu leczenia) należy dokumentować kolejne badania, co daje możliwość interpretacji zmian w czasie. Należy dokumentować kolejne krzywe, jej pozycję, wartość chronaksji, czasu użytecznego, reobazy. Wstępne badanie diagnostyczne za pomocą wykreślania krzywej i/t konieczne jest również w celu wyznaczenia planu postępowania terapeutycznego lub dalszej diagnostyki (EMG, szybkość przewodzenia).
KARTA BADANIA KRZYWA I/t , TEST CHRONAKSJI
Pacjent .........................................................Numer urządzenia..................................................
Data urodzenia.............................. Płeć M......K........
Diagnoza......................................................................................................................................
Data badania |
Nerw/ mięsień |
Krzywa I/t |
Chronakasja (norma ≤ 1ms) |
2.12.2001
|
Prawy strzałkowy głęboki/ piszczelowy przedni
Prawy strzałkowy głęboki/ prostownik palców krótki
Prawy strzałkowy wspólny/ dwugłowy uda (gł. krótka) Prawy piszczelowy/ brzuchaty łydki
Lewy strzałkowy głęboki/ piszczelowy przedni |
Wyraźnie przesunięta w prawo, gładka
Jak wyżej
Normalna
Normalna
Normalna
|
20ms
30ms
0.2 ms
0.1 ms
0.05 ms |
UWAGI: Wartość chronaksji i krzywa I/t zgodnie wskazują na silną degenerację prawego nerwu strzałkowego głębokiego na poziomie głowy strzałki. Wartości dla prawego nerwu strzałkowego powyżej kolana oraz lewego nerwu są w granicach wartości fizjologicznych. Następne badanie za 6-8 tygodni.
KARTA BADANIA KRZYWA I/t , TEST CHRONAKSJI
Pacjent .........................................................Numer urządzenia..................................................
Data urodzenia.............................. Płeć M......K........
Diagnoza......................................................................................................................................
Czas impulsu (ms) |
Mięsień.................. P/L data Natężenie w mA |
Mięsień.................. P/L data Natężenie w mA |
Mięsień.................. P/L data Natężenie w mA |
Mięsień.................. P/L data Natężenie w mA |
Mięsień.................. P/L data Natężenie w mA |
1000 |
|
|
|
|
|
500 |
|
|
|
|
|
100 |
|
|
|
|
|
50 |
|
|
|
|
|
10 |
|
|
|
|
|
5 |
|
|
|
|
|
1 |
|
|
|
|
|
0.5 |
|
|
|
|
|
0.1 |
|
|
|
|
|
0.05 |
|
|
|
|
|
UWAGI:
ELEKTROMIOGRAFIA jest metodą badawczą, która pozwala odróżnić zanik mięśni spowodowany uszkodzeniem neuronu obwodowwgo od zaniku, którego przyczyną są zmiany w samym mięśniu (miopatie). Badanie EMG polega na rejestrowaniu zmian elektrycznych w mięśniu w spoczynku i w czasie skurczu dowolnego. Każdy obwodowy neuron ruchowy unerwia pewną liczbę włókien mięśniowych i przewodzi pobudzenia wywołujące ich skurcz. Komórkę ruchową rogów przednich wraz z włóknami mięśniowymi, które są przez nią unerwiane, nazywamy jednostką ruchową. Gdy zdrowy mięsień jest całkowicie rozluźniony, nie można w nim wykryć żadnej czynności elektrycznej. Podczas skurczu mięśnia pojawiają się potencjały jednostek ruchowych. Są to dwufazowe lub trójfazowe wychylenia od linii izoelektrycznej. Podczas słabego skurczu można rozróżnić potencjały poszczególnych jednostek ruchowych. W miarę nasilania skurczu wzrasta liczba potencjałów. Podczas maksymalnego skurczu zapis ma charakter interferencyjny. W uszkodzeniu obwodowego neuronu zmniejsza się liczba komórek ruchowych i w związku z tym również jednostek ruchowych, co prowadzi do zubożenia zapisu EMG; podczas maksymalnego mięśnia liczba potencjałów jednostek ruchowych jest zmniejszona. Odnerwienie powoduje wystąpienie potencjałów fibrylacyjnych. Cechą chrakterystyczną uszkodzeń neuronu obwodowego jest pojawienie się podczas badania EMG w rozluźnionym mięśniu fibrylacji (niska amplituda, krótki czas trwania). Cechą charakterystyczną zapisu EMG skurczu mięśnia w miopatii jest występowanie zwiększonej liczby potencjałów bardzo krótko trwających i o niższej amplitudzie niż prawidłowe, szczególnie wtedy, gdy zanik jest silniej wyrażony. Drżenie włókienkowe występuje w odnerwionych włóknach mięśniowych i powstaje nadwrażliwości wyrodniejących włókien mięśniowych w stosunku do acetylocholiny znajdującej się w tkankach. Nie jest ono widoczne przez skórę. Drżenie, które widujemy u chorych jest drżeniem pęczkowym; powstaje wskutek szybkich skurczów wielu włókien mięśniowych, jest wyrazem patologicznych wyładowań komórki ruchowej. Najczęściej występuje w przewlekłych procesach zwyrodnieniowych, uszkadzających komórki ruchowe np. w stwardnieniu bocznym zanikowym. Drżenie to stwierdza się w mięśniach zanikających, w całkowicie zanikłych nie występuje. Najłatwiej można je zauważyć w mięśniach ręki międzykostnych, naramiennych i piersiowych większych; można je nasilić uderzeniem młotka w mięsień.
Przed wykonaniem elektrostymulacji należy koniecznie wykonać badania diagnostyczne (krzywa I/t) celem sprawdzenia stanu funkcji motorycznej nerwu i mięśnia oraz wyznaczenia parametrów do elektrostymulacji. W celu kontroli przebiegu leczenia należy regularnie wykonywać krzywe I/t oraz prowadzić dokumentację.!!!!!!!!
DOBÓR PARAMETRÓW LECZENIA DLA ODNERWIONYCH MIĘŚNI
CZAS. Bardzo ważne jest, aby rozpocząć elektroterapię możliwie jak najszybciej, gdyż maksymalna atrofia powstaje w ciągu pierwszych 3 miesięcy po uszkodzeniu.
CZAS I KSZTAŁT IMPULSU, CZĘSTOTLIWOŚĆ I CZAS PRZERWY.
W przypadku utraty ciągłości aksonu i degeneracji wallerowskiej stosujemy impuls eksponencjalny o długim czasie trwania (2000ms)- powstaje żwawy skurcz, przy małym natężeniu prądu, mały dyskomfort dla pacjenta.
Fizjologiczny blok- 10-100ms impuls prostokątny.
fizjologiczny blok i odnerwienie (axonotmesis i neurotmesis)- 100-2000ms impuls trójkątny lub trapezowy.
Regeneracja- nie należy stosować prądu typu faradycznego z max. skurczami.
Używamy do stymulacji impuls prostokątny o długim czasie trwania. Zachować ostrożność, aby nie przedawkować zbyt dużego natężenia prądu.
RODZAJE SKURCZÓW
Badacze uważają, że 2-3 cykle dziennie z max. izometrycznymi skurczami dają korzystny efekt w opóźnianiu atrofii. Bardzo ważne, aby nie stosować zbyt wysokiego natężenia dla pulsu o długim czasie trwania, gdyż może to spowodować szkodliwe efekty w metabolizmie i dożywieniu mięśni. Potwierdzono doświadczalnie, że optymalnym poziomem leczenia jest 20-30 skurczów, powtarzanych dwa razy dziennie. Alternatywną metodą jest stosowanie 90-200 skurczów dziennie. Bardzo ważna jest faza odpoczynku między skurczami (cas trwania przerwy jest od 3 do 5 razy dłuższy niż czas trwania skurczu) oraz między grupami skurczów- około 1 minuty. Jeżeli zakładamy wykonanie 20-30 skurczów w czasie jednego zabiegu grupujemy je po 10 z 1-2 minut przerwy między nimi. Ogromną uwagą należy zwrócić na fakt, aby mięsień nie zmęczył się. Cały czas należy obserwować skurcz. Jeżeli wykonujemy 90-200 skurczów dziennie grupujemy je w serie po 30 skurczy.
CZĘSTOTLIWOŚĆ ZABIEGÓW
Efektywność leczenia zależy od jego częstotliwości. Uważa się, że należy zabiegi wykonywać 2-3 razy dziennie. Dzięki zastosowaniu indywidualnych stymulatorów i przyuczaniu rodziny pacjenta zabiegi można wykonywać również w domu.
SELEKCJA MIĘŚNI
Stymulacja powinna być stosowana, jeżeli istnieje szansa wyzdrowienia mięśni. Są one minimalne, jeśli upłynęło około 12 miesięcy od urazu lub choroby. Maksymalne skurcze łatwiej uzyskać w małych mięśniach niż w dużych. Małe mięśnie łatwiej ulegają zwłóknieniu i potrzebują dłuższego czasu do wyzdrowienia. Mięśnie głębiej położone są trudniejsze do wyizolowania, do czego potrzebne jest większe natężenie prądu. Są również mniej podatne na zwłóknienia.
RELACJA MIĘDZY DŁUGOŚCIĄ I NAPIĘCIEM MIĘŚNIA
Pozycja początkowa mięśni powinna być następująca: mięsień powinien być rozciągnięty i dobrze podparty, aby chronić go przed nadmiernym rozciągnięciem i ruchem izotonicznym w czasie skurczu. Pozycja mięśnia razem z umiarkowanym oporem zabezpiecza ruch z maksymalnym napięciem, które jest optymalnym czynnikiem opóźniającym atrofię. Maksymalny skurcz izometryczny w tej pozycji hamuje rozwój zwłóknienia.
OCENA
Badania powinny być przeprowadzane co najmniej raz w tygodniu. Oceniamy wolne skurcze mięśniowe, czucie, krzywą I\t, EMG, wartość chronaksji, skurcz pod wpływem prądu galwanicznego, aby ocenić zdrowienie bądź regres. Czas użyteczny i chronaksja uzyskane z krzywej I\t mogą pomóc w doborze czasu pulsu do leczenia.
TEMPERATURA
W celu dobrania minimalnego natężenia prądu do uzyskania max. skurczu należy koniecznie ogrzać mięśnie przed stymulacją (ciepła kąpiel, owinięcie w ręcznik). Wzrost temperatury obniża wartość reobazy.
OPÓR SKÓRY
Duży opór skóry może spowodować ból i dyskomfort pacjenta. Zmniejszamy go przez umycie skóry i usunięcie łuszczącego się naskórka.
OPUCHLIZNA
Należy zmniejszyć opuchliznę przed stosowaniem stymulacji, gdyż jej obecność powoduje wzrost natężenia prądu.
PRZECIWWSKAZANIA
Opuchlizna: mała może być pominięta.
Ból: bolesne mięśnie nie mogą być stymulowane, gdyż nawet najmniejsze natężenie prądu wzmaga ból.
Blizny w tkance i przykurcze: duża ilość tkanki bliznowatej w skórze powyżej stymulowanych mięśni stanowi przeszkodę dla prądu i produkcji depolaryzacji błony komórkowej mięśnia.
Temperatura: zimno zmniejsza szybkość przejścia prądu przez tkanki, ciepło zwiększa szybkość. Nie stymulujemy zimnych mięśni!!!
Uszkodzenia skóry: daje możliwość oparzenia w miejscach o mniejszym oporze.
Utrata czucia: poparzenie w wyniku zastosowania zbyt wysokiego natężenia.
SKUTKI STYMULACJI ODNERWIONYCH MIĘŚNI
Opóźnianie atrofii wynikającej z odnerwienia (powtarzające się bodźce wytwarzają skurcze normalizujące metabolizm i odżywienie mięśni; zbyt mocne skurcz mogą zburzyć te procesy).
Zużytkowanie podłoża (krążenia krwi zwiększa się po odnerwieniu mięśnia w pierwszych 3 miesiącach po uszkodzeniu, występujące zaburzenia w metaboliźmie mięśni i przepuszczalności błon komórkowych mięśni nie pozwalają zużytkować tych substabcji→powstaje atrofia; stymulacja zapobiega tej sytuacji).
Wpływ na zastój w naczyniach żylnych i limfatycznych ( brak pompy mięśniowej sprzyja powstawaniu zastojowi płynów, co z kolei powoduje przykurcze mięśni i otaczających go tkanek miękkich; stymulacja zwiększa absorbcję przez aktywację mięśni).
Przyrost mięśni (w częściowych uszkodzeniach wytwarza masę mięśni przez pracę).
Utrzymanie rozciągliwości mięśni (w czasie odnerwienia zwiększa się siła zrostu w tkance kolagenowej, zwiększenie aktywności w stanach przewlekłych; skurcze opóźniają wytwarzanie tego stanu).
Infekcje: możliwość rozszerzenia się infekcji przez strumień krwi w przyległych tkankach, jeżeli stymulujemy mięśnie z infekcją.
STYMULACJA MIĘŚNI PORAŻONYCH SPASTYCZNIE - TONOLIZA
Elektrostymulacja, podobnie jak ciepło lub zimno w połączeniu z ćwiczeniami może być skutecznym narzędziem terapeutycznym czasowo zmniejszającym spastyczność. Spastyczność powstaje wskutek uszkodzenia lub dysfunkcji centralnego układu nerwowego. W wyniku braku centralnej regulacji pobudzenia wrzecion mięśniowych występuje przewaga napięcia w mięśniach zginaczach oraz osłabienie i rozciągnięcie mięśni prostowników. Stymulacja dwukanałowa jest jedną z wielu metod torowania proprioreceptywnego w celu przywrócenia fizjologicznej równowagi pobudzenia. Działanie tonolizy polega na stymulowaniu mięśni spastycznych krótkim impulsem o kształcie trójkąta o wyskim natężeniu, co wywołuje ich skurcz, a następnie rozluźnienie. W momencie rozkurczu mięśni agonistycznych (zginacze) stymuluje się serią impulsów modulowanych w amplitudzie mięśnie antagonistyczne (prostowniki). Naprzemienna odpowiedź zginaczy i prostowników przetorowuje ponownie odruchowy mechanizm wzajemnego unerwienia i przywraca czasowo równowagę fizjologiczną. W stanach cięższych można zastosować tonolizę bipolarną. Czas opóźnienia dla kończyn dolnych wynosi od 50 do 60ms, a dla kończyn górnych od 20 do 30ms. Czas trwania stymulacji w obrębie danego stawu wynosi 20 minut. Zabieg wykonuje się raz dziennie, przeciętnie 20-30 zabiegów w serii.
Szczegółowe wskazania do elektroterapii
Prąd galwaniczny (usprawnia krążenie, zmniejsza ból)
neuralgia
zaburzenia krążenia
zmiany zwyrodnieniowe w stawach
bóle mięśniowe
jonoforeza
Prąd galwaniczny impulsowy o częstotliwości 8000Hz
jonoforeza
Prąd galwaniczny impulsowy niskiej częstotliwości o trójkątnym i prostokątnym kształcie pulsu (elektrodiagnostyka krzywa I/t, elektrostymulacja mięśni)
Prąd Traberta (usprawnienie krążenia, zmniejszenie bólu, obniżenie napięcia mięśniowego)
zmiany zwyrodnieniowe w stawach
stany pourazaowe
bóle mięśniowe
zaburzenia wegetatywne
neuralgie
zaburzenia krążenia obwodowego
wzmożenie napięcia mięśniowego
Prąd neofaradyczny, modulowany (skurcze tężcowe mięśni prawidłowo unerwionych)
reedukacja mięśni
wzmocnienie siły mięśniowej
trening nowych akcji mięśniowych
Prądy diadynamiczne (zmniejszenie bólu, usprawnienie krążenia, obniżenie napięcia mięśniowego, normalizacja aktywności układu wegetatywnego)
stany pourazowe
choroby reumatyczne
zaburzenia krążenia
neuralgia
Prądy interferencyjne średniej częstotliwości (zmniejszenie bólu, normalizacja równowagi wegetatywnej, usprawnienie krążenia)
stany pourazowe
zmiany zwyrodnieniowe w stawach
przykurcze wynikające z unieruchomienia
neuralgia
bóle mięśniowe
wzmożone napięcie mięśniowe
zaburzenia krążenia
Prąd średniej częstotliwości falujący (skurcze mięśni, usprawnienie krążenia, reabsorbcja obrzęku)
wzmocnienie siły mięśniowej
obrzęk
krwiak
trening siły mięśniowej
Prąd Tens (zmniejszenie bólu, usprawnienie krążenia)
zaburzenia krążenia
bóle pooperacyjne
bóle chroniczne i ostre
obrzęk
krwiak
Przeciwwskazania
pacjenci z rozrusznikiem serca (zabiegi na klatce piersiowej i tułowiu, częstotliwość 10-60 Hz szczególnie niebezpieczna)
infekcje i procesy zapalne w stanie ostrym
zakrzepowe zapalenie żył
zagrożenie zatorem
choroby z możliwością krwawień
ciąża (rejon brzucha i dolnego odcinka kręgosłupa)
zaburzenia czucia
ból o nieznanej etiologii
aktywny nowotwór w obszarze leczenia
gruźlica
choroby przebiegające z gorączką
uszkodzenia skóry
powierzchowne implanty metalowe
miażdżyca zarostowa tętnic w okresie II b- IV wg. Fontaine'a
nie wolno stosować elektrostymulacji przez mózg
nie wolno stosować elektrostymulacji, jeżeli w pobliżu działają urządzenia o wysokiej częstotliwości (diatermia krótkofalowa lub mikrofalowa)
Środki ostrożności
nie wolno zostawiać pacjentów bez opieki w czasie zabiegów elektrostymulacji
zabiegi należy wykonywać na stole wyłożonym materiałem nieprzewodzącym
elektrody należy umieszczać w taki sposób, aby unikać stymulacji w rejonie zatoki tętnicy szyjnej
u pacjentów z chorobami serca nie jest zalecane układanie elektrod w rejonie serca na klatce piersiowej
należy ograniczać natężenie prądu z komponentem galwanicznym przy stosowaniu elektrod o małej powierzchni
w razie zgłoszenia pieczenia przez pacjenta należy bezwzględnie przerwać zabieg
elektrody należy stosować zgodnie z zaleceniami producenta i wymieniać okresowo, w zależności od zużycia, utrata właściwości elektrycznych przez elektrody grozi poparzeniem pacjenta.
Definicja bólu i terminologia
Każdy człowiek doskonale wie, co to jest ból, gdyż spotyka się z nim na co dzień, nie potrafi jednak go jednoznacznie zdefiniować. Dla pacjenta ból oznacza chorobę lub uszkodzenie, dla lekarza jest objawem, dla fizjologa rodzajem czucia. W 1979 roku Komisja Taksonomii Międzynarodowego Towarzystwa badania Bólu przyjęła taką jego definicję:
„Ból to nieprzyjemne, zmysłowe i emocjonalne odczucie towarzyszące istniejącemu lub zagrażającemu uszkodzeniu tkanki, lub odnoszone do takiego uszkodzenia”. Nie jest to oczywiście definicja w pełni wyczerpująca i uniwersalna.
Fizjologiczna rola czucia bólu czyni go rodzajem zmysłu, choć ból do zmysłów nie bywa zaliczany. Ale bez czucia bólu organizm jest narażony na ciągłe urazy i inne zagrożenia prowadzące do kalectwa. Ten rodzaj czucia jest niezbędny do prawidłowego funkcjonowania organizmu, pomagając mu przystosować się do środowiska zewnętrznego.
Fizjologiczne czucie bólu, zwaneteż u k ł a d e m n o c y c e p t y w n y m, dotyczy głównie powierzchni ciała i odbiera szkodliwe bodźce działające z zewnątrz. Bodźce płynące z wewnątrz, z narządów wewnętrznych, są zwykle bodźcami wynikającymi z procesu chorobowego i powodują ból patologiczny, który różni się dość znacznie od bólu fizjologicznego. Powstaje w wyniku działania innych bodźców, przewodzony jest przez cienkie włókna, bez osłonek mielinowych, za pomocą wielosynaptycznego układu wstępującego i odbierany jest głównie w układzie limbicznym. Reaguje też wyraźnie lepiej na środki przeciwbólowe.
B ó 1 f i z j o 1 o g i c z n y (czucie nocyceptywne), jest powodowany bodźcami zewnętrznymi, przeważnie rozpoznawalnymi i przewodzony jest włóknami cienkimi zmielinizawanymi, szybciej niż ból patologiczny, i odbierany w ośrodkach czuciowych płata ciemieniowego. Odróżnianie bólu fizjologicznego od patologicznego ma znaczenie praktyczne i dydaktyczne, chociaż nie jest to ujęte w definicji.
B ó 1 p a t o 1 o g i c z n y jest objawem choroby fizycznej lub psychicznej albo dokonanego uszkodzenia. Ból ten sam w sobie bez żadnych innych objawów może być chorobą, jak ta ma miejsce w bólach głowy. Dla medycyny ma on znaczenie diagnostyczne i jest również celem działania leczniczego, gdy sprawia cierpienie.
Ból fizjologiczny to rodzaj czucia, które staje się przedmiotem działania medycyny, kiedy zachodzi potrzeba bezbolesnego zabiegu lekarskiego.
Oprócz tych podstawowych dwóch pojęć bólu, ze zjawiskiem tym wiąże się wiele pojęć używanych w fizjologii i klinice bólu. Jest terminologia bólu.
Terminologia bólu
Allodynia jest to ból wywołany innym bodźcem niż bodziec szkodliwy. Np. powietrze działając na odkrytą miazgę zęba powoduje ból. Podobnie dotyk czy bodziec termiczny mogą wywołać wrażenie bólu, jeśli działają na miejsca zmienione.
Analgezja brak czucia bólu w miejscach, gdzie uprzednio było ono zachowane. Inaczej znieczulenie na ból.
Anestezja zniesienie wszelkiego rodzaju czucia, w tym również czucia bólu. Anestezja może być miejscowa i uogólniona.
Hiperalgezja zwiększona wrażliwość na ból, zwana też przeczulicą.
Hiperpatia podwyższony próg bólu z upośledzeniem czucia, Ból rozlany, obejmujący kończynę lub połowę ciała, wystąpić może po każdym silniejszym bodźcu. Hiperpatia występuje w zespole objawów uszkodzenia wzgórza.
Hiperanalgezja zmniejszone odczucie bólu, zwykle w następstwie uszkodzenia układu nerwowego lub działania środków przeciwbólowych.
Kauzalgia ból piekący, palący, trudny do zlokalizowania, który występuje po urazach dużych nerwów, w skład których wchodzą włókna wegetatywne.
Neuralgia nerwoból występujący zazwyczaj na skutek nieznanej przyczny.
Neuropatia uszkodzenie choroba nerwu lub wielu nerwów (polineurapatia). Neuropatie są zwykle pochodzenia zapalnego.
Próg bólu pierwsze odczucie bólu pojawiające się w następstwie działania bodźca, którego intensywność stopniowa narasta. Próg odczuwania bólu jest wartością stałą u danego osobnika, jeśli badany jest tą samą metodą i w takich samych warunkach. Płeć, rasa, czynniki zewnętrzne i wewnętrzne nie mają większego wpływu na wartość progową odczuwania bólu. Próg bólu mierzy się najczęściej siłą bodźca powodującego takie odczucie. Zazwyczaj jest to bodziec elektryczny lub termiczny. W praktyce klinicznej nie określa się progu bólowego. W hiperpatii próg bólu jest podwyższany.
Parestezja nieprawidłowe odczuwanie bodźca. W praktyce codziennej tym mianem określa się samoistne doznania czuciowe o nieprzyjemnym charakterze, co nie jest właściwe. Dla nieprzyjemnych doznań. jest miano „dysestezja", które jednak nie weszło do języka lekarskiego.
Tolerancja bólu jest ta zdolność wytrzymywania bólu do pewnego stopnia, zwanego progiem wytrzymałości na ból. Tolerancja bólu, w przeciwieństwie do progu bólu, jest cechą indywidualną i bardzo zmienną, zalegną od różnych czynników zewnętrznych
i wewnętrznych. U 1/3 ludzi tolerancja bólu jest albo mniejsza (czyściej), albo większa niż
u większości. Większą tolerancję wykazują kobiety niż mężczyźni, mniejszą dzieci i ludzie starsi. Nerwica, ranne choroby przewlekłe i wyniszczające obniżają tolerancję bólu.
W praktyce klinicznej rzadka określa się tolerancję bólu, choć może ta mieć większe znaczenie niż badanie progu bólowego.
Wraźliwość na ból jest to zdolność odczuwania bólu. Wrażliwość na ból może być prawidłowa, wzmożona, osłabiona lub zniesiona. Wzmożona wrażliwość na ból cechuje się obniżeniem tolerancji i hiperalgezją. Występuje w chorobach psychicznych, nerwicach, niektórych chorobach organicznych mózgu i w uszkodzeniach nerwów obwodowych.
Obniżenie lub brak wrażliwości na ból może być fizjologiczny lub patologiczny. Fizjologiczny brak wrażliwości na ból jest lokalny, dotyczy miejsc i narządów, które nie mają receptorów bólowych. Są to niewielkie obszary skóry i błon śluzowych oraz narządy takie jak mózg, płuca, wątroba, śledziona i inne.
Patologiczny brak wrażliwości na ból może być wrodzony lub nabyty. Wrodzony brak wrażliwości na ból, czy wrodzony brak bólu, jest ciężkim kalectwem, dość rzadka spotykanym. Jest ta pewna wada rozwojowa mózgu, w wyniku której nie rozpoznaje się bodźca bólowego, mimo jego odczuwania. zaburzenie prowadzi do ciężkich obrażeń w następstwie urazów nie dających bólu. Inną postacią wrodzonego braku wrażliwości na ból jest dziedziczna polineuropatia czuciowa, choroba nerwów obwodowych dotycząca zwykle kończyn dolnych. Choroba prowadzi do zniekształceń w stawach i owrzodzeń na skórze.
Nabyty brak wrażliwości na ból jest wynikiem choroby nerwów, rdzenia kręgowego i mózgu. Zaburzenie to najczęściej obserwuje się przy uszkodzeniach śródrdzeniowych (jamistość rdzenia, guz śródrdzeniowy ).
Przy uszkodzeniach płata ciemieniowego występuje niekiedy objaw, opisany w 1925 r. przez Schildera i Stengela jako asymbolia bólu. Chory nie rozpoznaje znaczenia bodźca bólowego i chociaż wie, że jest to ból, nie wykazuje żadnych odruchów obronnych.
Zespól bólowy jest to zespół kliniczny, którego dominującym i czasem jedynym objawem jest ból. Przyczyna najczęściej jest nie znana lub wiele różnych przyczyn wywołuje ten sam zespół, jak np. zespół bólowy kręgosłupa, zespół bolesnego barku itp. Do nazwy tej dodaje się często element czasowy - ostry, podostry lub przewlekły zespół bólowy. Leczenie polega na usunięciu bólu.
Każda klasyfikacja jest zabiegiem dość sztucznym i umownym, ale niezbędnym dla celów praktycznych oraz naukowych. Szczególne trudności nastręcza klasyfikacja zjawisk biologicznych i zmienia się ona wraz z postępem wiedzy. Odnosi się to także do bólu, który stwarza dodatkowe trudności związane ze złożonością tego zjawiska oraz dużym subiektywizmem. Klasyfikacja musi się opierać na wybranych kryteriach służących za jej podstawę, tych zaś w bólu jest wiele, dlatego też jest wiele klasyfikacji. Podstawą klasyfikacji bólu może być miejsce działania bodźca na część wstępującą łuku odruchowego, czas działania i odczuwania bólu, rodzaj bodźca, charakter odczucia doznania bólowego, siła lub natężenie bólu, jego mechanizm itp. Znajomość klasyfikacji jest niezbędna dla zrozumienia samego zjawiska i dla rozpoznania oraz podjęcia właściwych kroków leczniczych.
Anatomiczna klasyfikacja bólu
Punktem wyjścia tej klasyfikacji jest anatomiczne miejsce w układzie wstępującym czucia bólu, na które działa bodziec.
Ból receptorowy Powierzchniowy
Głęboki
Ból przewodowy
Ból ośrodkowy Organiczny - wzgórzowy
czynnościowo/psychogenny - mięśniowy
rozlany
|
B ó 1 r e c e p t o r o w y odbierany jest przez receptory i jest najbardziej naturalnym i najbardziej fizjologicznym rodzajem bólu. Receptory bólowe są rozmieszczone prawie wszędzie na powierzchni ciała, w naczyniach krwionośnych (w ścianach i tkankach otaczających), w mięśniach, ścięgnach, okostnej, torebkach stawowych, opłucnej, otrzewnej i w oponach mózgu i rdzenia. Odróżnia się dwa podstawowe rodzaje bólu receptorowego: powierzchniowy i głęboki.
B ó 1 p o w i e r z c h n i o w y ze skóry, błon śluzowych, spojówek, rogówki pochodzi z bodźców zewnętrznych i ma znaczenie fizjologiczne, ochronne. Jego istnienie konieczne jest dla zachowania ciągłości tkanek i zdrowia organizmu. Ten rodzaj bólu medycyna wyłącza tylko w celu znieczulenia miejscowego dla przeprowadzenia bolesnego zabiegu. Rozległe lub miejscowe obrażenia powierzchni ciała zmieniają ból fizjologiczny w ból patologiczny o niezwykle przykrym charakterze, jak to ma miejsce w oparzeniach lub niektórych chorobach skóry. Badając ból powierzchniowy, np, ukłuciem szpilką, doznać można 2 odczuć. Jedna ostre, zlokalizowane i drugie tępe, rozlane w chwilę później, co wynika z różnej szybkości przewodzenia impulsu bólowego włóknami szybkimi A delta i wolnymi C.
B ó 1 g ł ę b o k i pochodzi z receptorów znajdujących się w naczyniach, mięśniach, stawach, okostnej i narządach wewnętrznych. Powstaje on na skutek działania bodźców wewnętrznych, które są bodźcami patologicznymi. Czynniki zewnętrzne, np. urazy, powodujące obrażenia tkanek głębokich, mogą być także przyczyną bólu głębokiego. W bólu głębokim wyróżnić można 4 podstawowe rodzaje bólów receptorowych, a mianowicie: ból naczyniowy, kostno-stawowy, mięśniowy i narządowy.
B ó 1 n a c z y n i o w y pochodzi z receptorów znajdujących się w zewnętrznej warstwie ścian naczyń tętniczych i dużych Żył. Receptory naczyniowe są wrażliwe na nadmierne pulsowanie, rozciąganie i niektóre substancje chemiczne przenikające z krwi do przydanki. Cechą charakterystyczną naczyniowego bólu jest pulsowanie, które często odczuwane jest w bólach głowy. właśnie bóle głowy tzw. samoistne mają pochodzenie naczyniowe i są klasycznym przykładem tego rodzaju bólu.
B ó 1 k o s t n o - s t a w o w y jest najczęściej spotykanym w patologii bólem nękającym człowieka, zwłaszcza w wieku starszym. Torebki stawowe, okostna i tkanka wokół stawów są bogata zaopatrzone w receptory bólowe, z drugiej zaś strony choroby stawów są bardzo rozpowszechniane, stąd częste bóle. Sama kość nie jest unerwiana i nie jest bolesna, natomiast okostna, chrząstki i więzadła oraz przyczepy mięśni są dobrze unerwiane bólowo, stąd też pochodzą bóle odnoszone do kości.
B ó 1 m i ę ś n i o w y występuje nie tylko w patologii, ale powstaje także w wyniku obciążenia i zmęczenia nadmiernym wysiłkiem. Przyczyną są metabolity, głównie kwas mlekowy nagromadzony nadmiernie w czasie pracy mięśni . Uraz, zapalenie i niedokrwienie są najczęstszymi przyczynami bólów mięśniowych w patologii. Receptory bólowe mięśni znajdują się głównie wokół naczyń, w powięziach i ścięgnach. Reagują one na bodźce mechaniczne i chemiczne, którymi są substancje przemiany materii zalegające w mięśniu lub inne substancje przenikające z krwi. Ból mięśniowy wywoływany jest doświadczalnie dla celów badawczych. Jest to najczyściej pomiar liczby skurczów dowolnych przy zamkniętym dopływie krwi. W patologii z bólem mięśniowym spotyka się lekarz w chorobie Bürgera, w zapaleniu wielomięśniowym oraz w kardiologii (choroba wieńcowa, zawał mięśnia sercowego).
B ó 1 n a r z ą d o w y występuje wyłącznie w patologii jamy brzusznej i miednicy mniejszej. Narządy miąższowe, takie jak wątroba czy nerki, nie są wrażliwe na ból, gdyż nie mają takiego unerwienia. Wrażliwa natomiast jest otrzewna pokrywająca te narządy, a zwłaszcza pęcherzyk żółciowy, pęcherz moczowy oraz jelita. Receptory znajdujące się w ścianach tych narządów są wrażliwe głównie na rozciąganie i taki jest najczęściej mechanizm bólu. Bólowi narządowemu towarzyszą zwykle dodatkowe objawy w postaci nudności i wymiotów. Ból narządowy nazywany jest często k o 1 k ą.
Ból receptorowy leczony jest środkami wpływającymi na sam mechanizm bólu, na receptory, bądź niesteroidowymi środkami przeciwbólowymi i przeciwzapalnymi. W ostateczności stosuje się środki działające ośrodkowo.
Ból przewodowy
Bó1 przewodowy powstaje w wyniku działania bodźców bezpośrednia na nerw lub na drogi przewodzenia bólu w rdzeniu kręgowym. Mechanizmy tego bólu są różne, w odróżnieniu od bólu receptorowego. Ten rodzaj bólu wyodrębniono wyłącznie na podstawie kryterium anatomicznego ze względów dydaktycznych. Wiadomo, że receptory bólowe znajdują się także w łącznotkankowych otoczkach nerwowych, trudno jest jednak udowodnić na ile ból w następstwie drażnienia nerwu pochodzi z tych receptorów, a na ile z samego nerwu. Drażnienie samego włókna nerwowego także powoduje doznania bólowe, jeśli jest to włókno przewodzące ból lub inne włókna, a bodziec jest silny - uszkadzający.
W nerwie obok włókien czuciowych i ruchowych znajdują się także włókna współczulne i przywspółczulne znajdujące się poza kontrolą świadomości. Przy urazach dużych nerwów również i te włókna biorą udział w patomechanizmie bólu. Uszkodzenie nerwu powoduje zmiany strukturalne w samym nerwie i składzie włókien biorących udział w budowie nerwu. Włókna przewodzące ból są bardziej wytrzymałe na działanie czynników szkodliwych niż inne, grubsze włókna przewodzące np. czucie proprioceptywne. Zmienia się spektrum nerwu i jego funkcja ulega zakłóceniu, Na skutek tych zmian utrudniających dośrodkowy dopływ impulsów może dojść do samoistnych bólów, nazwanych bólami deaferentacyjnymi. Taki rodzaj bólu występuje np. w nerwobólach po półpaścu lub po urazowych uszkodzeniach większych nerwów. W bólu przewodowym wyróżnia się neuralgię, ból korzeniowy, splotowy, kauzalgię i ból fantomowy.
N e u r a 1 g i a lub n e r w o b ó 1 dotyczy pojedynczego nerwu i nazywane są także rwą, ze względu na rwący charakter bólu. Najczęściej spotykaną neuralgią jest rwa twarzowa, czyli nerwoból nerwu trójdzielnego, rwa kulszowa, rwa udowa, nerwoból nerwu skórnego bocznego uda, tzw. meralgia paraesthetica (choroba Rotha). Neuralgie są to samoistne nerwobóle występujące bez uchwytnej przyczyny i często prowokowane podrażnieniem tzw. punktów spustowych. odmianą neuralgii jest nerwoból pó półpaścu dający ból ciągły (ból deaferentacyjny).
K o r z e n i o w y b ó 1 różni się od neuralgii miejscem działania bodźca bólowego i występowaniem lub nasilaniem się podczas badania objawów korzeniowych. Bóle korzeniowe są znamienne dla ucisku przez przepuklinę lub wypadnięte jądro galaretowate w kanale kregowym, albo też przez guz zewnątrzrdzeniawy. Rzadziej powodem jest proces zapalny. Bóle korzeniowe nasilają się też przy kaszlu, przy wysiłku fizycznym i promieniują wzdłuż nerwu, w skład którego wchodzi dany korzeń nerwowy.
S p 1 o t o w y b ó l powstaje w wyniku ucisku lub podrażnienia całego splotu, czyli poza kanałem kręgowym, ale przed podziałem, na nerwy. Przyczyną są najczęściej sprawy nowotworowe i zapalne toczące się w okolicy szyjnej, w_ szczycie płuca lub w miednicy mniejszej. Prawdziwy ból splotowy jest dość rzadkim zjawiskiem w klinice i częsciej dotyczy splotu barkowego niż lędźwiowego lub krzyżowego. W praktyce wiele bólów dotyczących kończyn jest rozpoznawanych jako tzw. zapalenie splotu, a w rzeczywistości nimi nie są.
K a u z a 1 g i a jest szczególną postacią nerwobólu z komponentem wegetatywnym. Jest to ból, który powstaje na skutek urazów dużych nerwów zawierających w składzie swych włókien dużą liczbę włókien współczulnych. Takim nerwem w kończynie górnej jest nerw pośrodkowy, a w dolnej nerw kulszowy i one są najczęściej dotknięte kauzalgią. Typowymi objawami kauzalgii są bóle piekące, palące i ciągłe oraz objawy wegetatywne dystroficzne. Ból powoduje unieruchomienie kończyny, a każdy bodziec wywołuje jego nasilenie. Bólowi towarzyszy duża reakcja psychiczna na ból. Mechanizm kauzalgii nie jest całkiem jasny. Wydaje się, że powodem jest "krótkie spięcie" jakie powstaje wskutek urazu między włóknami eferentnymi współczulnymi a aferentnymi czuciowymi i impulsacja bólowa z układu wegetatywnego. Objawem dystrofii wegetatywnej może być zanik Sudecka, obrzęk, sinica, zanik skóry, potliwość itp.
B ó 1 f a n t o m o w y jest szczególną postacią bólu i zaliczany jest do bólu przewodowego, ponieważ powstaje po przecięciu nerwów przy amputacji kończyny. Około 10°/o amputacji daje w następstwie ból fantomowy. Występuje częściej jeśli przed amputacją odczuwany był ból w kończynie. Utrwalona pamięć tego bólu jest jedną z hipotez tłumaczącą to zjawisko. Innym mechanizmem może być patologiczna impulsacja z kikuta kończyny, gdzie powstają nerwiaki na końcu przeciętego nerwu. Elektrostymulacja tych końców przynosi ulgę.
Leczenie bólu przewodowego jest trudniejsze niż bólu receptorowego. Nie pomagają żadne obwodowe środki przeciwbólowe. W niektórych przypadkach skuteczne mogą być środki przeciwdrgawkowe oraz inne działające ośrodkowo. Doraźny efekt dają blokady z użyciem różnych preparatów. Ostatecznością jest alkohol lub fenol albo też przecięcie nerwu, czego raczej się już nie stosuje z uwagi na możliwość powstania bólu deaferentacyjnego. Elektrostymulacje przezskórne lub z implantacją elektrod mogą być również skuteczne.
Ból ośrodkowy
Ból ośrodkowy powstaje w wyniku zmian organicznych lub czynnościowych w samym mózgu. Mózg, jak wiadomo, nie posiada receptorów bólowych i nie jest bolesny na działanie bodźca szkodliwego, jednak w rzadkich wypadkach sprawy chorobowe zlokalizowane w mózgu mogą dać odczucia bólowe. Nie odnosi się to do bólu głowy, który z reguły jest bólem receptorowym z naczyń i opony twardej tworzącej zatoki. Tak jest nie tylko w samoistnych bólach głowy, ale także w guzach mózgu i przy zwiększonym ciśnieniu śródczaszkowym. W bólu ośrodkowym wyróżnia się ból pochodzenia organicznego oraz ból czynnościowy.
O r g a n i c z n y b ó 1 pochodzenia ośrodkowego rzadziej spotyka się w praktyce lekarskiej. Powstaje on zwykle w następstwie uszkodzenia wzgórza, gdzie są podkorowe pola projekcyjne czucia. Najczęstszą przyczyną w praktyce jest udar mózgowy. W pierwszym przypadku ból obejmuje połowę ciała lub część, jest trudny do zlokalizowania, napadowy lub (rzadziej) stały, wyzwalany innymi bodźcami. Towarzyszą mu często inne objawy uszkodzenia wzgórza, takie jak upośledzenie czucia, podwyższenie progu bólowego i dyskineza.
W praktyce klinicznej stosuje się często różne inne klasyfikacje bólu uwzględniając kryteria czasu, rodzaj bodźca, skutki i znaczenie.
Ból ostry i przewlekły to często stosowany w klinice podział, odnoszący się tylko do bólu patologicznego. Kryterium czasu trwania bólu jest umowne i dość dowolnie traktowane. Na ogół za ból ostry uznaje się ból trwający nie dłużej niż 2 miesiące, a za ból przewlekły ból trwający długiej niż 6 miesięcy. Pomiędzy tymi bólami wyróżnia się jeszcze ból podostry.
B ó 1 o s t r y może być krótkotrwały i stanowić informację o zagrożeniu bodźcem szkodliwym i taki ból nazywany jest też bólem fizjologicznym. Trwa zwykle długo, jak działanie bodźca. Ostry ból może być także wyrazem choroby, jeżeli powstaje w wyniku działania wewnętrznego bodźca patologicznego. Leczenie bólu ostrego sprowadza się do usunięcia przyczyny, przy jednoczesnym działaniu przeciwbólowym.
B ó 1 p r z e w 1 e k ł y jest z reguły bólem patologicznym, objawem lub skutkiem choroby. Zwalczaniem takiego bólu zajmują się lekarze wszystkich specjalności oraz specjalne poradnie przeciwbólowe. Bólowi przewlekłemu towarzyszy psychiczna reakcja na ból w postaci depresji, którą należy brać pod uwagę w leczeniu.
Ból dzieli się jeszcze na: organiczny i czynnościowy, fizjologiczny i patologiczny, somatyczny i trzewny, naturalny i doświadczalny, mechaniczny, termiczny
i chemiczny. Podziałów może być wiele, na podstawie dowolnych kryteriów, zależnie
od celu jakiemu służą. Dla klinicysty mają wartość tylko te, które służą postawieniu właściwej diagnozy i podjęciu odpowiedniego postępowania. Podział uwzględniający kryteria anatomiczne, z uwzględnieniem podziału wg czasu trwania, najbardziej spełnia te warunki.
Patomechanizmy bólu
Ból definiowany jest jako odczucie powstające na skutek działania bodźca, którego siła jest na tyle duża, że uszkadza lub poważnie grozi uszkodzeniem tkanki. Odczuwany świadomie ból należy niewątpliwie do kategorii zjawisk psychicznych, z natury subiektywnych oraz zależnych od emocji i wielu innych czynników determinujących aktualny stan psychiczny. W normalnych warunkach psychiczne odczucie bólu ma jednak wyraźny i nierozerwalny związek z fizjologicznymi i patologicznymi procesami (zjawiskami) zachodzącymi w tkance pod wpływem odpowiednio silnego bodźca i wywołanego nim uszkodzenia.
Biologiczną podstawą odczucia bólu jest fizjologiczny proces zwany n o c y c e p c j ą. Nazwa pochodzi od łacińskiego słowa "nocere" uszkadzać. Zadaniem nocycepcji jest rozpoznawanie i reagowanie na silne bodźce powodujące aktualnie lub potencjalnie uszkodzenie tkanki, na którą działają. Nocycepcja nie jest więc tylko procesem czuciowym i nie może być utożsamiana z czuciem bólu, rozumianym jako jeden z rodzajów czucia, analogiczny do czucia dotyku czy temperatury, a różniący się od nich jedynie siłą działającego bodźca czy przebiegiem dróg dośrodkowych. Celem procesu nocycepcji nie jest zapewnienie optymalnej percepcji silnego bodźca (bólowego), ale reakcja na zagrożenie jakie on ze sobą niesie, mająca doprowadzić do uniknięcia lub zmniejszenia wielkości i następstw uszkodzenia. Fizjologiczna podstawa samego odczucia bólu, podobnego w swojej istocie do odczucia np. dotyku, stanowi jedynie niewielki fragment nocycepcji, umożliwiający uświadomioną reakcję na ból.
Opracowanie informacji nocyceptywnej, zarówno w celu jej rozpoznania, jak i odpowiedniego zareagowania, odbywa się na różnych poziomach układu nerwowego, nazywanych piętrami nocycepcji. Piętro najniższe to poziom receptorów tkankowych. Decyduje on o wstępnym rozpoznaniu bodźca jako uszkadzającego. Reakcja na tym piętrze nocycepcji polega przede wszystkim na zmianie wrażliwości receptorów i ich wpływu na utaczającą tkankę. Dokładniejsza i, jak się wydaje, najważniejsza analiza bodźca nocyceptywnego dokonuje się w rogu tylnym rdzenia kręgowego. Z rdzeniowego piętra nocycepcji pochodzą też reakcje odruchowe: motoryczna (róg przedni) i współczulna (róg boczny). Opracowywanie informacji na wyższych poziomach (pień mózgu, wzgórze, układ limbiczny, kora mózgowa) jest już bardziej wybiórcze, a jednocześnie złożone i syntetyczne. Na każdym z tych pięter powstaje także swoista reakcja. Związane z bólem reakcje autonomiczne (krążeniowe, oddechowe) powstają na poziomie pnia, reakcje hormonalne na poziomie podwzgórza, a emocjonalne w układzie limbicznym.
Poszczególne piętra nocycepcji są ze sobą połączone wieloma drogami nerwowymi, zapewniającymi nie tylko dośrodkowy (wstępujący) przebieg impulsacji nocyceptywnej, ale równie ważną komunikację odśrodkową. Odkrycie istnienia tzw. zstępujących dróg bólu w rdzeniu i ich hamującego wpływu na przekaźnictwo nocyceptywne w rogu tylnym przyniosła przełom w rozumieniu mechanizmów bólu i analgezji. Obecnie znane są już drogi zstępujące między każdym piętrem nocycepcji w ośrodkowym układzie nerwowym. Rolę dróg zstępujących do receptorów odgrywają włókna współczulne.
Nocycepcji nie da się wyodrębnić strukturalnie ani nawet czynnościowo. Jej specyficzność jest zaznaczona jedynie w obwodowym układzie nerwowym, gdzie wyróżnić można specyficzne dla bodźców uszkadzających receptory i rodzaje włókien nerwowych.
W rdzeniu kręgowym na neurony reagujące wyłącznie na bodźce bólorodne stanowią znikomy procent ogólnej populacji komórek rogu tylnego, a odczucie bólu może powstać przy drażnieniu komórek, które prócz informacji nocyceptywnej otrzymują także inną, nienocyceptywną. Powyżej poziomu rdzenia nie ma już w ogóle komórek wyłącznie nocyceptywnych, ani też żadnych ośrodków bólu, które można by porównać np. do topograficznie zorganizowanych korowych reprezentacji czucia dotyku, zmysłu wzroku czy słuchu. Informacja nocyceptywna przekazywana jest jednocześnie do różnych części ośrodkowego układu nerwowego, odpowiedzialnych za poszczególne komponenty odczucia bólu (zmysłowe, emocjonalne) oraz za pewne cząstkowe reakcje składające się na ogólną, całościową odpowiedź na ból, nazywaną "zachowaniem" bólowym (behawiorem bólu).
W warunkach fizjologicznych aktywizacja każdego rodzaju nocyceptorów powoduje powstanie odczucia bólu. w bólu wywołanym eksperymentalnie, gdzie na osobę badaną nie działają żadne inne bodźce, a jej stan psychiczny i emocjonalny jest wyrównany, istnieje ścisła zależność między nasileniem działającego bodźca oraz wielkością wywołanej nim impulsacji w drogach dośrodkowych, a intensywnością odczucia bólu. Podobna zależność w warunkach naturalnego, wywołanego jakimś procesem patologicznym, bólu jest rzadka i występuje np. po urazie mechanicznym, takim jak uderzenie. Im silniejsze uderzenie tym silniejsze odczucie bólu. Reguła ta ma jednak swoje granice. Powyżej pewnego poziomu uszkodzenia tkanki nasilenie i długotrwałość odczucia bólu zależne jest już nie od siły uderzenia, a od wytworzenia się specyficznych, patologicznych mechanizmów bólu.
Działający na tkankę bodziec o znacznej sile może spowodować uszkodzenie odpowiedzialnych na nocycepcję receptorów, włókien czy pni nerwowych. Różne czynniki patologiczne mogą także uszkadzać zaangażowane w nocycepcję struktury ośrodkowego układu nerwowego. Zmienia to w sposób istotny przebieg tego procesu. Nocycepcja jest wzbudzana poza receptorami, a jej impulsacja przebiega także innymi niż normalnie drogami.
Mechanizm bólu patologicznego różni się więc istotnie od powstającego w warunkach fizjologicznych, tzn. zapoczątkowanego pobudzeniem obwodowych receptorów
i z zachowaniem prawidłowego przebiegu nocycepcji na każdym jej piętrze. Różnice w mechanizmach bólu fizjologicznego (nocyceptywnego, receptorowego, somatogennego)
i patologicznego (dysnocyceptywnego, neurogennego) znajdują swoje odbicie w odmienności obrazu klinicznego i reaktywności na leki przeciwbólowe.
Nocycepcja jest procesem dynamicznym. Długotrwałe utrzymywanie się bólu, niezależnie od początkowej przyczyny, prowadzi do postępującej w czasie zmiany fizjologicznych mechanizmów nocycepcji i wytworzenia się patologicznych mechanizmów, które mogą podtrzymywać ból, mimo ustąpienia pierwotnego czynnika sprawczego, np. zapalenia, dochodzi wtedy do powstania tzw. bólu przewlekłego. Jego mechanizm może być obwodowy, jak się to dzieje w przypadku bólu mięśniowo-powięziowego, lub ośrodkowy, np. w bólu fantomowym.
Receptory i neurochemia bólu
Występujące na zakończeniach włókien nerwowych receptory charakteryzują się różną wrażliwością na bodźce, nie tylko pod względem ich rodzaju (bodźce mechaniczne, termiczne i chemiczne), ale takie nasilenia. Receptory reagujące jedynie na bodźce, których siła stanowi zagrożenie dla tkanki, na którą działają, nazywane są n o c y c e p t o r a m i.
U ludzi można wyróżnić co najmniej trzy typy nocyceptorów, a mianowicie:
1. mechanoreceptory „o wysokim progu" reagujące jedynie na bodźce mechaniczne o dużej sile;
2. termoreceptory reagujące na temperaturę powyżej 45 stopni;
3. polimodalne reagujące zarówno na substancje chemiczne powyżej określonego stężenia, jak i na inne, silne, nocyceptywne bodźce mechaniczne lub termiczne.
Wszystkie ww. nocyceptory występują na tzw. wolnych zakończeniach nerwowych, będących końcowymi odcinkami cienkich afferentnych (dośrodkowych) włókien nerwowych, zmielinizowanych włókna A delta lub niezmielinizowanych (włókna C). W przeciwieństwie do receptorów o mniejszej pobudliwości (niskim progu), takich jak receptory dotyku, ciepła lub zimna, nocyceptory nie tworzą żadnych wyodrębnionych strukturalnie tworów, a stanowią jedynie specjalny fragment błony komórkowej zakończenia nerwu, który pod wpływem odpowiedniego bodźca generuje potencjały czynnościowe. Liczba tych potencjałów, przekształconych następnie w impulsy dośrodkowe, rośnie wraz z natężeniem działającego bodźca nocyceptywnego. W odróżnieniu od innych receptorów, nocyceptory generują potencjały czynnościowe jeszcze przez pewien czas po zaprzestaniu działania bodźca, a powtarzające się bodźce nie prowadzą do typowego dla innych receptorów zjawiska spadku pobudliwości receptora, wprost przeciwnie, powtarzające się bodźce uwrażliwiają, tzn. obniżają próg pobudliwości nocyceptorów.
Nocyceptory mechaniczne i termiczne występują głównie na zakończeniach włókien A delta, a polimodalne na zakończeniach włókien C. Eksperymenty neuro i psychofizjologiczne dowodzą, że aktywizacja nocyceptorów na włóknach A delta, których szybkość przewodzenia wynosi 10-20m/s , jest odpowiedzialna za powstanie innego odczucia bólu nie receptorów polimodalnych na włóknach C, których przewodzenie jest znacznie wolniejsze, poniżej 1 m/s. W reakcji na ukłucie szpilką dystalnej części kończyny wyróżnić można dwa kolejno po sobie następujące odczucia bólu. Ból pierwszy, występujący natychmiast po ukłuciu, odczuwany jest jako ostry i ma ściśle punktową lokalizację. Bezpośrednio po nim, z opóźnieniem około 1 sekundy, powstaje drugie odczucie, ból wtórny, odczuwany jako tępy, piekący i bardziej rozlany. Na powstanie pierwszego, ostrego bólu, który wg podziału Heada mocna nazwać bólem (czuciem epikrytycznym), odpowiedzialny jest układ włókien A delta, a za powstanie tępego, piekącego i rozlanego bólu wtórnego odpowiadającego czuciu protopatycznemu - układ włókien C.
Nocyceptory występują na skórze i błonie śluzowej oraz w tkankach głębokich (mięśnie, stawy itd.). Jak dotąd nie udowodniono ich występowania w narządach wewnętrznych, gdzie słabe i silne bodźce działają na te same receptory dając w efekcie tylko różną częstotliwość i/lub wzorzec impulsacji dośrodkowej. Niektóre tkanki, takie jak chrząstka stawowa, jądro galaretowate krążka międzykręgowego, część zbita kości, rdzeń czy mózg, pozbawione są w ogóle nocyceptorów, a tym samym możliwości reagowania odczuciem bólu na uszkodzenie. W klinice wyraża się to bezbolesnym przebiegiem uszkodzeń lub procesów zwyrodnieniowych tych struktur. Inne tkanki, np, rogówka, mają tylko nocyceptory, a ich pobudzenie nawet słabym bodźcem dotykowym powoduje ból.
Najczęstszą formą nocyceptorów są n o c y c e p t o r y p o 1 i m o d a 1 n e. Są one wrażliwe na różne, występujące naturalnie w tkankach, substancje chemiczne, ale przy stężeniach znacznie przekraczających wartości fizjologiczne, a osiągalnych dopiero przy uszkodzeniu tkanki. Niektóre z tych substancji mają zdolność bezpośredniej aktywacji (pobudzenia) nocyceptorów, a inne jedynie uwrażliwiają nocyceptory (obniżają) próg ich pobudliwości na bólorodne substancje i bodźce. Te pierwsze nazywane są obwodowymi mediatorami bólu. Wlicza się do nich m.in. jony wodoru i potasu, aminy biogenne, takie jak adrenalina, serotonina czy histamina oraz polipeptydy, np. bradykininę. Wzrost stężenia kaźdej z tych substancji jest wynikiem uszkodzenia określonej struktury w tkance. Nocyceptywny wzrost stężenia serotoniny oraz bradykininy, kalikreiny i innych tzw. kinin osoczowych w tkance występuje najczęściej po uszkodzeniu naczyń. Serotonina uwalnia się wtedy z płytek krwi, a bradykinina i inne kininy powstają z osoczowego kininogenu przez jego aktywację poza naczyniami. Za wzrost stężenia potasu odpowiedzialny jest jego wypływ z uszkodzonych komórek, a jonów wodoru tkankowe niedotlenienie prowadzące do kwasicy.
Substancjami, które nie mają zdolności bezpośredniego pobudzenia nocyceptorów, ale znacznie uwrażliwiają je na inne bodźce, są m.in. tkankowe mediatory zapalenia, takie jak prastaglandyny czy leukotrieny. Powstają one po uszkodzeniu błony kornórkowej jako produkty rozpadu kwasu arachidonowego.
Podobnie silnie uwrażliwiające działanie mają polipeptydowe neuroprzekaźniki pierwszego neuronu czuciowego, takie jak substancja P czy peptyd pochodny
genykalcytaniny (ang. calcitonin gen related peptide - CGRP). Substancje te uwalniane są do tkanek obwodowych po uszkodzeniu receptorów i dośrodkowych włókien nerwowych, gdzie normalnie są syntetyzowane i magazynowane. Substancje bezpośrednio pobudzające lub uwrażliwiające nocyceptory.
Substancja |
Źródło |
Udział w reakcji bólowej człowieka |
Wpływ na receptory |
Potas |
Uszkodzone komórki |
++ |
aktywacja |
Serotonina |
Płytki |
++ |
aktywacja |
Bradykinina |
Kininogen surowicy |
+++ |
aktywacja |
Histamina |
Mastocyty |
+ |
aktywacja |
Prostoglandyny |
Błona komórkowa |
+/- |
uwrażliwienie |
Leukotrieny |
Błona komórkowa |
+/- |
uwrażliwienie |
Substancja P |
nocyceptory |
+/- |
uwrażliwienie |
Zarówno obwodowe mediatory bólu, jak i substancje uwrażliwiające nocyceptory wzajemnie potęgują swoje działanie. Bólorodne działanie bradykininy, krótkiego 9 aminakwasowego polipeptydu, znanego jaka jeden z najsilniejszych obwodowych mediatorów bólu, jest wielokrotnie silniejsze w obecności uwrażliwiającej nocyceptory prastaglandyny E. Podobne wzmocnienie bólorodnego działania bradykininy, wyrażające się spadkiem stężenia potrzebnego da pobudzenia nocyceptarów, występuje także przy jednoczesnym wzroście stężenia potasu czy adrenaliny w tkance. Mechanizm ten umożliwia łatwe wzbudzenie aktywności układu nocyceptywnego przy jednoczesnej destrukcji różnych elementów tkanki (naczynia, włókna nerwowe, komórki itd.) co ma miejsce przy jej prawdziwym, np. urazowym uszkodzeniu, a zapobiega wzbudzeniu tej aktywności przy wybiorczym, specyficznym dla określonej patologii, np. reakcji alergicznej, wzroście stężenia tylko jednej substancji, np. histaminy.
Obwodowe mechanizmy bólu
Jednym z najlepiej poznanych obwodowych mechanizmów bólu jest hiperalgezja, czyli stan zwiększanej wrażliwości na ból. Przyczyną jej powstawania może być zapalenie, którego mediatary, takie jak prostoglandyny czy leukatrieny, długotrwale uwrażliwiają nocyceptory. Reagują one pobudzeniem na obecność w tkance jonów, amin i innych bólorodnych substancji w stężeniach znacznie poniżej groźby uszkodzenia, a czasem nawet w stężeniach niewiele przekraczających wartości fizjologiczne. To sama dotyczy innych bodźców, np. mechanicznych czy termicznych. Stan hiperalgezji może powstać także przy zmianie kierunku przebiegu impulsacji nerwowej (impulsacja wsteczna, antydromowa). Może ona być wywołana przez podrażnienie uszkadzanego nerwu lub w mechanizmie tzw. odruchu aksonalnego. W tym ostatnim przypadku dochodzi do sytuacji, w której impulsacja dośrodkowa po osiągnięciu punktu rozgałęzienia wypustek jednego aksonu przekazywana jest dalej, nie tylko dośrodkowa, ale również odśrodkowo przez drugą gałązkę. Uwalniane w sposób patologiczny z zakończeń czuciowych substancja P i CGRP mają nie tylko działanie uwrażliwiające nocyceptory, ale powodują także rozszerzenie naczyń i przechodzenie białek z osocza do tkanek. Powodują więc one pełny obraz zapalenia tkanki, który ze względu na swoje pochodzenie nazywany jest zapaleniem neurogennym. Mechanizm ten jest obecnie uważany za ważny element patogenetyczny migreny.
Powodem hiperalgezji może być również uszkodzenie nerwu ze zniszczeniem jego osłonek. Może wtedy dojść do bezpośredniego styku i przekazywania impulsacji z włókien dośrodkowych na odśrodkowe. Szczególnie bólorodne jest wytworzenie się bezpośredniego połączenia (efapsy) między dośrodkowymi włóknami nocyceptywnymi a odśrodkowymi włóknami współczulnymi. Prowadzi to do „błędnego koła" bólu, w którym impulsacja nocyceptywna z obwodu przeniesiona na eferentne włókna współczulne powoduje zwiększone uwalnianie noradrenaliny z zakończeń tych włókien, a tym samym zwiększenie wrażliwości okolicznych nocyceptorów i dalszy wzrost impulsacji nocyceptywnej.
Uszkodzenie nerwu może być przyczyną powstania innych, specyficznych mechanizmów bólu obwodowego (przewodowego). Nieuszkodzony nerw z zasady nie jest wrażliwy na bodźce zewnętrzne, np. na uderzenie. W uszkodzonym nerwie mogą natomiast powstawać impulsy nerwowe pod wpływem nawet niewielkich bodźców mechanicznych i chemicznych. Włókna dośrodkowe w miejscu uszkodzenia nerwu stają się m.in. szczególnie wrażliwe na adrenalinę i noradrenalinę. Nawet niewielki wzrost aktywności układu współczulnego, zachodzący np. w reakcji lękowej, moje już być wystarczającym powodem powstania bólu przez uwalnianie się noradrenaliny z włókien współczulnych w miejscu ich uszkodzenia.
Jeszcze innym neurogennym mechanizmem bólu obwodowego jest spontaniczne generowanie impulsów nerwowych we włóknach dośrodkowych uszkodzonego nerwu. Ta spontaniczna aktywność włókien nie powstaje w miejscu uszkodzenia, ale najczęściej w pobliżu ciała neuronu w zwoju rdzeniowym.
Wszystkie ww. mechanizmy bólu neurogennego mogą być odpowiedzialne za szczególnie intensywny ból w nerwiaku powstającym po przerwaniu ciągłości nerwu. odrastające, a nie mogące trafić do własnych otoczek włókna nerwowe są bardzo wrażliwe na wszystkie bodźce oraz spontanicznie generują impulsy nerwowe.
Bardzo częstym, ale niestety słabo poznanym pod względem patomechanizmu jest pochodzący z tkanek głębokich ból mięśniowo-powięziowy. Uważa się, że w mięśniu, w którym zbyt długo utrzymuje się wzmożone napięcie, może dojść do ogniskowej hipoksji oraz wyraźnego wzrostu stężenia substancji bólorodnych w szczególnych miejscach, zwanych p u n k t a m i s p u s t o w y m i . Są one bardziej niż otaczająca je tkanka wrażliwe na ucisk i inne bodźce. Receptory w tych punktach spustowych mają wyraźnie obniżony próg pobudliwości, a ich aktywność jest odpowiedzialna za ból, zarówno miejscowy, jak i rzutujący się do miejsc odległych. Nie jest jeszcze wiadomo czy odpowiedzialne są za to jedynie lokalne interakcje miedzy obwodowymi substancjami bólorodnymi a receptorami czuciowymi i zakończeniami włókien współczulnych, czy też pośredniczą w tym odruchowe mechanizmy motoryczne i współczulne rdzenia.
Rdzeniowe mechanizmy bólu
Róg tylny rdzenia kręgowego, jak już obecnie wiadomo, nie jest prostą stacją przekaźnikową informacji (impulsacji) między pierwszym a drugim neuronem czuciowym. Stanowi on złożony układ integracyjny, pozwalający nie tylko na analizę napływającej informacji nocyceptywnej, ale także na jej daleko idącą modulację pod wpływem impulsacji pochodzącej zarówno z obwodu (aferentacja nienocyceptywna), jak i z ośrodków ponadrdzeniowych. Dopiero taka, w znacznym stopniu przetworzona informacja przekazywana jest do ośrodków ponadrdzeniowych oraz do efferentnych części rdzenia realizujących odruchową odpowiedź ruchową (róg przedni) i współczulną (róg boczny).
Przenoszące informację nocyceptywną włókna C i A delta wnikają do rdzenia kręgowego przez korzenie grzbietowe (tylne) i kończą się synapsami na neuronach rogu tylnego istoty szarej rdzenia. W miejscu połączenia korzenia z rdzeniem włókna nocyceptywne ułożone są bardziej bocznie niż pozostałe, tworząc tzw. wiązkę boczną korzenia. Przed dotarciem do rogu tylnego włókna te oddają dodatkowe wypustki (kolaterale) skierowane ku górze i dołowi. Umożliwiają one przekazywanie informacji nocyceptywnej nie tylko do segmentu rdzenia odpowiadającemu korzeniowi, w którym przebiegają włókna, ale także do kilku segmentów sąsiednich. Osiągając róg tylny włókna nocyceptywne kończą się w różnych jego warstwach. Włókna C kończą się w położonej najbardziej zewnętrznie warstwie komórek brzeżnych (warstwa I wg Rexeda) oraz w leżącej nieco głębiej istocie galaretowatej (warstwy II i III). Włókna A delta docierają do warstw głębszych [jądro własne rogu tylnego warstwy IV, V i VI), ale kończą się takie w warstwie I. Neurony rdzenia, do których przekazywana jest informacja nocyceptywna, można podzielić na specyficznie nocyceptywne, konwergencyjne i wstawkowe. Neurony specyficznie nocyceptywne to przede wszystkim duże komórki warstwy brzeżnej (I). Utrzymują one informacje ze stosunkowo małych pól recepcyjnych skóry i tkanek głębokich. Komórki konwergencyjne, zwane także szerokozakresowymi (ang. wide-dynamic-range neurons), otrzymują informację zarówno nocyceptywną, jak i nienocyceptywną. Mogą więc reagować w zależności od intensywności i rodzaju bodźca. Oba wymienione wyżej typy komórek przekazują informację bezpośrednio da struktur ponadrdzeniowych, mogą więc być traktowane jako drugi neuron drogi czuciowej. W udrożnieniu od nich neurony wstawkowe mają połączenia jedynie z innymi komórkami rdzenia. Największe znaczenie dla nocycepcji mają neurony wstawkowe umiejscowione w istocie galaretowatej .
Pierwszą poważną próbą wyjaśnienia skomplikowanych procesów na temat informacji bólowej na poziomie rdzenia kręgowego była opublikowana w 1965r. teoria wrót kontrolnych bólu (gate control theory). U podstaw tej teorii leżała obserwacja hamującego wpływu drażnienia grubych, szybko przewodzących włókien nienocyceptywnych A beta na przekazywanie informacji nocyceptywnej w rogu tylnym. Na podstawie wyników badań własnych i opublikowanych przez innych, autorzy tej teorii, Melzack i Wall, przyjęli, że kierująca się do komórek konwergencyjnych warstwy V rdzenia impulsacja zarówno nienocyceptywna we włóknach A beta jak i nocyceptywna we włóknach A delta i C, dociera wcześniej, poprzez kolaterale tych włókien, do hamujących neuronów wstawkowych istoty galaretowatej w warstwie II i III. Oba rodzaje impulsacji różnią się jednak znacznie swoim działaniem na te komórki. Impulsacja nienocyceptywna je pobudza, a nocyceptywna hamuje. Wypustki komórek istoty galaretowatej tworzą połączenia synaptyczne na obu rodzajach włókien w pobliżu synaps łączących je z komórkami konwergencyjnymi. Ponieważ działanie tych komórek jest hamujące, ich pobudzenie przez impulsację nienocyceptywną hamuje w sposób presynaptyczny przekaźnictwo zamyka wrota bólu, a ich hamowanie przez impulsację nocyceptywną ułatwia przekaźnictwo otwiera wrota bólu.
Mimo licznych krytyk ze strony neurofizjologów, teoria została powszechnie zaakceptowana jako prosty model wyjaśnienia rdzeniowego mechanizmu bólu i analgetycznej skuteczności metod obwodowej stymulacji, takich jak akupunktura czy elektrostymulacja. Obecnie wiadomo, że modulacja informacji nocyceptywnej w rdzeniu jest znacznie bardziej skomplikowana niż przedstawili to Melzack i Wall. Oprócz hamowania presynaptycznego (działanie na synapsy od strony neuronu przekazującego informację) bierze w niej udział również hamowanie postsynaptyczne (działanie na synapsę od strony neuronu otrzymującego informację), a dotyczy to nie tylko komórek konwergencyjnych warstwy V rdzenia, ale także innych, np. warstwy I. Zostawiając na boku rodzaje i miejsca możliwego hamowania, najogólniej można powiedzieć, że modulacja bólu na rdzeniowym piętrze nocycepcji zachodzi pod wpływem
impulsacji nienocyceptywnej z grubych włókien Aβ;
impulsacji nocyceptywnej poprzez interneurony hamujące;
impulsacji z dróg zstępujących.
Każdy rodzaj impulsów docierających do komórki konwergencyjnej ma swoje własne synapsy i neuroprzekaźniki. W synapsach pobudzających są to m.in. substancja P i neurotensyna, a w hamujących GABA, glicyna, serotonina, noradrenalina i enkefalina. To nagromadzenie działania różnych neuroprzekaźników na jednej komórce powoduje, że uzyskanie farmakalogicznego wpływu na modulację bólu w rogu tylnym rdzenia jest bardzo trudne.
Rdzeniowe mechanizmy modulacji informacji nocyceptywnej przez informację nienocyceptywną są podstawą specyficznego patomechanizmu, zwanego b ó 1 e m
z d e a f e r e n t a c j i. Deaferentacja, czyli pozbawienie dopływu impulsacji dośrodkowej (aferentacji), może powstać w wyniku uszkodzenia nerwu obwodowego lub korzenia. Brak prawidłowego wzorca impulsacji z włókien nienocyceptywnych uniemożliwia fizjologiczną modulację impulsów nocyceptywnych. Zamiast hamowania ulegają one wzmocnieniu, co prowadzi nie tylko do nadwrażliwości neuronów konwergencyjnych na impulsację
nocyceptywną, ale także do ich spontanicznej aktywności. Ta nadmierna i lub spontaniczna aktywność neuronów konwergencyjnych w deaferentacji zmienia się w czasie. Stopniowo narasta przez pierwsze tygodnie od uszkodzenia, a potem zmniejsza się. Typowy ból
z deaferentacji powstaje po chirurgicznym przecięciu lub urazowym uszkodzeniu (wyrwaniu) korzeni. Rozlany, palący ból w obszarze znacznej niedoczulicy lub zupełnego braku czucia jest z reguły niepodatny na proste środki przeciwbólowe.
Pniowe mechanizmy bólu
Informacja nocyceptywna z komórek rogu tylnego rdzenia przekazywana jest wyżej wieloma drogami wstępującymi, przede wszystkim do wzgórza, ale także do różnych jąder pnia mózgu tworzących jego układ siatko waty. Najbardziej znana jest droga rdzeniowo-wzgórzowa. Tworzą ją włókna wywodzące się z komórek warstwy V rogu tylnego i kończące się w bocznej części wzgórza jądrze brzusznym tylnym bacznym. Droga ta jest filogenetycznie młoda i stanowi podstawę przenoszenia informacji pozwalającej na różnicowanie i lokalizowanie bodźców uszkadzających. Oprócz tej "nowej" drogi rdzeniowo-wzgórzowej istnieje jeszcze "stara", której włókna zaczynają się najczyściej w komórkach warstwy I, a kończą głównie w przyśrodkowej i centralnej części wzgórza.
Przynajmniej połowa zaangażowanych w nocycepcję włókien dróg wstępujących rdzenia nie dociera w ogóle do wzgórza, a kończy się w jądrach układu siatkowatego pnia mózgu (droga rdzeniowo-siatkowata). Układ ten, poprzez kalaterale, otrzymuje równiej impulsy z innych, przebiegających przez rdzeń, dróg czuciowych, w tym także z drogi rdzeniowo-wzgórzowej .
Neurony układu siatkowatego pnia oraz tzw. niespecyfcznych jąder przyśrodkowej i centralnej części wzgórza otrzymują informację pochodzącą od wielu komórek, najczęściej z obu stron rdzenia. Jest to więc informacja o charakterze ilościowym. Stwierdzono np., że pojedyncze neurony, wchodzącego w skład układu siatkowatego jądra olbrzymiokomórkowego, otrzymują informację nocyceptywną obustronnie z bardzo rozległych pól receptorowych, np. z kończyny lub nawet z całego ciała. Ich aktywność odgrywa istotną rolę w ogólnej reakcji wzbudzenia i orientacji na bodźce bólowe.
Bardzo ważne dla prawidłowego przebiegu nocycepcji są umiejscowione w pniu mózgu struktury, takie jak substancja szara okołowodociągowa, miejsce sinawe i jądra szwu. Są one punktem wyjścia impulsacji skierowanej z powrotem do rogu tylnego rdzenia, w tzw. zstępujących drogach bólu. Impulsacja ta powoduje bardzo silne hamowanie przekaźnictwa nocyceptywnego w rogu tylnym. Odpowiedzialna za to aktywność ww. struktur pnia nazywana jest czasem z tego powodu antynocycepcją. Wiedza na ten temat zaczęła się od obserwacji analgetycznego efektu elektrycznej stymulacji różnych regionów pnia i śródmózgowia. Potem okazało się, że w niektórych miejscach, takich jak substancja szara okołowodociągowa, stymulacja mogła być zastąpiona przez miejscowe iniekcje morfiny. Dopiero odkrycie receptorów opioidowych i ich naturalnych agonistów, enkefalin i endorfin, pozwoliło na pełne zrozumienie funkcji i wzajemnej zależności endogennych układów kontroli bólu. Obecnie wiadomo, że tworzą je co najmniej trzy układy neuroprzekaźnikowe: opioidowy, serotaninergiczny i noradrenergiczny.
Neurony układu opioidowego zgrupowane są w różnych miejscach pnia mózgu, m.in. w substancji szarej okołowodociągowej.
Aktywizacja wykorzystującego różne układy neuroprzekaźnikowe, zstępującego układu antynocycepcyjnego może być wynikiem nie tylko bezpośredniej stymulacji elektrycznej czy chemicznej w badaniu eksperymentalnym, ale powstaje także w warunkach fizjologicznych pod wpływem obwodowej stymulacja nocyceptywnej. Pośredniczą w tym inne struktury, głównie z wyższych pięter nocycepcji. Nienocyceptywne formy obwodowej stymulacji pobudzają antynocycepcję znacznie słabiej. Mamy więc tutaj do czynienia z sytuacją odwrotną niż na poziomie rdzenia, gdzie hamowanie bólu powstaje przede wszystkim pod wpływem obwodowej stymulacji nienocyceptywnej.
Stale jeszcze nie można odpowiedzieć definitywnie na pytanie, czy antynocyceptywna aktywność struktur pniowych jest procesem tonicznym, tzn. występującym stale, czy fazowym wymagającym specjalnej aktywizacji. Istnieją poważne dowody, ze jest to aktywność stała, która nasila się szczególnie w pewnych sytuacjach zagrożenia i pozwala nam nie odczuwać bólu mimo uszkadzania i wywołanej nim nocycepcji.
Ośrodkowe mechanizmy bólu
Ostateczna analiza informacji nocyceptywnej oraz wynikające z niej najbardziej złożone reakcje na ból są wyrazem aktywności wielu różnych struktur mózgu, przede wszystkim przodomózgowia. Można je zgrupować w dwa podstawowe układy realizujące odmienne aspekty percepcji i reakcji na ból:
boczna część wzgórza i somatosensoryczna kora płata ciemieniowego oraz ich połączenia z innymi strukturami odpowiedzialne za percepcyjne-dyskryminacyjny (poznawczy) aspekt bólu i za powstanie wysoko zorganizowanych i uświadomionych reakcji obronnych;
2. przyśrodkowa część wzgórza, podwzgórze, jądra podkorowe, układ limbiczny i kora czołowa odpowiedzialne za motywacyjno-emocjonalny aspekt bólu oraz wywołane bólem cierpienie i jego następstwa, takie jak reakcje behawioralne, emocjonalne, metaboliczne-hormonalne, mięśniowe itd.
Dokładne mechanizmy współdziałania tych wszystkich ośrodków dla powstania bólu są mało poznane. Jest to proces niewątpliwie bardzo skomplikowany. Jednym z jego elementów jest konfrontacja bieżącej informacji nocyceptywnej z informacją nienocyceptywną, zarówno ze skóry i tkanek głębokich, jak i z narządów zmysłów (wzrok, słuch itp.) oraz z pamięcią poprzednich zdarzeń i przeżyć. O stopniu skomplikowania i złożoności tego procesu świadczy m.in. jego podatność na dysregulację w przebiegu różnych czynnościowych zaburzeń ośrodkowego układu nerwowego. Ból jest jednym z najczęstszych objawów nerwicy, reakcji stresogennych oraz zaburzeń emocjonalnych, takich jak lęk czy depresja.
W każdym z tych stanów możemy mieć do czynienia z bólem, którego mechanizm jest pierwotnie psychogenny lub polega na ujawnieniu lub wzmocnieniu istniejących obwodowych lub ośrodkowych mechanizmów bólu, które bez udziału zaburzeń wynikających z nerwicy, lęku czy depresji, nie powodowałyby cierpienia w ogóle lub o tak dużym nasileniu.
Obserwacje kliniczne u chorych z organicznymi uszkodzeniami ośrodkowego układu nerwowego dowodzą, że charakterystyczne zespoły bólu ośrodkowego mogą powstać przy uszkodzeniach a bardzo różnej lokalizacji. Najbardziej klasyczny ból ośrodkowy, ból wzgórzowy, któremu często towarzyszy połowicza niedoczulica, allodynia lub hiperpatia powstaje przy uszkodzeniu bocznej części wzgórza. Niczym nie różniące się klinicznie zespoły bólowe mogą powstać także po uszkodzeniach innych struktur głębokich mózgu, np. w udarach krwotocznych i niedokrwiennych (ból poudarowy). Podobieństwo obrazu klinicznego bólu ośrodkowego z bólem deaferentacyjnym sugeruje podobny patomechanizm.
Kliniczne cechy bólu
Ból, jako objaw uszkodzenia lub choroby , ma swoje cechy kliniczne tj. lokalizacja, natężenie, czas trwania i jakość. Na ich podstawie lekarz dokonuje oceny bólu i ustala jego źródło. Wszystkie te cechy oceniane są subiektywnie na podstawie informacji uzyskanych od pacjenta.
Lokalizacja
Zlokalizowanie bólu nie oznacza znalezienia miejsca lub narządu chorego, ze względu na występowanie tzw. bólu przeniesionego np. ból serca odczuwany w przedramieniu, ból woreczka żółciowego pod łopatką. Biorąc pod uwagę lokalizacje rozróżnia się ból miejscowy- dobrze zlokalizowany, rozlany - trudny do zlokalizowania, zwykle głęboki i ból uogólniony. Inny podział to: ból powierzchowny i głęboki, ból skórny i narządowy.
Bardzo trudny do zlokalizowania jest ból pochodzący z narządów wewnętrznych, który rzutowany jest na powierzchnię ciała i odnoszony do poszczególnych narządów. Miejsca odnoszenia bólu zgodne są z segmentarnym unerwieniem narządów wewnętrznych i skóry, co zostało opisane przez Heada. Wg teorii Mackenziego narządy wewnętrzne nie mające unerwienia bólowego, więc impulsy z nich płynące są odczuwane tak, jakby pochodziły ze skóry unerwianej ze wspólnego segmentu rdzeniowego. Efektem wspólnego segmentarnego unerwienia skóry i narządów wewnętrznych jest odczuwanie przeczulicy na skórze w schorzeniach różnych narządów wewnętrznych. Działanie bodźcami zewnętrznymi na te miejsca może spowodować zmniejszenie lub nasilenie bólu odczuwanego z chorego narządu. Z drugiej strony działanie bodźcem bólowym na takie strefy może spowodować ból sugerujący chorobę narządu zupełnie zdrowego.
Natężenie
Odczuwanie natężenia bólu jest cecha bardzo indywidualną i zależy od cech osobniczych, czynników zewnętrznych i wewnętrznych, a przede wszystkim od siły działania bodźca bólowego.
Cechy osobnicze decydują o większej lub mniejszej wytrzymałości i tolerancji na ból, są dziedziczone wraz z innymi cechami fizycznymi i charakteru. Bardzo wiele bodźców zewnętrznych może łagodzić odczuwanie bólu, nawet całkowicie znosząc jego natężenie. Umiejętne wykorzystanie tych bodźców stosuje się w fizjoterapii (krioterapia, ciepłolecznictwo).
Zależność odczuwania natężenia bólu od czynników wewnętrznych, takich jak stan psychiczny chorego, działanie układu hormonalnego i immunologicznego jest znaczna , lecz nie do końca poznana. W leczeniu bólu, szczególnie przewlekłego coraz większą rolę odgrywa działanie psychoterapeutyczne.
Zależność natężenia bólu od siły działającego bodźca udowodniono w bólu doświadczalnym u zwierząt, a także u ludzi. W bólu patologicznym o natężeniu bodźca można wnioskować na podstawie natężenia odczuwanego bólu. Od natężenia zależy skala cierpienia, jakie odczuwa chory.
Czas trwania
Czas trwania bólu jest najbardziej wymierną spośród wszystkich cech klinicznych. Jest możliwy do zarejestrowania i przekazania. Według czasu ocenia się długość cierpienia i jego ciągłość. Jest podstawą wyróżnienia bólu ostrego i przewlekłego, bólu napadowego i ciągłego. Czas trwania bólu wraz z jego natężeniem można przedstawić graficznie.
Typ narastający może odpowiadać chorobie nowotworowej. Typ zwalniający obserwuje się w wielu chorobach np. reumatycznej, nerwobólach pochodzenia kręgosłupowego, gdzie nasilenie związane jest z rytmem dobowym, pogodą, wysiłkiem. Typ ostry polega na nagłym pojawieniu się i stopniowym ustępowaniu bólu i jest znamienny dla wielu chorób narządów wewnętrznych, urazów, krwotoków i zapaleń. Typ napadowy występuje w niektórych postaciach bólów głowy (migrena), neuralgii nerwu trójdzielnego, dnie moczanowej i innych chorobach z napadowo pojawiającymi się objawami.
Jakość
Jakość bólu lub jego charakter jest cecha pozwalająca na odróżnienie jednego bólu od drugiego. Można mówić o słowniku bólu, który w zależności od inteligencji pacjenta może być skromny lub bogaty i służy do określenia jakości bólu. Istnieją jednak pewne cechy bólu niezwykle ważne, o które należy zapytać pacjenta, jeżeli nie umieści ich w swoim opisie. Cechy te określane są jako: ból pulsujący, rwący, kurczowy, piekący, palący, rozsadzający itp.
Ból pulsujący sugeruje naczyniowe pochodzenie, a pulsowanie odpowiada fali tętna. Powstaje na skutek podrażnienia receptorów znajdujących się w ścianie naczyń, lub wokół nich. Jest to ból receptorowy i jest znamienny dla naczyniopochodnych bólów głowy.
Ból rwący oznacza się gwałtownością w narastaniu i krótkim czasem trwania, bądź narastaniem i zwalnianiem. Może promieniować zgodnie z przebiegiem nerwów (rwa twarzowa, kulszowa).
Ból kurczowy ma pochodzenie mięśniowe i występuje najczęściej w niedokrwieniu. Najczęściej obserwuje się w chromaniu przestankowym, w chorobie wieńcowej, po większych wysiłkach fizycznych i w niektórych chorobach narządów wewnętrznych (żołądek), a także przy porodzie.
Ból piekący, palący jest zwykle trudny do zlokalizowania i może być odczuwalny na powłokach zewnętrznych w neuropatiach, uszkodzeniach układu współczulnego, a także w chorobach skóry.
Ból rozsadzający pochodzi najczęściej z narządów jamy brzusznej i z głowy. Jest to ból głęboki, rozlany, tępy lub bardzo gwałtowny, często połączony z objawami wegetatywnymi w postaci wymiotów, zaczerwienienia lub zblednięcia.
Poza wymienionymi słownymi określeniami charakteru bólu istnieją dwie podstawowe jakości, którymi posługuje się lekarz określając charakter bólu, a mianowicie ból organiczny i czynnościowy (psychogenny). Odróżnienie to nastręcza niejednokrotnie wielu trudności nawet doświadczonemu lekarzowi.
W każdym przypadku bólu lekarz musi wziąć pod uwagę wszystkie jego cechy kliniczne, które mają ułatwić ocenę bólu i rozpoznać źródło jego pochodzenia.
Metody badania bólu
Badanie bólu jest zadaniem trudnym, jako że sam ból jest zjawiskiem bardzo subiektywnym i zależnym od wielu czynników. W praktyce każdy lekarz musi dokonać oceny bólu i zarejestrować jego podstawowe cechy kliniczne, jakimi są: lokalizacja, natężenie, czas trwania i jakość lub charakter bólu. Poza tym, musi też dokonać oceny drugiego komponentu bólu, czyli reakcji na ból ze strony psychiki, układu ruchowego, wegetatywnego i w rzadkich przypadkach wewnątrzwydzielniczego. Ocenia się całość zjawiska związanego z bólem, tj. oba jego komponenty, czyli odruch bólowy. Celowi temu służą różne metody proste lub bardziej złożone, metody doświadczalne, psychologiczne, kliniczne i laboratoryjne za pomocą aparatury i techniki elektrofizjologicznej.
Najłatwiejsze i najbardziej obiektywne są doświadczalne metody badania bodźca bólowego, kiedy jest on znany, wymierny oraz działa na określone miejsce w określonym czasie. Do tego celu stosuje się bodziec mechaniczny, termiczny, elektryczny lub chemiczny. Metody te stosuje się tylko w laboratoriach dla celów naukowy-badawczych, przeważnie na zwierzętach, rejestrując za pomocą specjalnej aparatury recepcję, przewodzenie i odbiór impulsu wywołanego bodźcem. Za pomocą tych metod można określić również próg bólu oraz tolerancję, czyli wytrzymałość na ból. W praktyce klinicznej najczyściej stosuje się bodziec elektryczny, termiczny oraz bodziec najbardziej zbliżony do bólu patologicznego - ból mięśniowy spowodowany niedokrwieniem.
Badając ból doświadczalny można też oceniać reakcję na ból, która powstaje ze strony różnych układów. Laboratoryjne metody oceny tych reakcji są bardzo precyzyjne, ale służą tylko celom naukowym i nie są wykorzystywane w praktyce lekarskiej. Tylko niektóre pomiary ruchowej, czyli mięśniowej reakcji na ból oraz reakcji ze strony układu wegetatywnego mogą mieć praktyczne znaczenie dla oceny badanego bólu w klinice.
Medycyna nie ma obiektywnych metod pomiaru i oceny samego bólu, czyli pierwotnego komponentu tego złożonego zjawiska. Wszystkie stosowane w praktyce metody badania i skale pomiaru oparte są na słownym przekazie uzyskanym od chorego czy badanego. Z tego też powodu końcowa ocena jest bardzo subiektywna i w dużej mierze zależna od umiejętności dokonania tego przekazu, jak i zdolności jego odbioru i dokonania właściwego zapisu w umowny sposób. Odnosi się to przede wszystkim do bólu patologicznego, z którym lekarz ma do czynienia na codzień. W ocenie bólu patologicznego podstawową trudnością jest brak informacji o istocie bodźca powodującego doznanie bólowe, o jego natężeniu i miejscu działania. Nie można tez ocenić obiektywnie w jakim stopniu ból wywołany jest samym bodźcem uszkadzającym, a w jakim jego skutkami morfologicznymi i biochemicznymi.
Aby uzyskać informacje najbardziej obiektywne, posługiwać się trzeba językiem, który jest jednakowo rozumiany przez badanego, jak i badającego. Do tego celu służą różne metody opracowane przez klinicystów i psychologów. Metody te dotyczą oceny jednej tylko cechy klinicznej bólu, a mianowicie natężenia, które, jak wiadomo, zależy od siły bodźca uszkadzającego - nocyceptywnego i psychicznej reakcji na ból.
Metody psychologiczne podzielić można na dwie grupy. Do pierwszej należą metody analogowe, polegające na porównywaniu istniejącego bólu z innym bodźcem. Drugą grupę stanowią metody samooceny bólu przez cierpiącego za pomocą odpowiedniej skali, wyrażonej najczęściej w cyfrach lub graficznie. Metod tych jest wiele, a każdy zajmujący się tym zagadnieniem stara się wprowadzić własne modyfikacje lub własne skale.
W pierwszej grupie metod odczuwany ból może być porównywany z doświadczalnym bodźcem bólowym, dźwiękowym, wzrokowym, np. z kolorem. Jednym ze sposobów pomiaru bólu jest próba Perka z zastosowaniem audiometru. Sygnały słuchowe były dopasowywane przez chorego do odczuwanego bólu. Ból był porównywany z głośnym dźwiękiem. Średnia z kilku pomiarów ma odpowiadać natężeniu bólu. Ból wywołany niedokrwieniem za pomocą testu ischemicznego jest najbardziej zbliżony do bólu patologicznego, dlatego też testy ischemiczne są dobrym wzorcem dla porównania bólu istniejącego z bólem spowodowanym takim testem.
Najbardziej znanym jest t e s t i s c h e m i c z n y S t e r n b a c h a, który polega na zaciśnięciu bandażem całego przedramienia uniesionej ku górze kończyny chorego. Powyżej nakłada się mankiet manometru i podnosi ciśnienie do 250 mm Hg. Następnie zdejmuje się bandaż, układa się kończynę wzdłuż tułowia i poleca się wykonać 20 ruchów ściskania dynamometru co 2 sekundy. Po zakończeniu mierzy się stoperem czas do chwili pojawienia się bólu równego lub porównywalnego z odczuwanym, a następnie czas do wystąpienia najsilniejszego bólu. Czas jest miarą natężenia bólu i wytrzymałości na ból.
Innym, mniej znanym jest test porównania ucisku opracowany przez Domżała. Polega on na porównaniu bólu wywołanego zaciśnięciem kończyny zdrowej z bólem w drugiej kończynie. Zakłada się manometr do mierzenia ciśnienia krwi na obie kończyny. Zaciska się zdrową kończynę uciskiem do 250 mm Hg, a następnie stopniowo zwiększa się ucisk na kończynę chorą, aż do porównywalnego bólu. Różnica między stroną zdrową a chorą uzyskana z kilku pomiarów jest liczbowym wykładnikiem natężenia bólu.
W drugiej grupie metod psychologicznych, opartych na informacjach uzyskanych od osób cierpiących na ból, podstawą jest ocena bólu w odpowiedniej skali . Najczęściej stosowaną jest prosta skala opisowa, która składa się z oznaczonych cyframi stopni natężenia bólu. Liczba stopni bywa różna, najczęściej 3-stopniowa, np.:
0 brak bólu
1 lekki
2 silny
3 trudny do wytrzymania
albo 6-stopniowa:
0 brak bólu
1 minimalny
2 lekki
3 średni
4 silny
6 bardzo silny
7 nie do wytrzymania
W praktyce stosowana jest też skala w z r o k o w o-a n a 1 o g a w a. Jest to odcinek prostej, np. 10 cm, z zaznaczonym na początku brakiem bólu i na końcu maksymalnym bólem. Chory zaznacza punkt na linii, który odpowiada natężeniu jego bólu. Wypracowano wiele skal oceniających kilka elementów składowych bólu prze wlekłego. Najbardziej znany jest kwestionariusz McGilla-Melzacka. Określa on następujące parametry:
lokalizację bólu oznaczaną na schemacie ciała,
charakter bólu na podstawie słów badanego określających jakość doznania, dla którego może być kilka synonimów, jak np.: ból pulsujący, ból tętniący, ból łupiący, ból walący oraz ból palący lub piekący, lub parzący. Poszczególnym słowom są przypisane wartości w punktach opatrz załącznik
wystąpienie bólu w czasie,
nasilenie bólu według skali opisowej .
W praktyce klinicznej stasuje się metody oceny bólu obejmujące wiele cech klinicznych, takich jak: lokalizacja bólu, natężenie i charakter bólu, sposób występowania bólu w czasie, wpływ bólu na aktywność życiową chorego i stopień niewydolności spowodowanej bólem, zaburzenia w sferze psychicznej, np. lęk, napięcie, depresja, częstość korzystania z pomocy lekarskiej, ilość zużywanych środków przeciwbólowych.
Większość informacji o lokalizacji bólu uzyskuje się z wywiadu chorobowego. Badaniem przedmiotowym można stwierdzić występowanie miejsc wzmożonej bolesności, punktów "spustowych" przeczulicy, obrony mięśniowej itd. Dokładny wywiad pozwala określić sposób występowania bólu, czas jego trwania i pojawiania się, czy jest stały, czy nawracający, porę największego i najmniejszego natężenia bólu, długotrwałość poszczególnych incydentów bólowych i częstość ich występowania. Dla oceny wpływu bólu na sprawność chorego opracowano różne skale, które są zwykle częścią składową wieloczynnikowych kwestionariuszy. Są one opracowywane dla każdego rodzaju bólu oddzielnie i dostosowane do jego specyfiki. Przykładem może być prosta, przydatna do praktycznego stosowania skala Domżała, która ocenia natężenie bólu w rwie kulszowej na podstawie zachowania się i liczby objawów korzeniowych.
Skala Domżała:
0 bez bólu,
1 nie przeszkadza w pracy i chodzeniu,
2 utrudnia pracę i chodzenie,
3 występuje w spokoju i w pozycji leżącej,
4 bardzo silny, trudny dv wytrzymania, powoduje zmiany w zachowaniu się.
Suma punktów określa natężenie i aby ją poszerzyć, można do tego dodać liczbę stwierdzanych objawów korzeniowych, takich jak: objaw Lasegue'a, objaw Fajersztajna-Krzemickiego, objaw karkowy, objaw kaszlowy.
Związek ból a stan psychiczny chorych odgrywa dużą rolę w badaniu klinicznym. Na intensywność i jakość odczuwanego bólu wpływają: stan emocjonalny chorego, osobowość, uprzednie przeżycia i doświadczenia związane z bólem, zdolność do zrozumienia jego przyczyny i konsekwencji, niepokój, lęk. Parametry te, określane jako psychiczna reakcja na ból, są oceniane za pomocą badania psychologicznego. Do tego celu najczęściej stosowane są kwestionariusze Eysencka i Cattella określające osobowość, a w tym neurotyzm, sferę emocjonalną, typ przeżywania i inne cechy. Do oceny depresji głównego objawu reakcji psychicznej w bólu przewlekłym stosuje się kwestionariusz Zunga. Inny test, zwany w skrócie MMPI (Minnesota Multiphasic Personalny Inventory), określa cechy osobowości, objawy neurotyczne i psychotyczne.
Ból można też oceniać pośrednio na podstawie częstości korzystania z wizyt lekarskich, liczby zapisywanych i przyjmowanych środków przeciwbólowych, ich dawki w ciągu doby lub całego epizodu bólowego.
Wymienione skale dotyczą samego bólu, a metody oceny oparte są na ustnym przekazie i obserwacji zachowania się chorego. Większe możliwości obiektywnego badania i rejestracji dają metody oceny reakcji na ból. W sposób pośredni na ich podstawie można wnioskować o istnieniu i natężeniu doznawanego bólu. Nie ma jednak prostej zależności między stopniem natężenia i stopniem reakcji na ból. Tylko w niektórych typach reakcji mięśniowej odnotowano taką zależność.
W różnych klinicznych zespołach bólowych badane komponenty muszą być dostosowane do rodzaju bólu. W ocenie mogą być porównywane tylko jednolite zespoły bólowe, np. nie można porównywać bólu w migrenie z bólem korzeniowym. Do badania każdego z tych zespołów służą inne wielokomponentowe karty obserwacji, składające się z wybranych skal psychologicznych i metod klinicznych. Każdy z ośrodków zajmujących się badaniami bólu posiada własne metody lub dostosowuje opracowane już karty badania bólu do własnych potrzeb. Przykładem może być omówiony powyżej kwestionariusz McGilla-Melzacka i skala Domżała. Możliwości wyboru odpowiedniego kwestionariusza są duże i istnieje obszerne piśmiennictwu światowe dotyczące tego problemu. Badania reakcji na ból, poza psychiczną, o której była już mowa, prowadzi się przy użyciu prostych metod badania przedmiotowego, jak również przy użyciu skomplikowanych metod elektrofizjologicznych.
Prostymi metodami fizykalnymi można oceniać reakcje ruchowe, badać napięcie mięśniowe (obronę mięśniową, wyraz twarzy, badać objawy korzeniowe, objawy wegetatywne i inne. Metod oceny tych objawów jest wiele. Metody laboratoryjne, elektrofizjologiczne, pozwalają na rejestrację odpowiedzi ruchowej w mięśniach zależnie od typu omówionych wcześniej reakcji.
Reakcję wewnątrzwydzielniczą na ból bada sil różnymi metodami laboratoryjnymi, oznaczając poziomy endogennych substancji związanych z bólem. Bada się poziom steroidów, endorfiny, serotoniny, prostaglandyny, bradykininy, histaminy, tachykininy i inne. Badania takie wykonywane są tylko w wyspecjalizowanych laboratoriach dla celów naukowych. W praktyce nie są one używane.
Przystępując do badań nad bólem należy określić cel jakiemu te badania mają służyć. Czy jest to np. ocena doznania bólowego chorego, czy skuteczności klinicznego postępowania przeciwbólowego, czy też ocena analgetycznego działania leku. Potem dopiero należy wybrać odpowiednie metody badania.
Ból bada się metodami subiektywnymi, zaś odpowiedź na ból metodami obiektywnymi. Dla pełnej oceny klinicznej oba te komponenty muszą być zbadane. Wybór sposobu badania zależy od wiedzy i możliwości badającego.
8
1
83
Wyszukiwarka