WYKŁAD 14
METODY ELEKTROFORETYCZNE
Elektroforeza - wędrówka jonów w polu elektrycznym i proces rozdzielania tych cząsteczek wskutek różnicy szybkości ich migracji.
Zastosowanie elektroforezy - analiza i oczyszczanie makrocząsteczek/białek/kwasów nukleinowych oraz cukrów, aminokwasów, peptydów, nukleotydów, jonów i in.
Szybkość poruszania się cząstki w polu elektrycznym: υ =μ E
gdzie: υ [cm/s] - szybkość migracji
μ [m2/s V] - ruchliwość elektroforetyczna
E [V/m] - natężenie pola elektrycznego,
Wpływ parametrów środowiska:
![]()
![]()
![]()
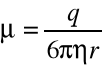
Ruchliwość elektroforetyczna (μ) jest charakterystyczna dla danego jonu i jest wprost proporcjonalna do jego ładunku q [C], i odwrotnie proporcjonalna do promienia r [pm]
Podział metod elektroforetycznych:
Elektroforeza swobodna
Elektroforeza w nośnikach:
bibułowa
żelowa [agarozowy, PAGE]
Etapy elektroforezy:
przygotowanie próbki
wybór odpowiedniego nośnika i systemu buforów elektroforetycznych
rozdział elektroforetyczny
detekcja
ELEKTROFOREZA BIBUŁOWA:
Nośnik: bibuła chromatograficzna, octan celulozy
Technika kombinowana: elektrochromatografia
ELEKTROFOREZA NA ŻELACH AGAROZOWYCH:
Są to galaretki półprzezroczyste, kruche, nie są tak odporne jak żele poliakrylamidowe
Ich głównym składnikiem jest agaroza
Stosowana w biologii molekularnej do analizy kwasów nukleinowych
Immunoelektroforeza białek
Elektroforeza kwasów nukleinowych na żelach agarozowych:
Elektroforeza DNA w żelu agarozowym jest standardową metodą pozwalającą na rozdzielenie, identyfikacje lub oczyszczenie fragmentów DNA.
Technika horyzontalna - rozdział według rozmiaru cząsteczek
Żele agarozowe o różnym stężeniu stosuje się do rozdziału fragmentów DNA od 200 pz do 50 000 pz
Detekcja kwasów nukleinowych w agarozie:
Barwniki fluerescencyjne - np. lub bromek etydyny pozwalają na uwidocznienie makrocząsteczek po zakończeniu elektroforezy lub wybarwienie przed separacją. Znaczniki uwidaczniają położenie prążków w świetle UV lub widzialnym. Czułość detekcji jest porównywalna z barwieniem srebrem lub jest nieco lepsza.
IMMUNOELEKTROFOREZA BIAŁEK NA ŻELACH AGAROZOWYCH:
Metody wykorzystujące swoiste reakcje Ag-Ig
Elektroforeza białek i immunodyfuzja Ig - linie precypitacyjne charakterystyczne dla reakcji Ag-Ig
Immunoelektroforeza rakietowa - elektroforeza w agarozie z dodatkiem Ag
Immunoelektroforeza krzyżowa - kombinacja zwykłej elektroforezy na żelu agarozowym i elektroforezy rakietowej
IMMUNOELEKTROFOREZA - zależy od specyficznych reakcji antygen-przeciwciało i służy do detekcji rozdzielonych białek. Po niskonapięciowej elektroforezie próbek na żelu agarozowym wprowadza się surowice odpornościowe, które dyfundują przez żel i tworzą widoczne osady z rozdzielonymi antygenami.
Elektroforeza na ŻELU POLIAKRYLAMIDOWYM:
polimer akrylamidu i bisakrylamidu (czynnik sieciujący)
posiada wysoką zdolność rozdzielczą
odporny na działanie czynników chemicznych
przezroczysty, bezbarwny, sprężysty
zapewnia powtarzalność rozdziałów
Elektroforeza kwasów nukleinowych odbywa się zazwyczaj w układzie pionowym
Elektroforeza w żelach poliakrylamidowych stosowana w biologii molekularnej do analizy małych cząsteczek kwasów nukleinowych.
Detekcja kwasów nukleinowych w żelach poliakrylamidowych:
Barwienie srebrem:
Utrwalanie żelu
Barwienie azotanem srebra
Odbarwianie tła
ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM:
Elektroforeza natywna -
Metoda Ornstein'a - Davis'a
ruchliwość elektroforetyczna jest uzależniona od ładunku i rozmiaru cząsteczki
układ nieciągły, niedenaturujący
Elektroforeza w warunkach denaturujących (SDS, mocznik) + reduktor (β-merkaptoetanol, DTT)
Rozdział na zasadzie sita molekularnego
Metoda Laemmli'ego: bufor elektrodowy: Tris-glicyna
Metoda Shagerravona: bufor elektrodowy: Tris-tricyna
Jest możliwe wyznaczanie masy cząsteczkowej białka:
![]()
![]()
M - masa cząsteczkowa białka
Metody detekcji stosowane w żelowej elektroforezie:
Coomasie Brilliant Blue (0,1-1µg)
sole cynku (10-100 ng)
sole srebra (1-10 ng)
SYPRO orange (2-10 ng)
Selektywne wybarwianie enzymów (wizualizacja enzymów, które w wyniku katalizy produkują barwny substrat)
barwniki fluorescencyjne (wymagają odpowiednich urządzeń - lamp)
Czynniki wpływające na szybkość migracji cząsteczek w żelu:
masa cząsteczki
koncentracja żelu / stopień usieciowania
napięcie / natężenie prądu
temperatura
siła jonowa buforu elektrodowego
pH buforu elektrodowego
IZOELEKTRYCZNE OGNISKOWANIE (IEF)
Rozdział przebiega w gradiencie pH wytworzonym przez amfolity (czyli mieszanina kwasów wielokarboksylowych, które wędrują w polu elektrycznym i wytwarzaja pH w żelu)
Jeśli białko jest naładowane ujemnie to wędruje w kierunku katody, jeżeli dodatnio to w kierunku anody, natomiast jeżeli nastąpi zrównoważenie ładunku białka (pH odpowiada pI) to białko zatrzymuje się w miejscu
Metoda charakteryzuje się wysoką rozdzielczością
ELEKTROFOREZA 2D - dwuwymiarowa
Połączenie izoelektrycznego ogniskowania i elektroforezy SDS-PAGE
1 kierunek: immobilizowany gradient pH, czyli ogniskowanie izoelektryczne które przeprowadza się na specjalnych paskach, a następnie pasek nakłada na żel i prowadzi elektroforeze SDS-PAGE w kierunku prostopadłym do IEF (2 kierunek)
dostajemy żel pełen plam → obraz w postaci kropek
metoda ta służy do badań np. ekstraktów komórkowych, kiedy badamy wszystkie białka jakie się w niej znajdują
np. może służyć do porównania między komórkami normalnymi, a nowotworowymi (widzimy jakie białka występują w komórkach chorych a nie występują w zdrowych)
do klasyfikacji białek używamy najczęściej sekwencjonowania aminokwasów
![]()
F - siła działająca na cząstkę w polu elektrycznym
q - ładunek cząstki
η - lepkość środowiska
r - promień cząstki
Przykrywa
(─)
(+)
Bibuła
Linia startowa
Roztwory buforowe
Schemat urządzenia do elektroforezy bibułowej:
odległość wędrówki białka
Małe cząsteczki
Duże cząsteczki
Żele poliakrylamidowe
- używane do cząstek mniejszych
Żele agarozowe do 2%
- używane do cząstek większych
ELEKTROFOREZA NA ŻELACH
odległość wędrówki znacznika
Wyszukiwarka
Podobne podstrony:
2303
2303
2303
2303
2303
więcej podobnych podstron