WPŁYW KATALIZATORA NA SZYBKOŚĆ REAKCJI CHEMICZNEJ |
ĆW. 15. |
Cel ćwiczenia
Katalizator jest to substancja, która zwiększa szybkość reakcji chemicznej, lecz sama się nie zużywa. Katalizator może reagować tworząc formy pośrednie, ale odtwarza się w końcowym etapie reakcji. Katalizator przyśpiesza reakcję chemiczną prowadząc ją poprzez etapy o bardziej korzystnej kinetyce niż w jego nieobecności. Z równania Arrheniusa
k = A·e-Ea/RT
wiemy, że stała szybkości k, a stąd i szybkość reakcji, zależy od częstości zderzeń A oraz od energii aktywacji reakcji Ea, tak więc im większa wartość A oraz im mniejsza wartość Ea tym większa szybkość reakcji chemicznej. W wielu przypadkach katalizator zwiększa szybkość reakcji przez obniżenie jej energii aktywacji.
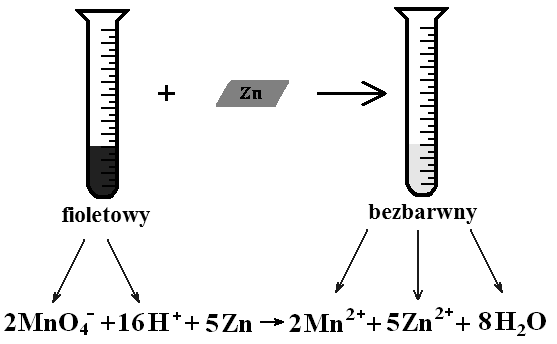
Celem eksperymentu jest wykazanie, jak dodatek katalizatora zwiększa szybkość reakcji na przykładzie reakcji redukcji manganianu(VII) potasu wodorem, który powstaje w wyniku działania kwasu na cynk. Katalizatorem w tej reakcji jest stały azotan(V) potasu (KNO3).
Odczynniki:
► 0,1 M manganian(VII) potasu, KMnO4
► 1,0 M kwas siarkowy(VI), H2SO4
► stały azotan(V) potasu, KNO3
► cynk, Zn
Sprzęt laboratoryjny:
► statyw z probówkami
► probówki miarowe
Wykonanie ćwiczenia:
Do probówki z podziałką należy wlać 0,5 cm3 0,1 M roztworu manganianu(VII) potasu, KMnO4 i dopełnić do 15 cm3 1 M roztworem kwasu siarkowego(VI), H2SO4.
Otrzymany w ten sposób roztwór wymieszaj i rozlej równo do dwóch probówek.
Do pierwszej probówki dodaj kilka kryształków KNO3 i mieszaj, aż do rozpuszczenia soli.
Następnie do obu probówek dodaj jednocześnie po możliwie równym kawałku cynku.
Zmierz i zanotuj czas odbarwienia się roztworu manganianu(VII) potasu na skutek redukcji jonów manganianowych(VII), MnO4- do jonów manganu(II), Mn2+.
Dyskusja:
1. Jakie czynniki wpływają na szybkość reakcji chemicznej?
2. Napisz równanie Arrheniusa i zdefiniuj wszystkie wielkości w nim występujące.
3. Jaką rolę odgrywa energia aktywacji w kinetyce reakcji?
4. Co to jest katalizator i jaki ma wpływ na energię aktywacji reakcji?
5. Podaj definicję katalizatora homogenicznego i heterogenicznego.
6. Wyjaśnij działanie katalizatora samochodowego.
7. Wyjaśnij, czy reakcje enzymatyczne są przykładem homogenicznych czy heterogenicznych reakcji katalizy.
8. Wyjaśnij, który mechanizm katalizy zaproponujesz dla przeprowadzonego przez ciebie eksperymentu.
Wyszukiwarka
Podobne podstrony:
zadania3-wplyw temperatury na szybkosc reakcji
WPŁYW TEMPERATURY NA SZYBKOŚĆ REAKCJI, NAUKA, chemia, lab
zadania3 wplyw temperatury na szybkosc reakcji
Wpływ aktywatorów i inhibitorów na szybkość reakcji enzymatycznej
14 wpływ temp. i kat. na szybkość reakcji
cwiczenie 2 hydrolazy czynniki wplywajace na szybkosc reakcji enzymatycznych 15 05 2014
25 Wpływ stężenia kwasu na szybkość reakcji hydrolizy estru
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH
wpływ temperatury na szybkość przenikania olejków eterycznych
5.Badanie wpływu stężenia substancji reagujących na szybkość reakcji chemicznej., Państwowa Wyższa S
(5 1) Określenie wpływu stężenia reagentów i temp na szybkość reakcji chem(1)
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH nowy
A cw 3 czynniki wpływające na szybkość reakcji enzymatycznej
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH
Ćwiczenia na szybkość reakcji bramkarza
Ćwiczenia na szybkość reakcji bramkarza2
Wpływ polaryzacji na szybkość korozji
więcej podobnych podstron