Joanna Narewska
Wydział Chemiczny
Technologia Chemiczna
Grupa nr 1
Ćwiczenie nr 5
Protonowanie wody
Cel cwiczenia:
Zmierzenie widm wibracyjnych wody metodą spektroskopii Ramana i obliczenie częstości drgań metodami kwantowo-mechanicznymi oraz porównanie teoretycznych i doświadczalnych wyników.
Wstęp teoretyczny:
Spektroskopia Ramana jest jedną z metod pozwalających na otrzymanie informacji o własnościach wibracyjnych cząsteczki. Jest to metoda wysoce selektywna, ponieważ położenie pasm w widmie, ich selektywność i liczba są bardzo wrażliwe na strukturę molekularną, zmiany konformacyjne i wpływ otoczenia .
Gdy na próbkę pada światło o energii fotonu równej różnicy energii podstawowego EO i wzbudzonego E1 stanu elektronowego, zostaje ono zaadsorbowane. Natomiast gdy energia fotonu jest mniejsza od tej różnicy ma miejsce rozpraszane światła.
Zjawisko Ramana można wytłumaczyć następująco. Składowa elektryczna promieniowania elektromagnetycznego oddziałuje z cząsteczką i indukuje w niej moment dipolowy. Drgający moment dipolowy jest źródłem promieniowania o trzech częstościach:
ν0- częstość maksimum pasma rozpraszania Rayleigha
(ν0- ν)- częstość maksimum pasma stokesowskiego rozpraszania Ramana
(ν0+ν)-częstość maksimum pasma antystokesowskiego rozpraszania Ramana
Rozpraszanie Rayleigha ma miejsce gdy częstość ν0 promieniowania padającego i rozproszonego są jednakowe.
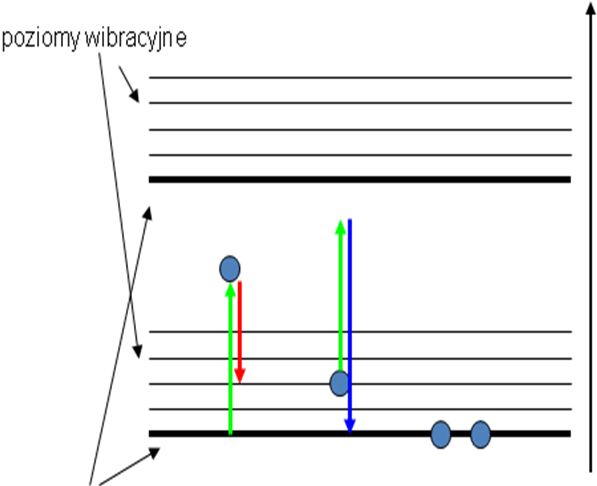
Rozpraszanie Ramana:
1-gdy foton pada na cząsteczkę ,
znajdującą się w podstawowym stanie
elektronowym i podstawowym stanie
wibracyjnym, a w wyniku rozproszenia
światła cząsteczka powraca na wzbudzony 1 2
poziom wibracyjny, to częstość fotonu
wyemitowanego wynosi (ν0- ν);
poziomy elektronowe
2-gdy foton oddziałuje z cząsteczką , znajdującą się w stanie wzbudzonym, a po rozproszeniu światła powraca do podstawowego stanu wibracyjnego, to częstość fotonu wynosi (ν0+ν).
Schemat spektrometru Ramana:
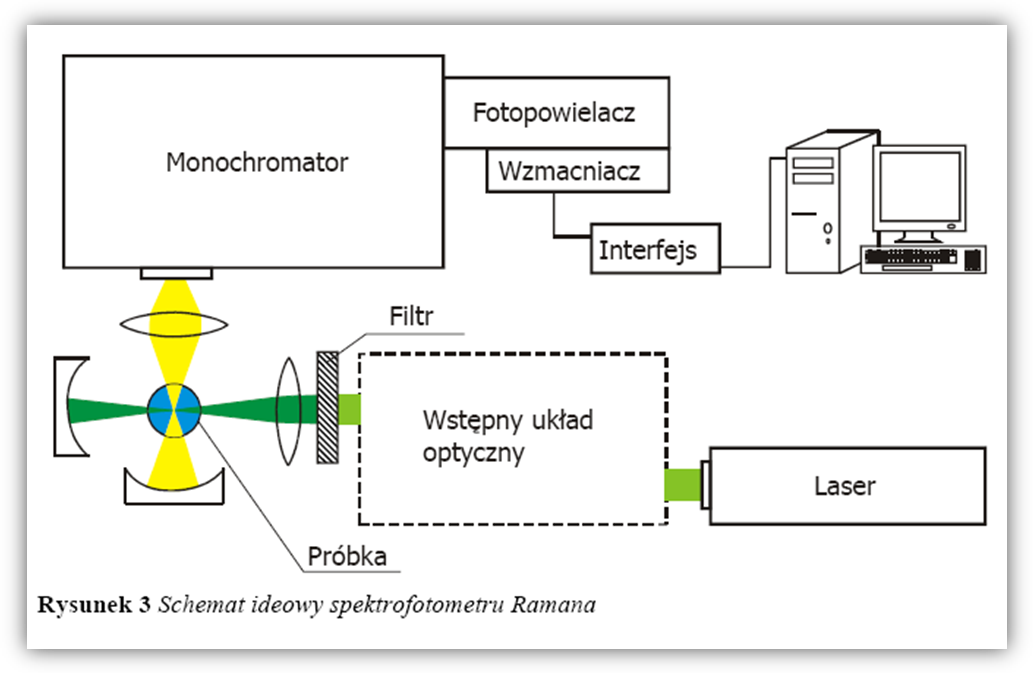
Źródłem promieniowania jest laser jonowy argonowy. Liniowo spolaryzowane promieniowanie monochromatyczne przechodzi przez wstępny układ optyczny, umożliwiający regulację kierunku wiązki i pada na filtr interferencyjny, gdzie usuwane są wiązki promieniowania różne od 514 nm. Następnie skupione przez soczewkę promieniowanie pada na próbkę umieszczoną w szklanej kuwecie. Rozproszone przez próbkę promieniowanie polichromatyczne przechodzi przez soczewkę skupiającą, a następnie poprzez układ szczelin dostaje się do monochromatora, zawierającego zwierciadła wklęsłe i siatki dyfrakcyjne. Po przejściu przez monochromator promieniowanie rozproszone jest rejestrowane za pomocą fotopowielacza i wzmacniane przez wzmacniacz. Interfejs zapewnia kontrolę pracy monochromatora, zbieranie danych oraz wstępną ich obróbkę.
Opis wykonywanych czynności:
Wykorzystując program ChyperChem narysowałam cząsteczkę wody, zoptymalizowałam strukturę ,
a następnie odczytałam wartości kątów i długości wiązań OH oraz obliczyłam całkowitą energię cząsteczki. Wyniki umieściłam w tabeli i analogiczne operacje przeprowadziłam dla jonu hydroniowego H3O+.
Tabele z wynikami:
Wzór sumaryczny |
Baza STO-3G |
Baza 3-21G |
Baza 6-31G |
|||||
|
Struktura zoptymalizowana |
Struktura zoptymalizowana |
Struktura zoptymalizowana |
|||||
|
geometria |
energia |
geometria |
energia |
geometria |
energia |
||
Cząsteczka wody
|
Dł.wiązania OH 0,989 A Kąt pomiędzy HOH 99,99o |
SCF: -47041,82 kcal/mol MP2: -24,45kcal/mol Suma -47066,27 kcal/mol |
Dł.wiązania OH 0,967A Kąt pomiędzy HOH 107,675o |
SCF: -47430,91 MP2 -77,07 Suma: -47507,98 |
Dł.wiązania OH 0,947A Kąt pomiędzy HOH 105,60 |
SCF: -47696,58 MP2: -116,31 Suma: -47812,89 |
||
Jon hydroniowy |
Dł.wiązania OH 0,990 A kąt HOH 113,822O kąt torsyjny 132,654O |
SCF: -47270,57 kcal/mol MP2: -30,48kcal/mol Suma: -47301,05 kcal/mol |
Dł.wiązania OH 0,979 kąt HOH 120,002o kąt torsyjny 179,708o |
SCF: -47622,47 MP2: -80,08 Suma: -47702,55 |
Dł.wiązania OH 0,970A kąt HOH 112,941o kąt torsyjny 129,699o |
SCF: -47870,94 MP2: -116,03 Suma: -47986,97 |
||
Energia protonowania wody ∆Eteoretyczna |
-234,78kcal/mol |
|
-194,57 kcal/mol |
|
-174,08 kcal/mol |
|||
Energia protonowania wody
∆Eeksperymentalna |
-167 kcal/mol |
|
|
|
|
|||
Porównanie wartości teoretycznych z doświadczalnymi i wnioski:
|
WARTOŚCI DOŚWIADCZALNE |
WARTOŚCI TEORETYCZNE (baza 6-31G) |
Długość wiązania O-H |
0,96 A |
0,95 A |
Kąt pomiędzy H-O-H |
104,5O |
105,6O |
Energia protonowania |
-167 kcal/mol |
-174,08 kcal/mol |
Z powyższego porównania jednoznacznie wynika, że wartości obliczone za pomocą funkcji bazy 6-31G są najbliższe prawdy. Jest to więc najdokładniejsza baza, uwzględniająca polaryzację wiązań oraz stosująca najmniej przybliżeń, co często przekłada się na dłuższy czas obliczeń.
Po odczytaniu wartości częstości drgań z dołączonego widma Ramana widać, że najbliższa prawdziwej struktura nie odpowiada prawdziwym częstościom drgań. Odstępstwa są dość znaczne, co wynika z tego, że w naszych rozważaniach nie braliśmy pod uwagę wzajemnych oddziaływań między cząsteczkami wody (wiązania wodorowe). Analizowaliśmy układ składający się z jednej cząsteczki wody umieszczonej w próżni.
Najbliższą teoretycznej wartości energii protonowania otrzymujemy korzystając z bazy 6-31G. Przyczyną odstępstw energii policzonej teoretycznie od wyznaczonej doświadczalnie jest to, że baza ta nie uwzględnia wszystkich oddziaływań, stosuje przybliżenia.
Wyszukiwarka
Podobne podstrony:
mitr protonowanie wody
mitr protonowanie wody
Ujecia wody
Ruchy wody morskiej i wody podziemne
GEOLOGIA 3 wody podziemne
zbiornik wody czystej, dezynfekcja
Przygotowanie cieplej wody uzytkowej
instrukcja bhp przy magazynowaniu i stosowaniu chloru w oczyszczalni sciekow i stacji uzdatniania wo
Adsorpcyjne oczyszczanie wody i ścieków
Postacie wody w glebie, Studia, UTP Ochrona środowiska, I rok, Semestr II, Geologia
kapusta z wody, A Przepisy kulinarne 1
morawski sciaga, Studia, Uzdatnianie wody
zagadnienia chemia wody, Politechnika Wrocławska, Inżynieria Środowiska, II rok, Chemia wody
Opowiadanie o kropelce wody, Chemia, Tajemnice wody
spr - koag pow, Sprawozdania, oczyszczanie wody
więcej podobnych podstron