Egzamin praktyczny z mikrobiologii
ćw. 1
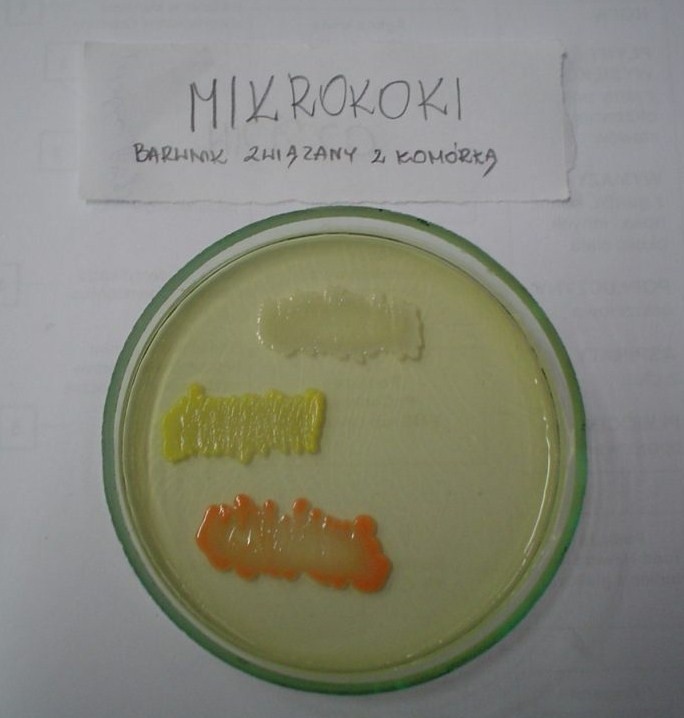
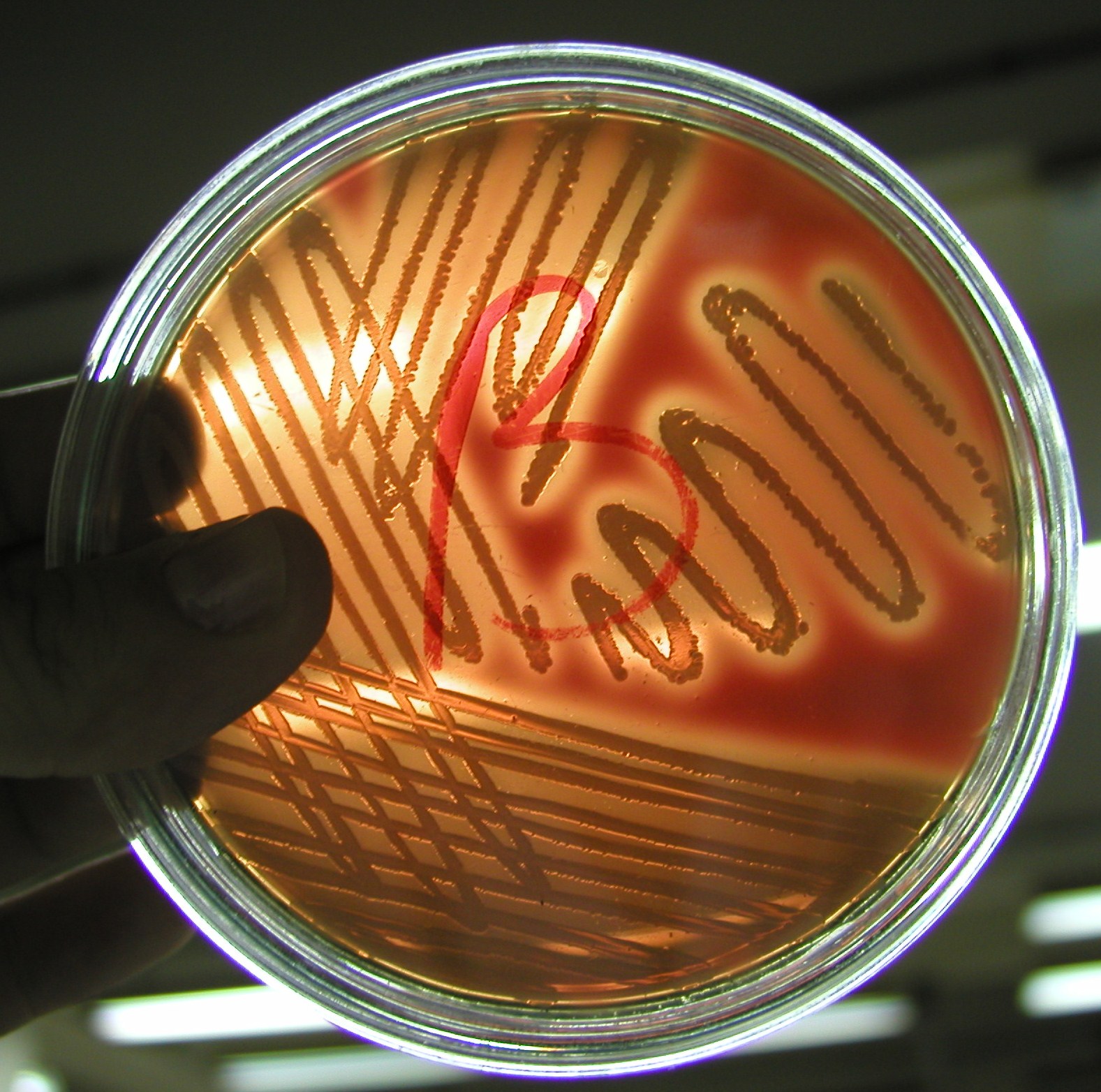
1. Mikrokoki, barwniki związane z komórką, nie dyfundują do podłoża, nie rozp. w wodzie
tlenowe
pożywki proste
wrażliwe na bacytracynę, oporne na furazolidon - pozwala to na odróżnienie ich od gronkowców
posiadają katalazę - to odróżnia je od paciorkowców
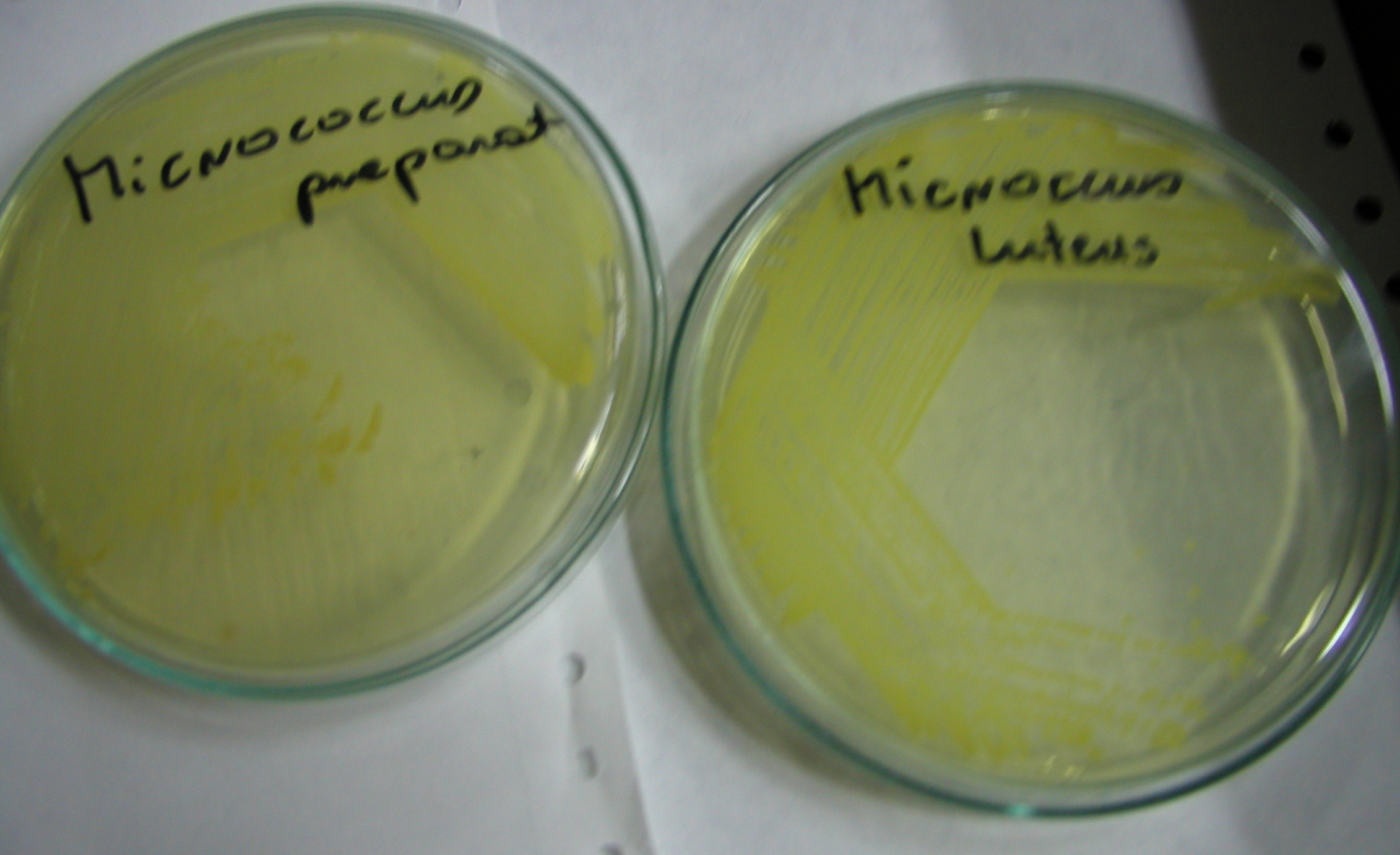
M. Luteus - niekiedy na skórze i błonach śluzowych człowieka i innych ssaków, w glebie, w wodzie, powietrzu, artykułach spożywczych, w zakażeniach u osób z obniżoną odpornością
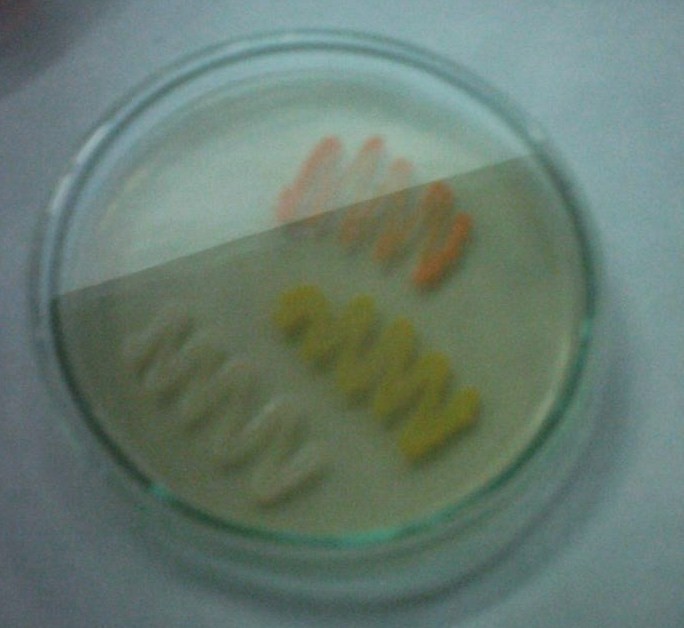
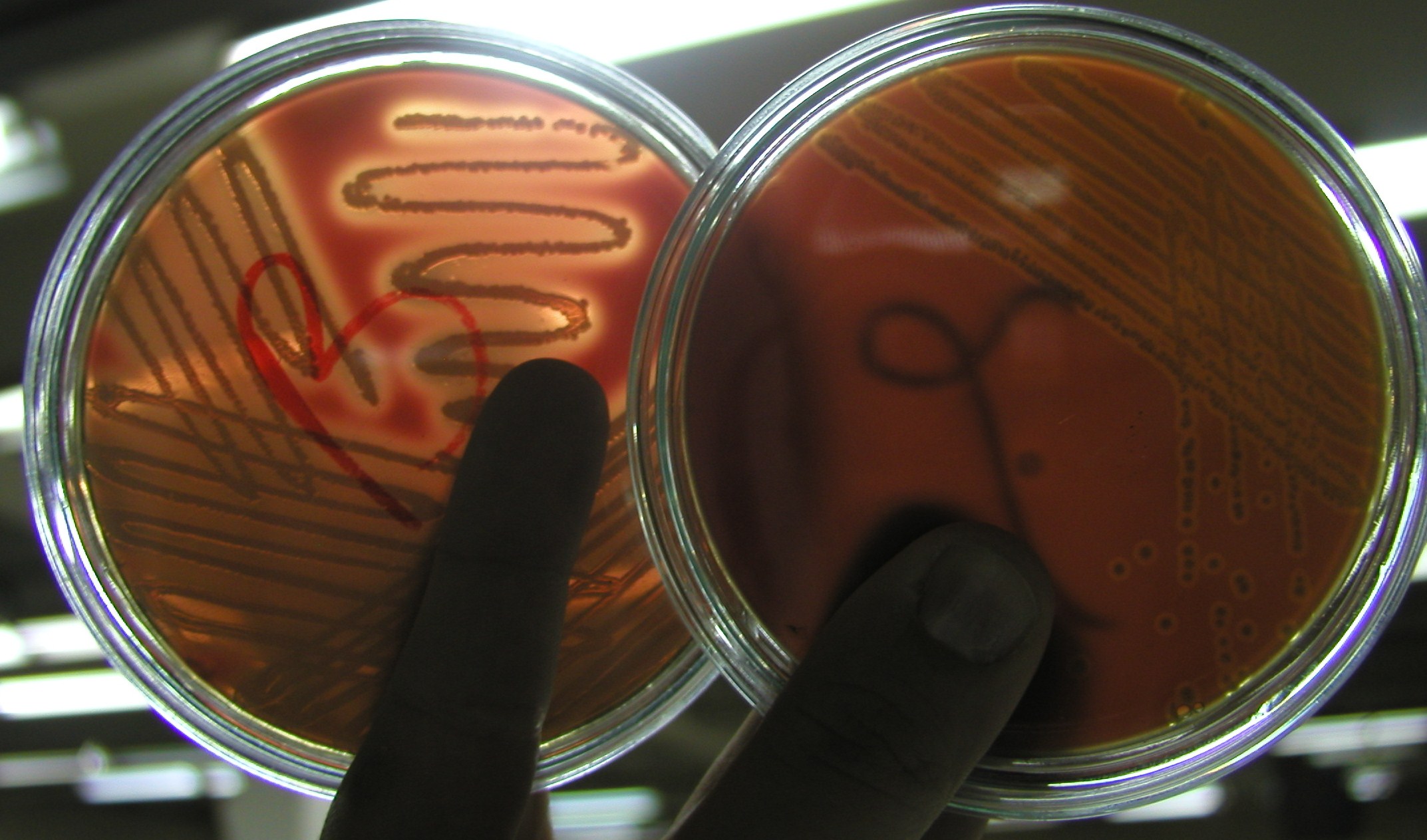
2. Barwniki wytwarzane przez Pseudomonas
barwniki fenazynowe, fluoryzujące i niefluoryzujące,
dyfundują do podłoża
wytwarzają katalazę i oksydazę cytochromową
P. aeruginosa wytwarza barwniki: fluoresceina, piocyjanina, piorubina, melanina;
pożywki: agar zwykły, agar z krwią, podłoże MacConkeya;
podłoża wybiórcze: Cetrymid (0,1% cetrymidu), podłoże Pseudomonas agar, podłoże Kinga B. (z dodatkiem nitrofurantoiny - hamuje wzrost większości pałeczek gram-ujemnych)
3. Barwniki Pseudomonas?
ćw. 2
1. Ziarenkowce, formy kuliste bakterii, metoda negatywna
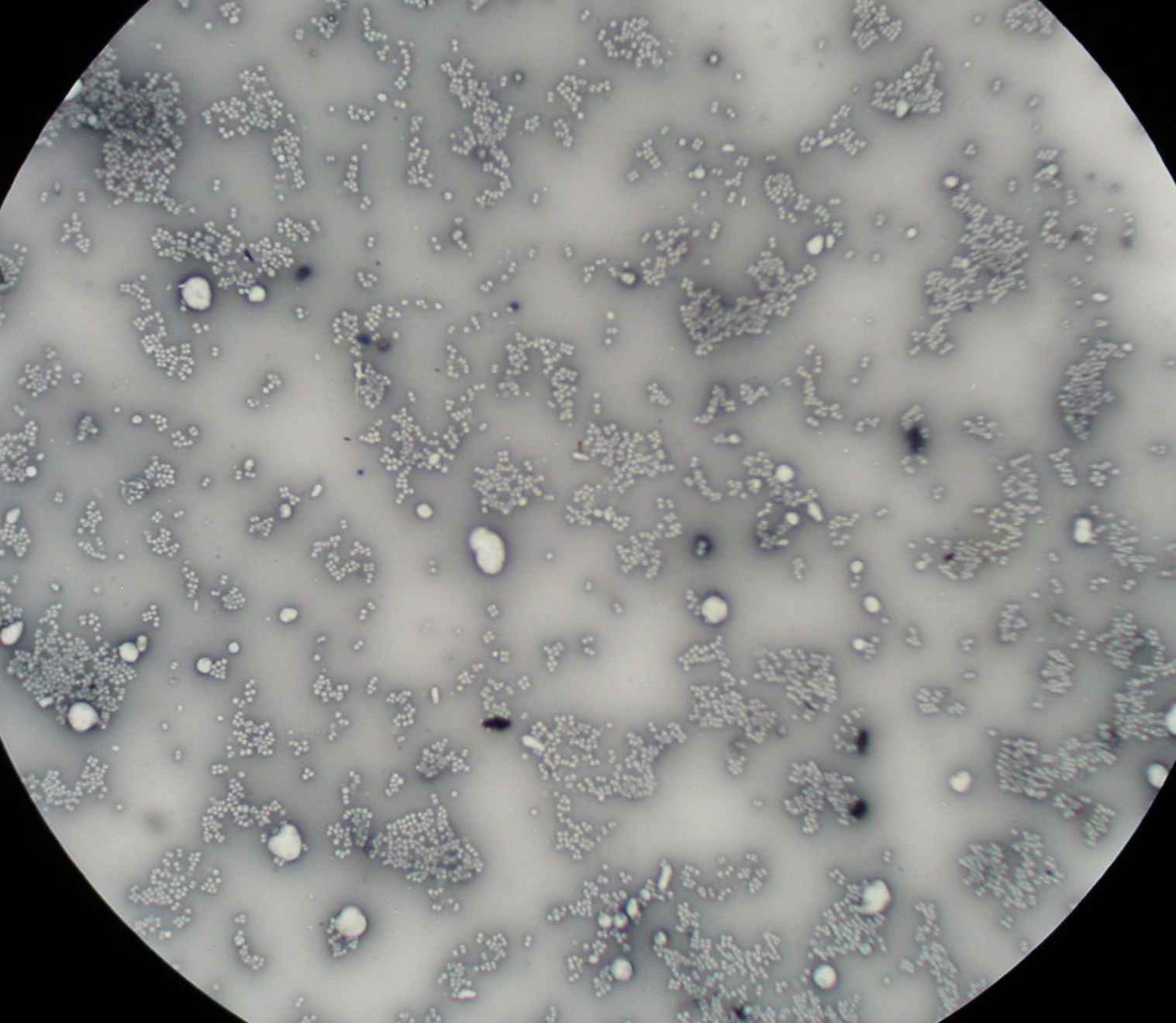
barwienie negatywne - zabarwienie tła barwnikiem kwaśnym - komórka zostaje niezabarwiona na ciemnym tle
* czarna nigrozyna
* tusz chiński ( od innych barwników różni się tym że nie ma odpowiedniej dyspersji i nie wnika do wnętrza komórki)
barwienie pozytywne - wybarwienie komórek bakteryjnych z pozostawieniem niewybarwionego tła - najczęściej stosowane w mikrobiologii
ziarenkowce: Micrococcus, Staphylococcus, Streptococcus, Enterococcus, Neisseria
dwoinki: Streptococcus pneumoniae, Neisseria meningitidis, Neisseria gonorrhoae
łańcuszki: Streptococcus pyogenes, Streptococcus agalactiae, paciorkowce jamy ustnej (oralis, mutans, salivarius)
grona: Staphylococcus
Enterococcus może układać się po dwie lub w łańcuszki
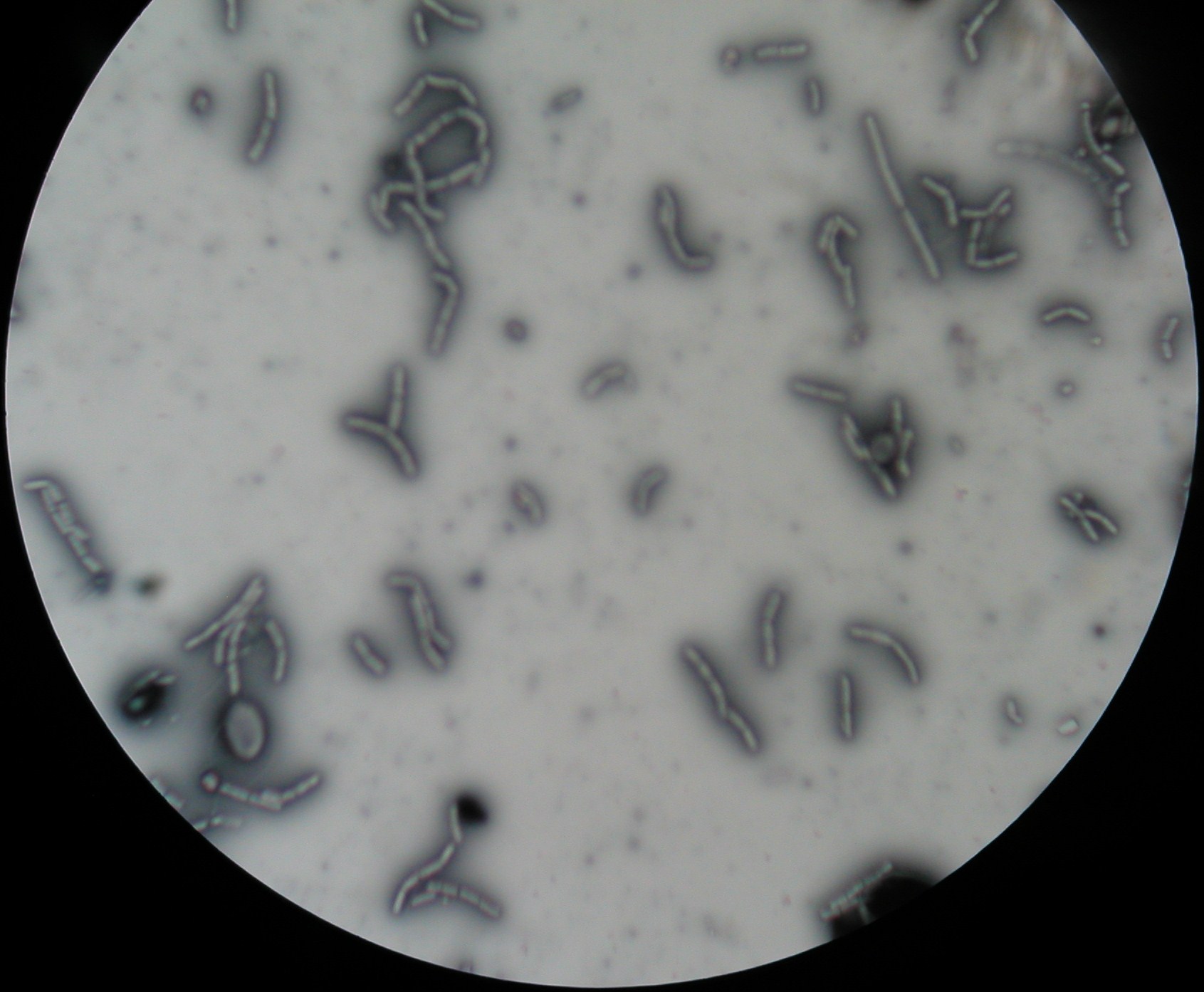
2. Formy cylindryczne (laseczki) metoda negatywna
3. Otoczka, metoda pozytywno - negatywna
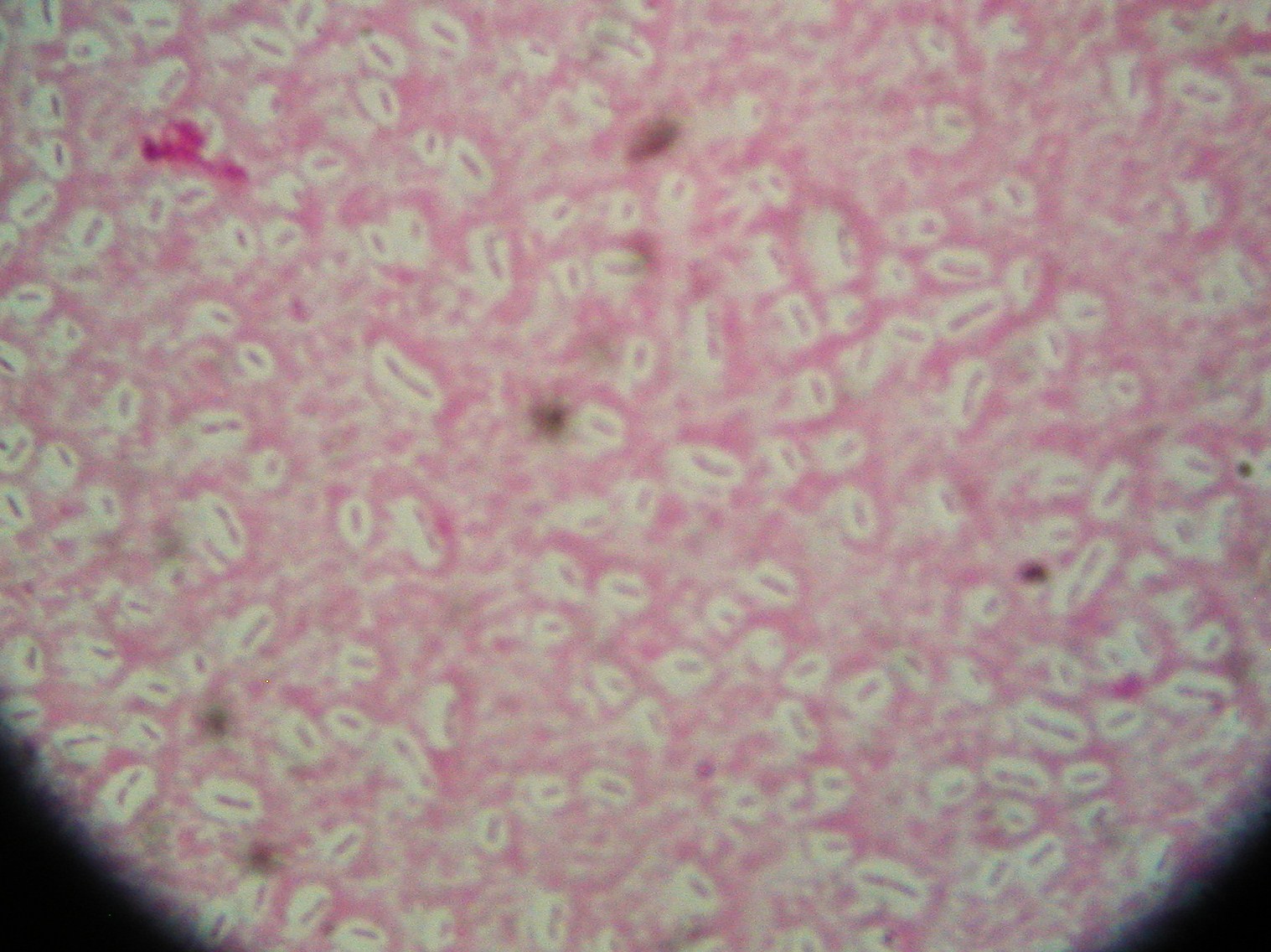
otoczka chroni przed fagocytozą
mają otoczkę: Staphylococcus, Streptococcus, Neisseria, Bacillus anthracis (z polipeptydu kwasu D-glutaminowego) Clostridium perfringens,
Streptococcus pyogenes - otoczka z kwasu hialuronowego takiego samego jak jest w organizmie
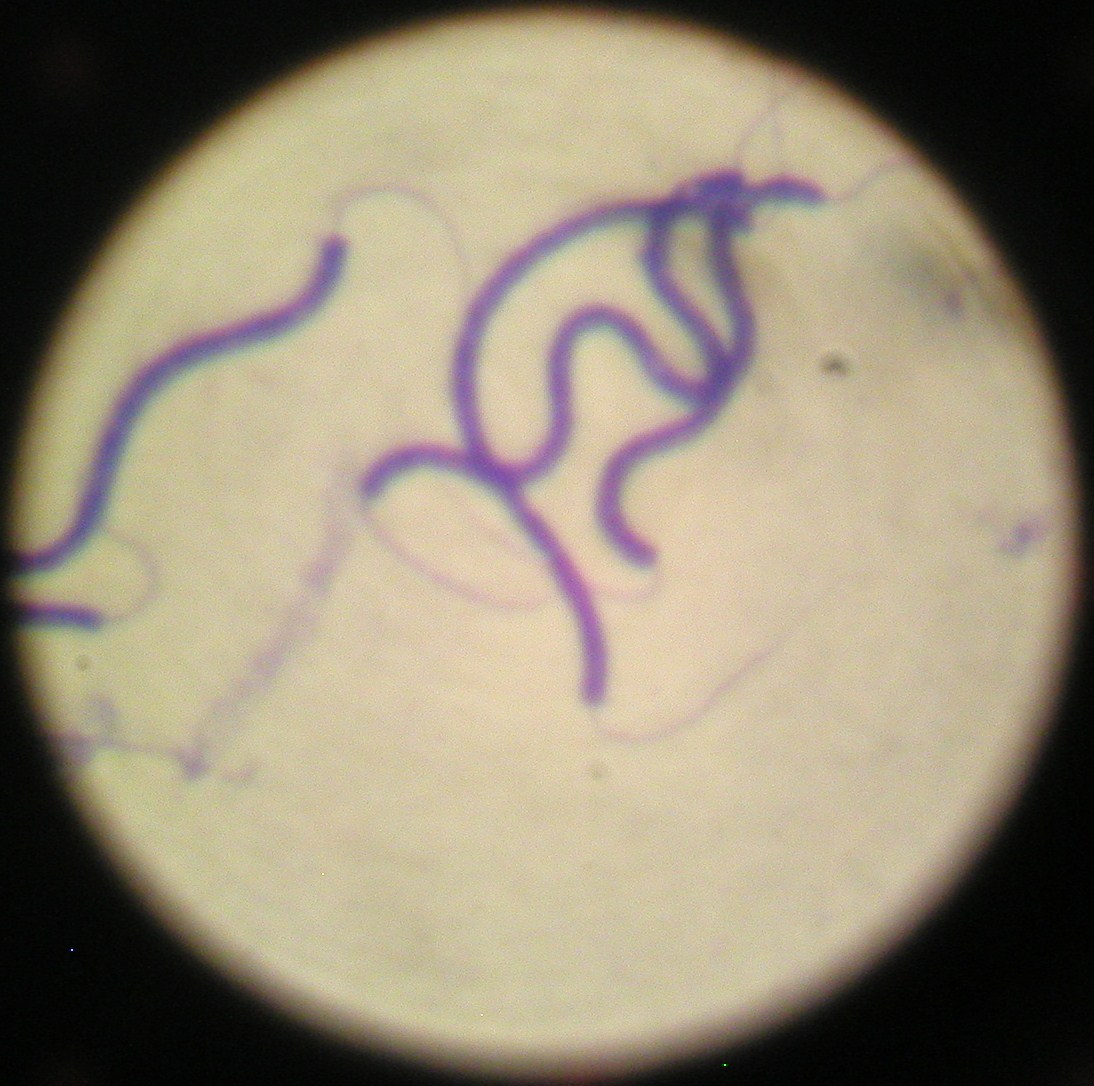
4. Treponema pallidum - krętek blady (przedstawia formę spiralną?)
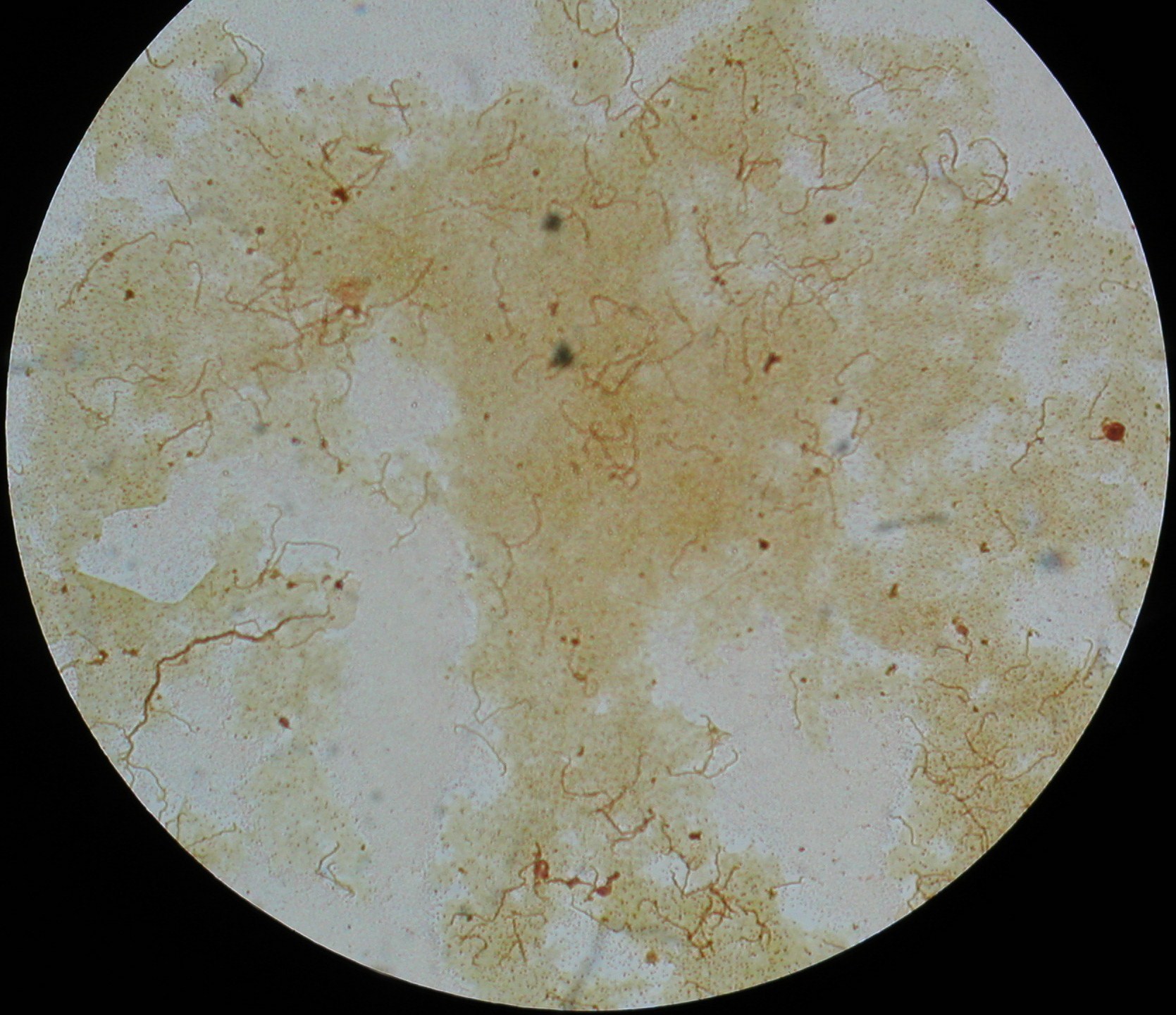
widać krętki (są gram -), spośród krętków nie można hodować in vitro Treponema pallidum ( z Treponema tylko szczepy niechorobotwórcze dają się hodować in vitro)
5. Przetrwalniki - preparat barwiony zielenią malachitową i safraniną - pretrwalniki na zielono
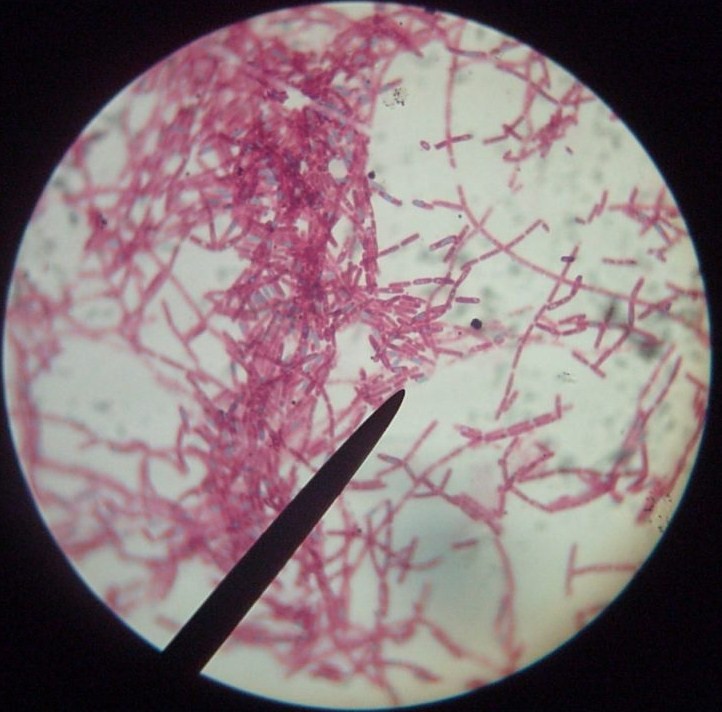
pałeczki gram + i przetrwalniki; przetrwalniki to spoczynkowe komórki ; kształt kulisty lub owalny; położenie centralne, podbiegunowe, biegunowe; średnica mniejsza (u Bacillus) lub większa (u Clostridium) od komórki
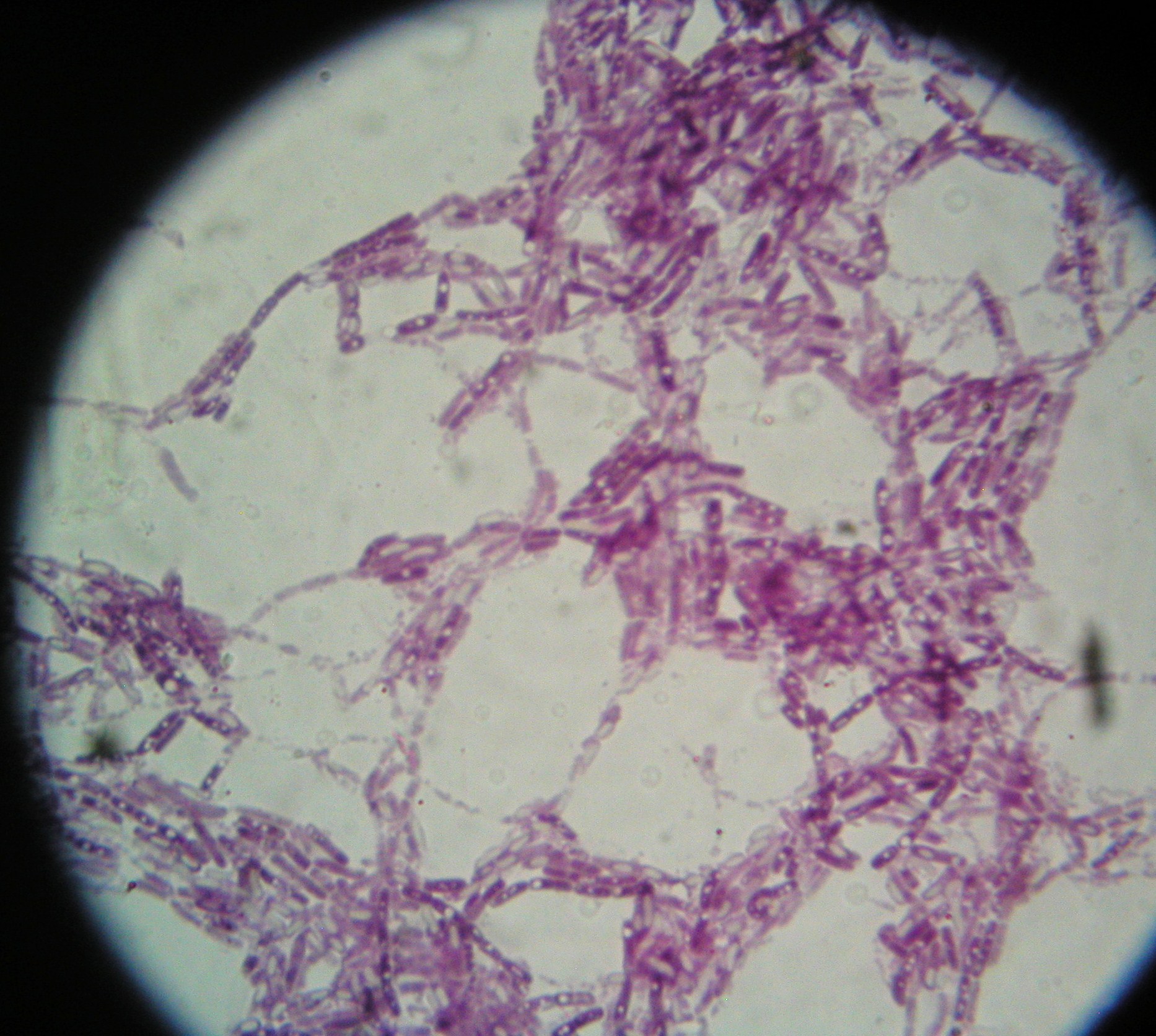
6. Przetrwalniki - preparat barwiony metodą Grama
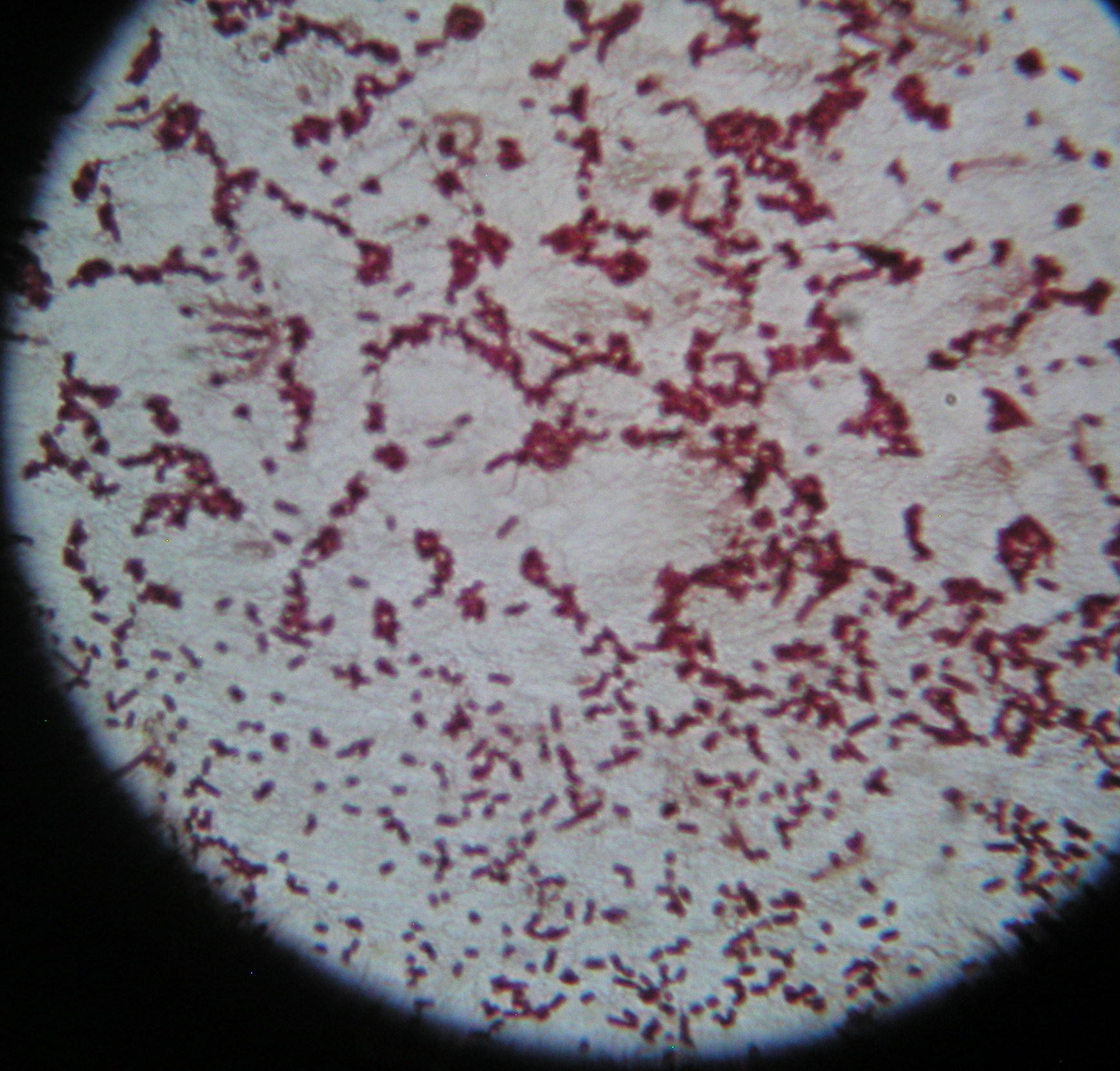
7. Rzęski
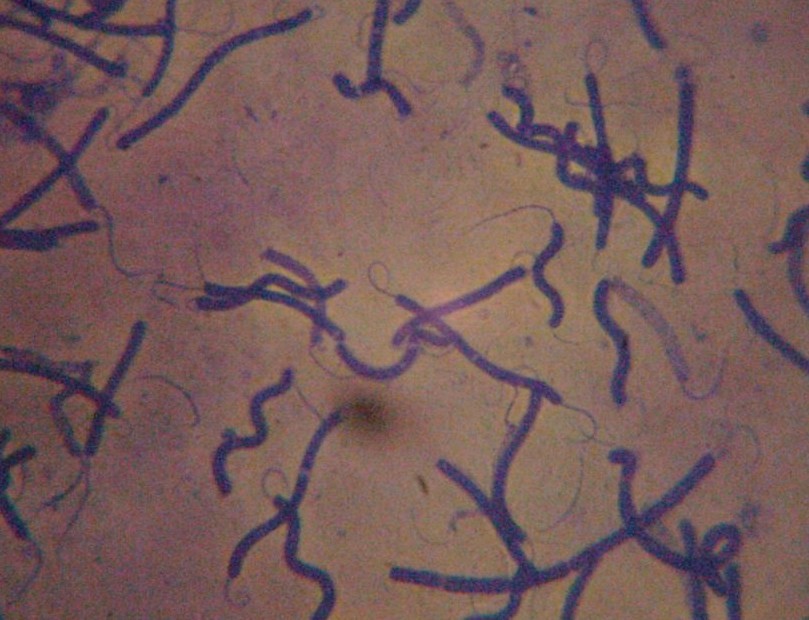
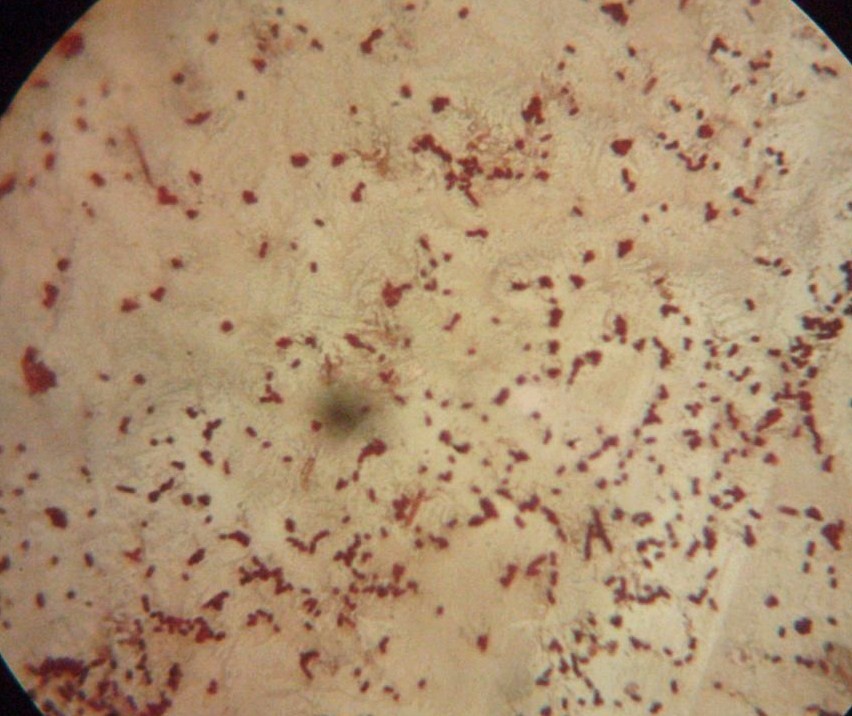
niektóre Enterococcus mają rzęski, peritrichalnie ułożone rzęski u Clostridium (oprócz C.perfringens) Listeria monocytogenes, Pseudomonas - jedna, lub więcej rzęsek na jednym biegunie, Escherichia, Salmonella, Proteus, Vibrio - 1 rzęska, Campylobacter, Helicobacter - rzęski na końcu komórki
ćw. 3
1. Sporal A : u góry wyniki negatywny, u dołu pozytywny

2. Sporal S : u góry wynik negatywny, u dołu pozytywny

Sporal A - autoklawy - przetrwalniki Bacillus stearothermophilus
Sporal S - suszarki - przetrwalniki Bacillus subtilis
każde opakowanie zawiera 10^8 do 10^9 przetrwalników
sporal A - ulega całkowitemu wyjałowieniu w 121st C w czasie 20 min
sporal S - ulega całkowitemu wyjałowieniu w 160st C w czasie 2 godzin
gdy zostaną niedokładnie wyjałowione to po inkubacji nastąpi zmętnienie i powstanie kożuch
3. Hemoliza alfa i beta
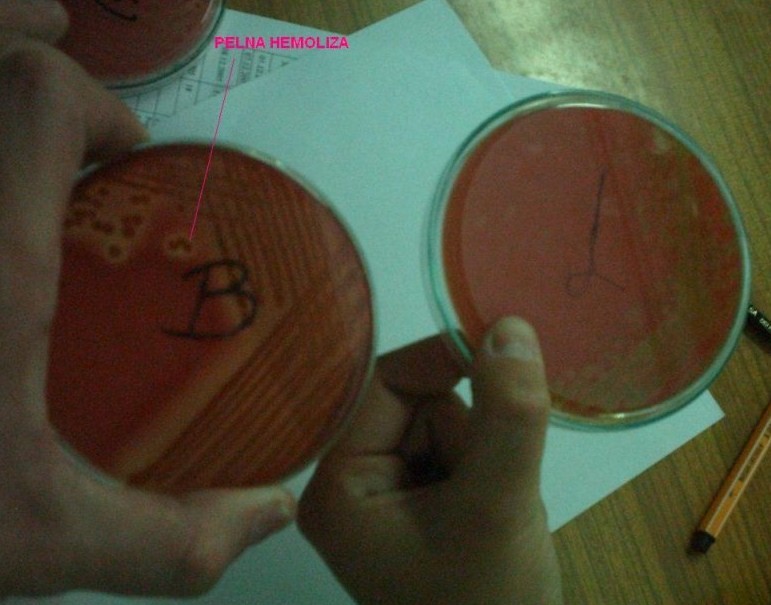
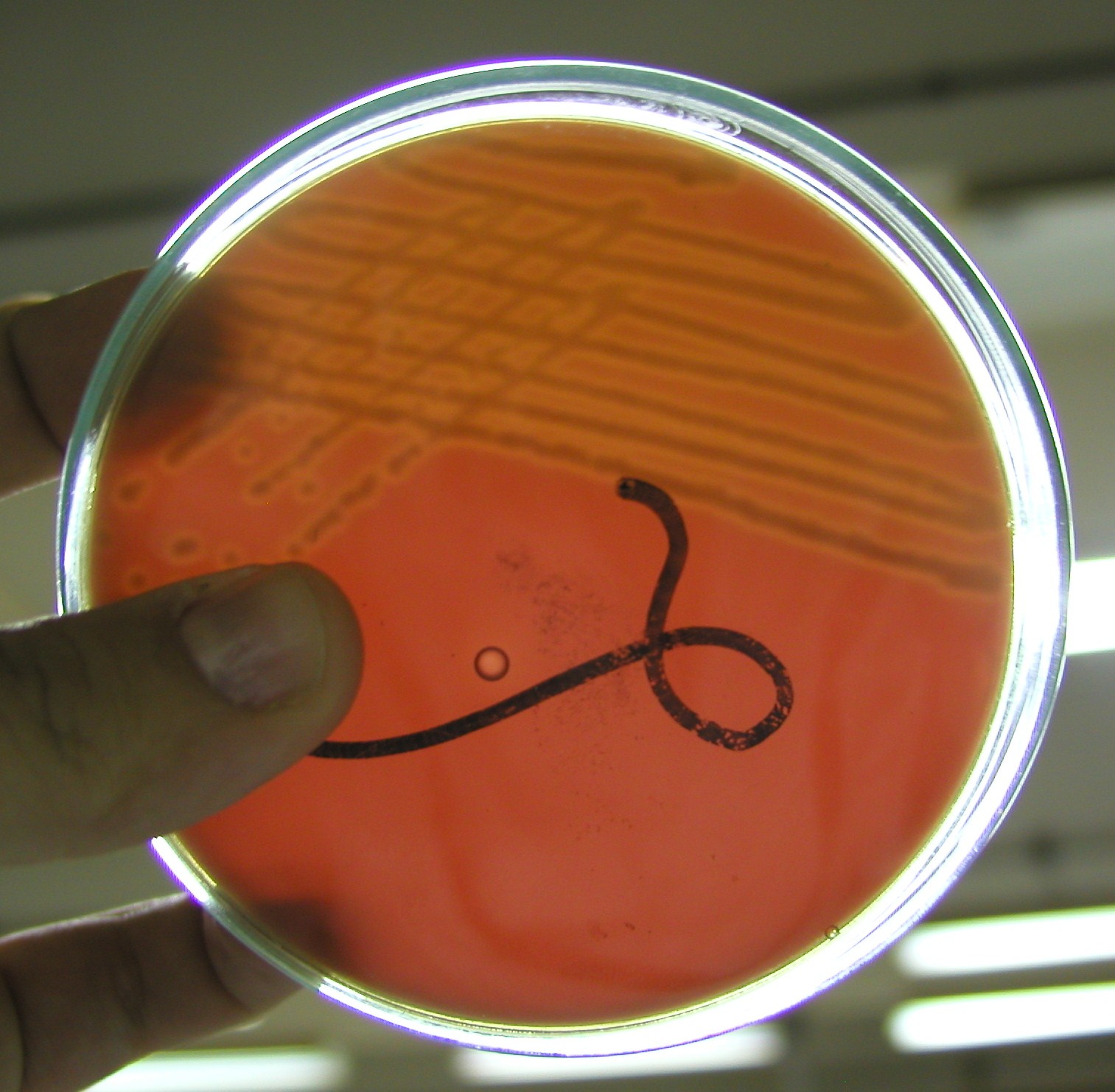
hemoliza alfa - niepełna, dokoła kolonii bakteryjnych widoczna jest strefa zazielenienia podłoża spowodowana przekształceniem hemoglobiny w methemoglobinę
→ S. pneumoniae (warunki tlenowe), Enteococcus (albo brak hemolizy)
hemoliza beta - pełna, dokoła kolonii strefa całkowitego przejaśnienia powstała w wyniku całkowitego rozpadu krwinek czerwonych
→ Staphylococcus, S. pyogenes, S. pneumoniae (beztlenowo) S. agalactiae, paciorkowce jamy ustnej
4. Próba z czerwienia metylowa = pepton + fosforan potasowy + glukoza
bada czy glukoza jest rozkładana do produktów kwaśnych, czy nie
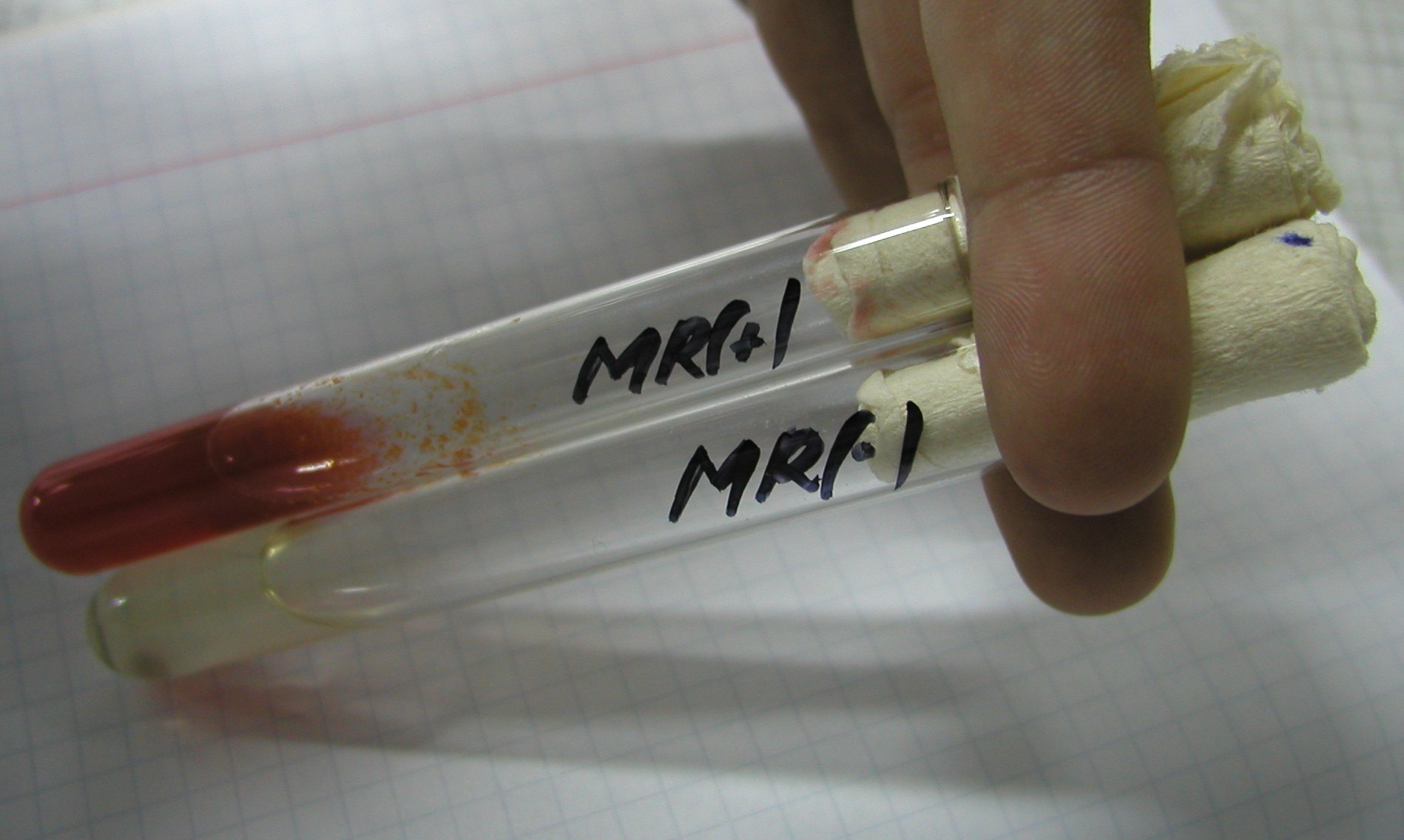
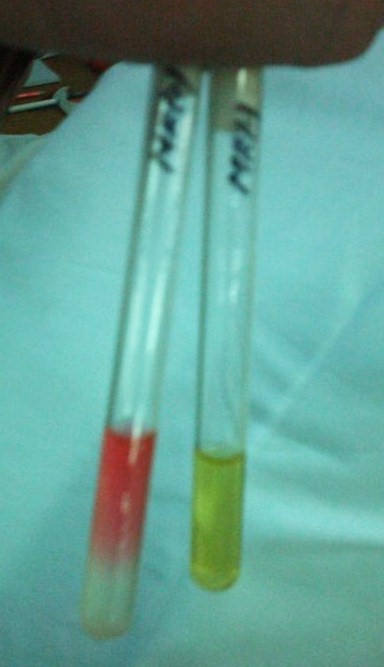
pH< 4,5 - wynik dodatni = zabarwienie czerwone
pH> 4,5 - wynik ujemny = zabarwienie żółte
5. indol +/- (woda peptonowa z tryptofanem?)

6. Podłoże Mac Conkey'a
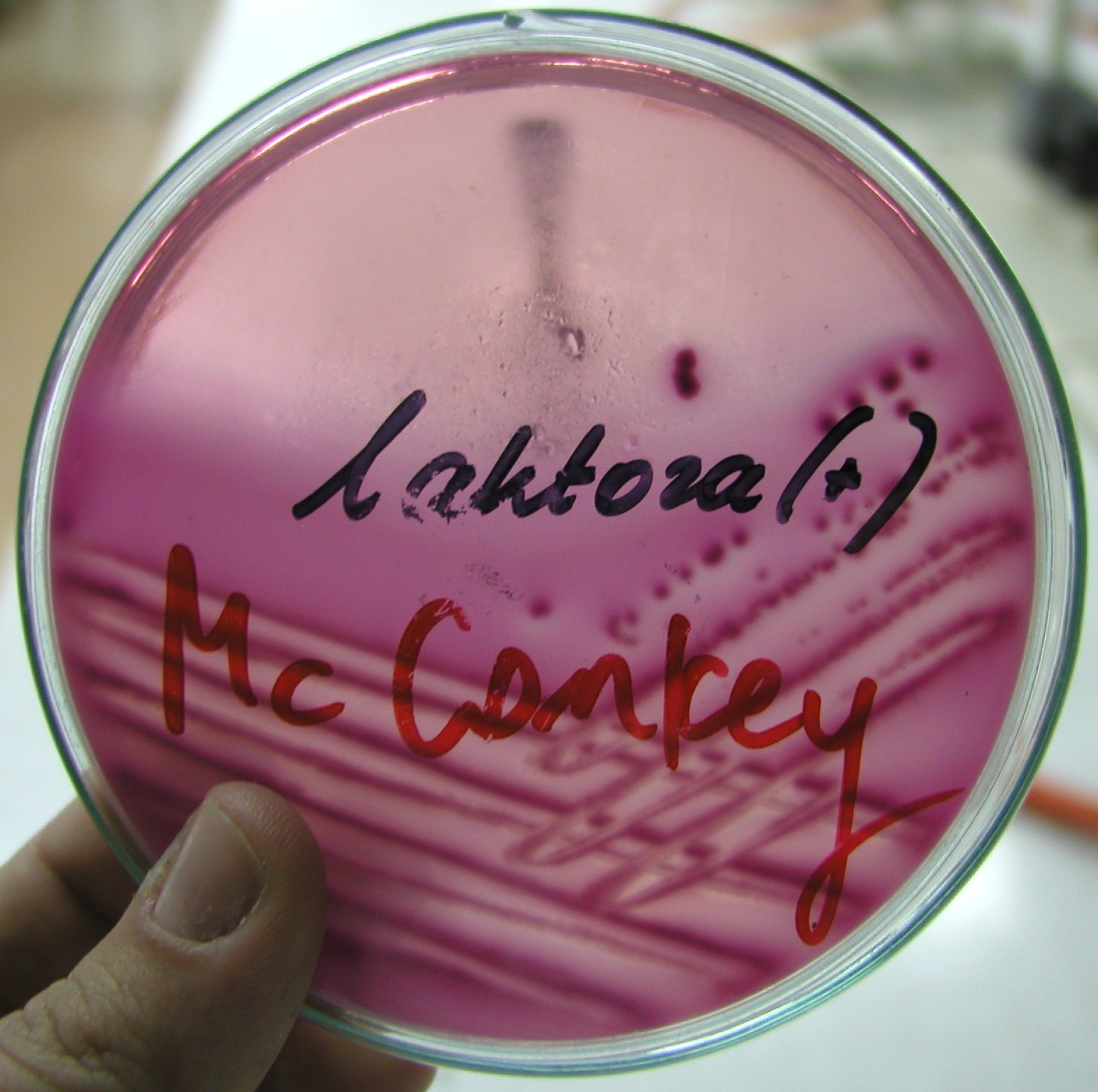

podłoże wybiórczo - różnicujące dla pałeczek jelitowych
czynnik wybiórczy - fiolet krystaliczny
czynnik różnicujący - laktoza:
- pałeczki rozkładające laktozę tworzą kolonie o barwie ciemnoróżowej
- pałeczki nie rozkładające laktozy tworzą kolonie o barwie białawo - przezroczystej
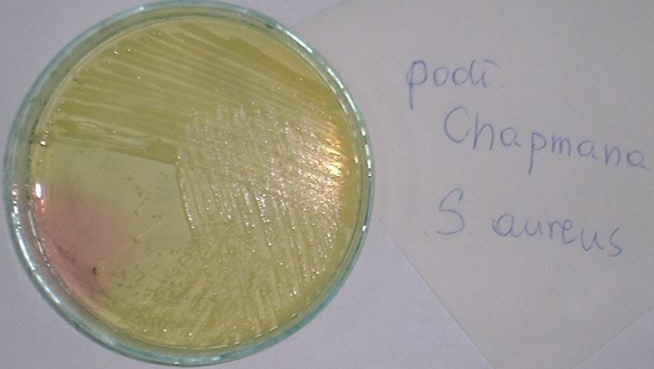
7. Podłoże Chapmana
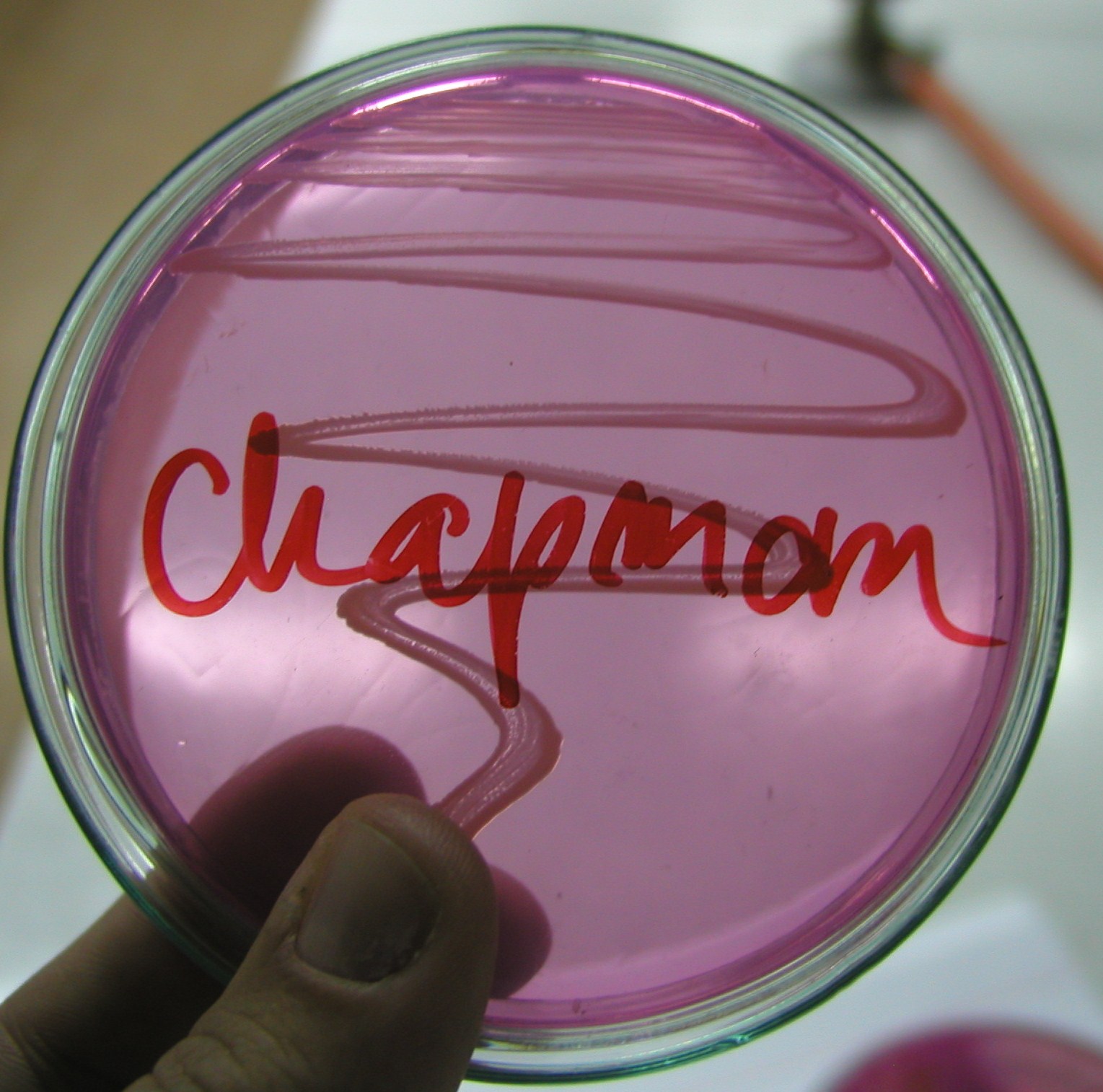
podłoże wybiórczo - różnicujące dla gronkowców
czynnik wybiórczy: 7,5-10% NaCl
czynnik różnicujący: mannitol
szczepy rozkładające mannitol wytwarzają żółte kolonie, przy czym ulega również zmianie zabarwienie podłoża z różowego na żółte
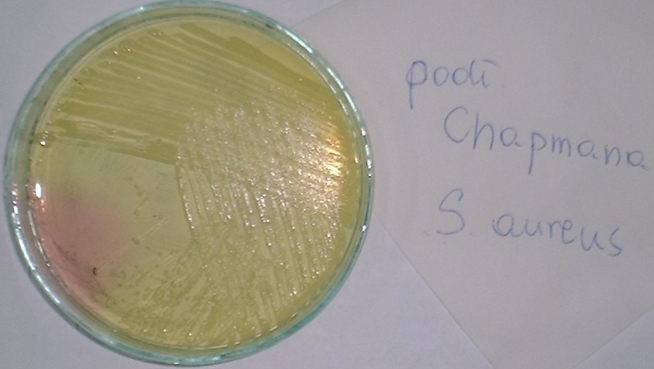
8. Rozkład glukozy i laktozy
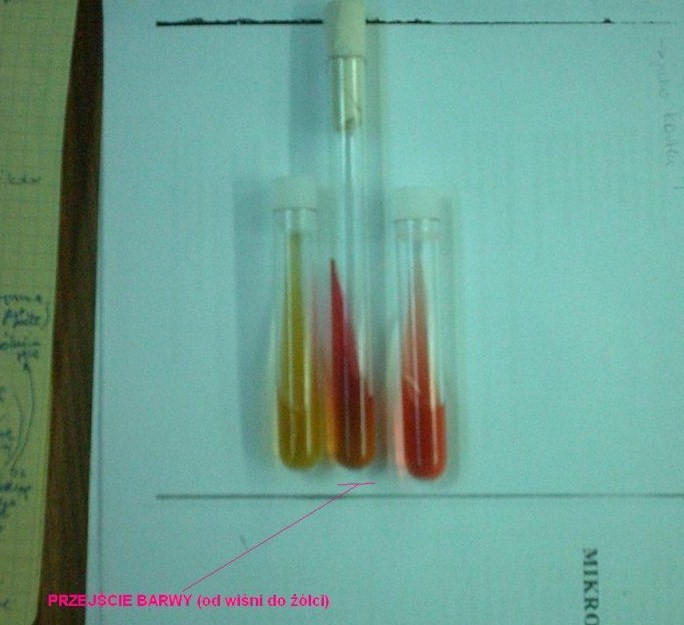
9. Rozkład mocznika - podłoże Christensena - zmiana zabarwienia z żółtego na fioletowy oznacza rozkład mocznika

10. Podłoża do testu na katalazę (dodaje się 3% r-ru nadtlenku wodoru i gdy pojawią się pęcherzyki - katalaza + )
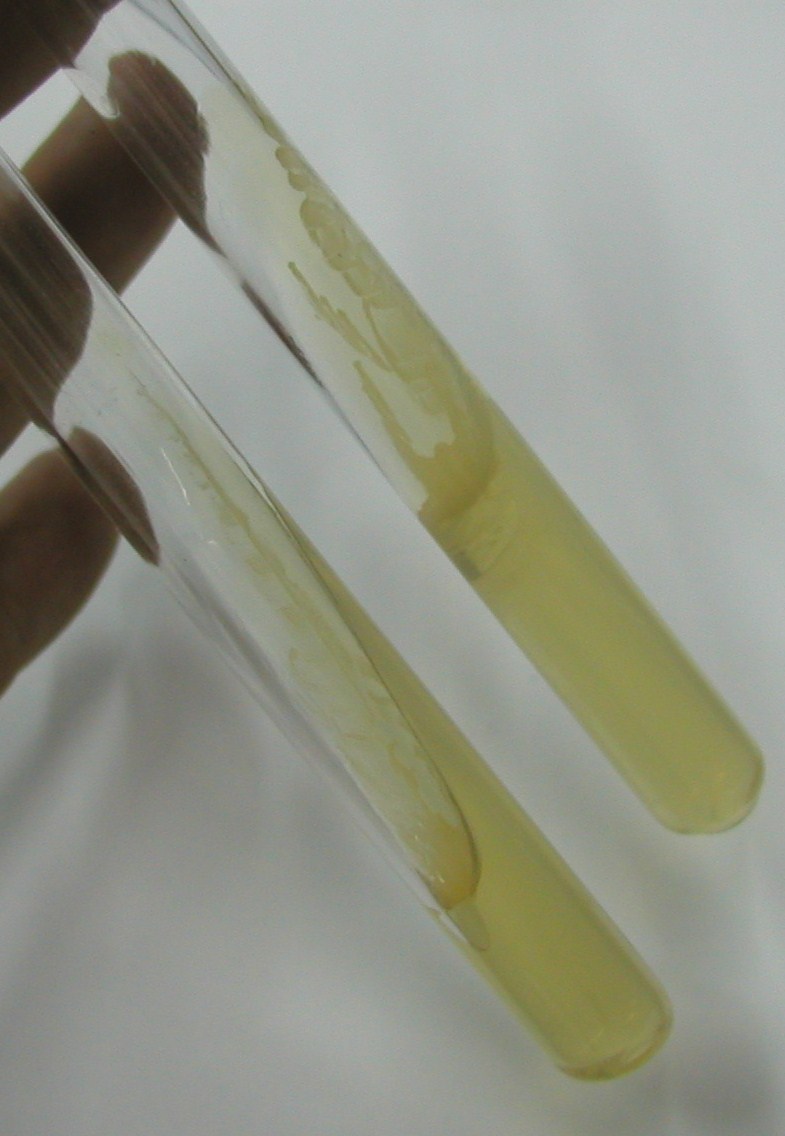
ćw. 4
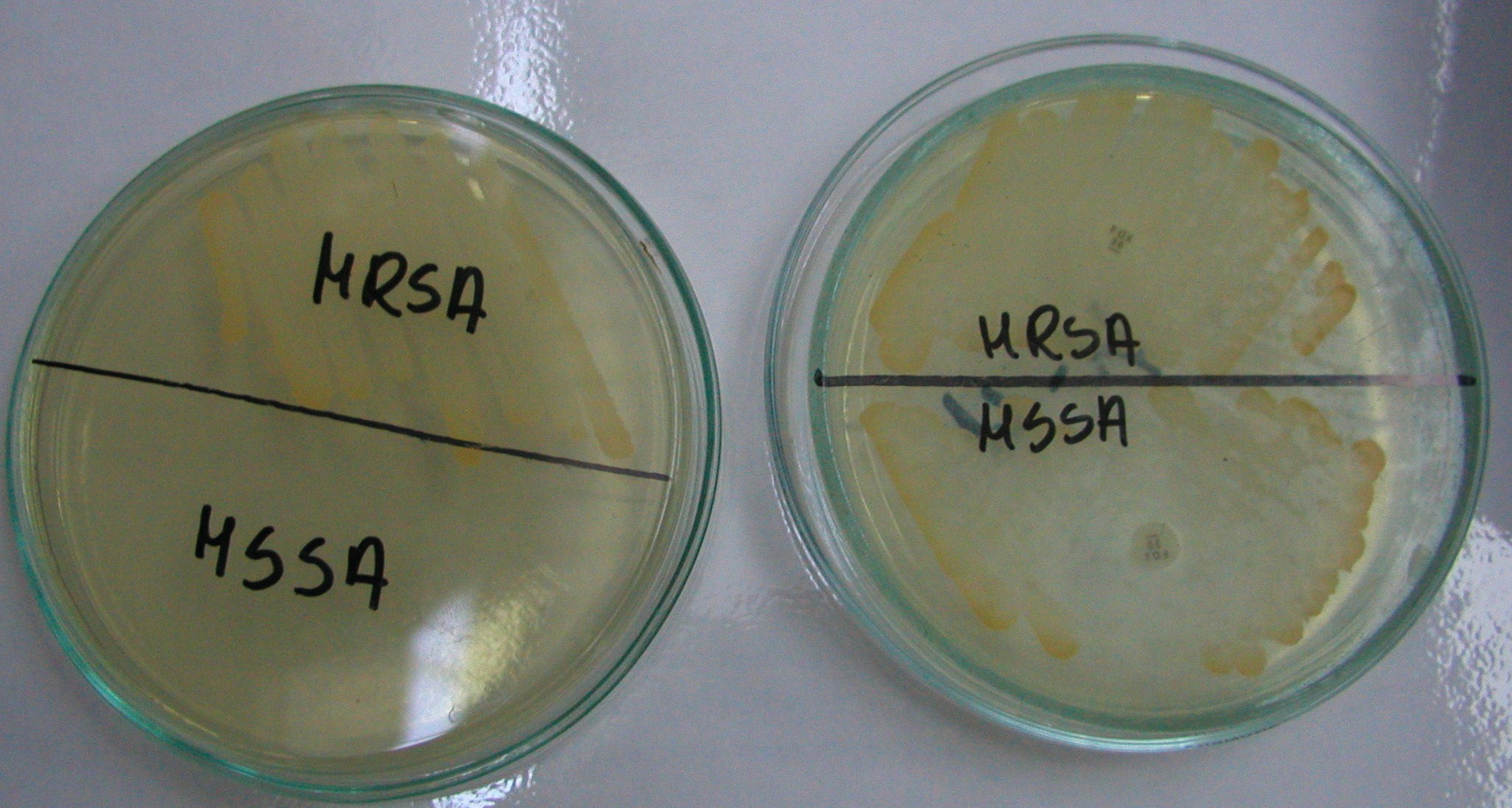
1. MRSA - gronkowce metycylinooporne
MSSA - gronkowce metycylinowrażliwe
2. test na wytwarzanie EESBL - beta-laktamaz o rozszerzonym spektrum działania
EESBL degradują wszystkie antybiotyki oprócz monobaktamów
podłoże Muellera-Hintona
1 krążek np. Cefalosporyna
2 krążek - ta sama cefalosporyna sprzężona z kwasem klawulanowym (inhibitor beta-laktamazy)
porównujemy średnicę, jeśli różnica jest większa lub równa 5mm to bakterie wytwarzają EESBL
3. E-test
to metoda ilościowa oznaczania wrażliwości bakterii na antybiotyk
określa najmniejsze st. hamujące
zasada metody: dyfuzja antybiotyku z bibuły do podłoża
pasek bibuły jest nasączony wzrastającymi st. antybiotyku
strefa zahamowania wzrostu ma kształt elipsy - jej początek mówi o najmniejszym st. Hamującym
4. Metoda dyfuzyjno - krążkowa
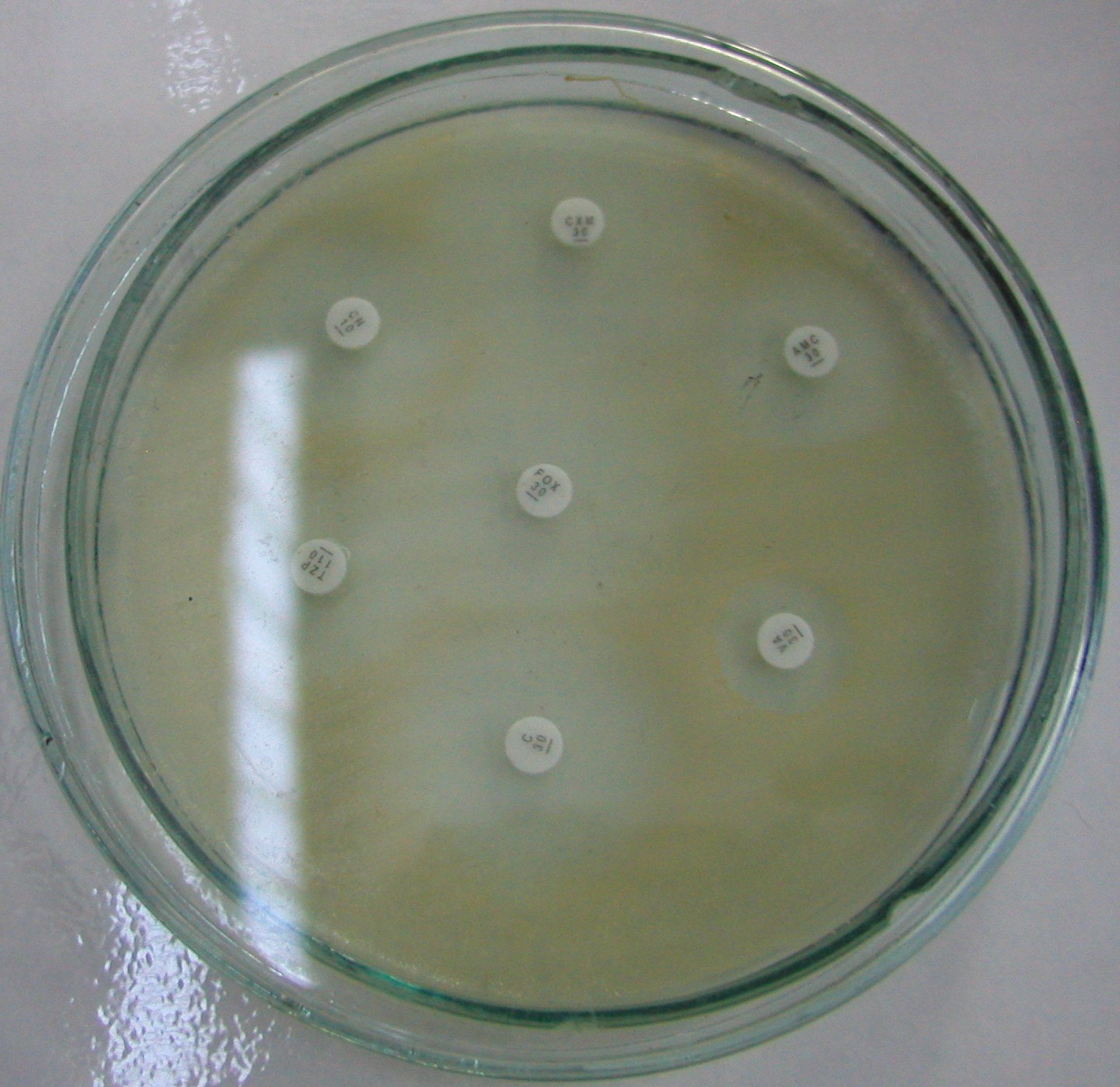
to metoda jakościowa oznaczania wrażliwości bakterii na antybiotyk
krążki bibuły nasączone antybiotykiem
zasada metody: dyfuzja antybiotyku z bibuły i działanie na drobnoustroje posiane na pow. podłoża
podłoże Muellera - Hintona
odległość między krążkami nie mniejsza niż 2 cm
najpierw 30 min w temp. pokojowej, później w cieplarce 37st przez 18-24 godz
po inkubacji - mierzymy średnice stref zahamowania wzrostu - podajemy w mm - porównujemy z tabelą wzorcową
klasyfikujemy dany drobnoustrój jako: wrażliwy, średnio wrażliwy, oporny
kontrola: badanie szczepów o znanej wrażliwości
5. Synergizm działania antybiotyków np. Biseptol: trimetoprim z sulfametoksazolem
6. Antagonizm działania antybiotyków np. bakteriobójcze z bakteriostatycznymi
ćw. 5 - Paciorkowce, Enterokoki,
1. Hemokultura paciorkowca
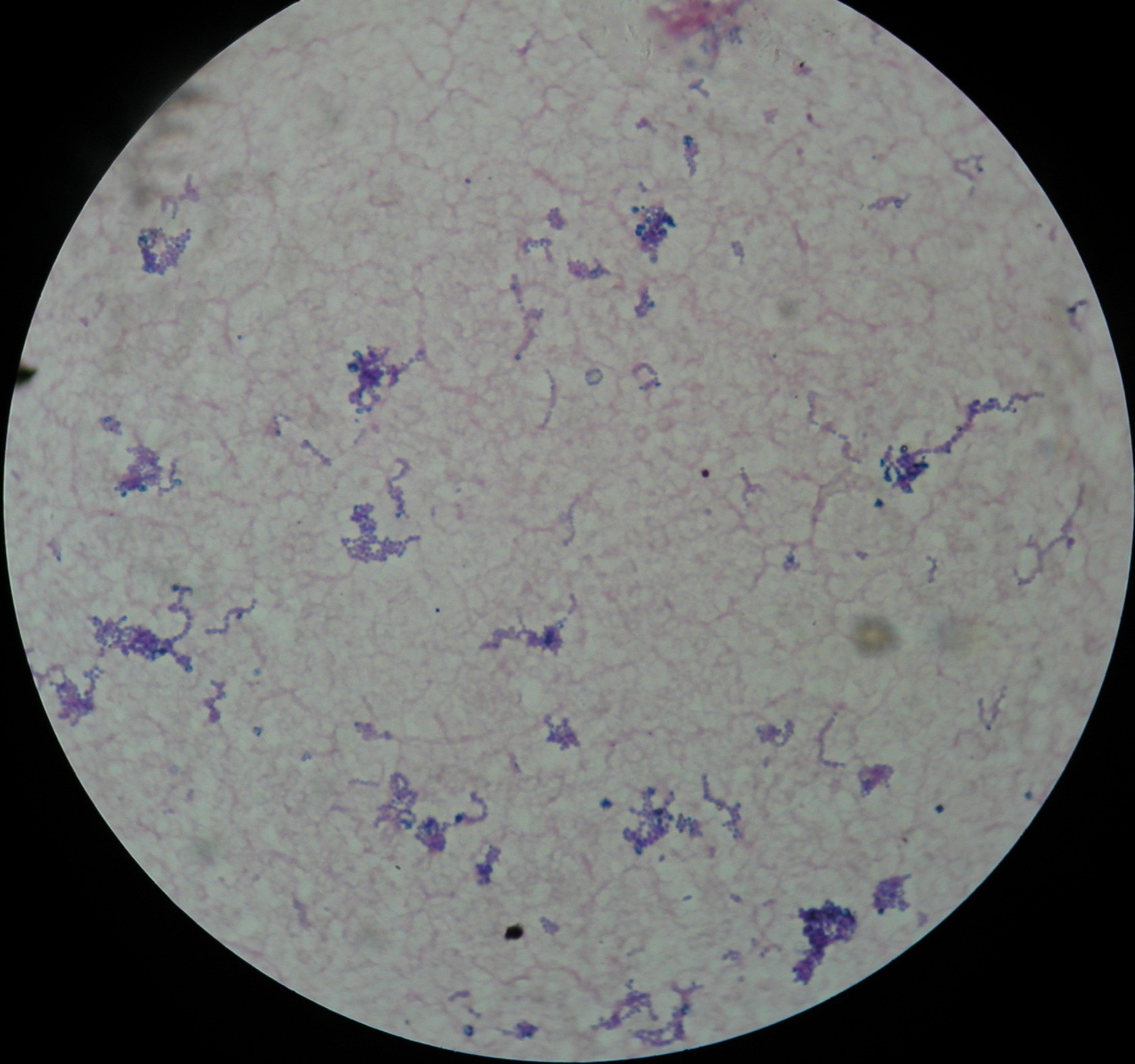
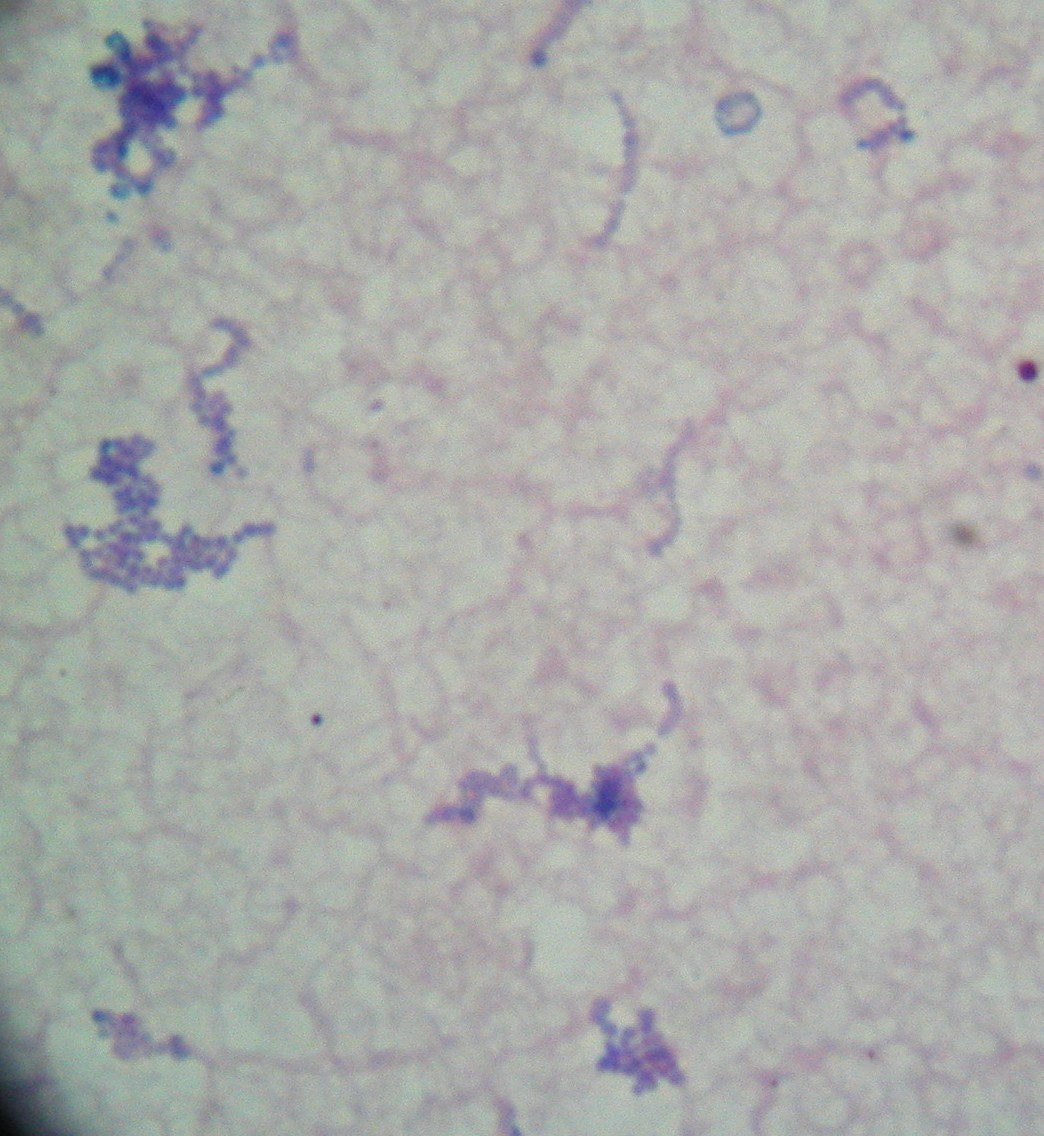
hemokultura - gdy do podłoża płynnego dodamy krew pacjenta
2. Streptococcus pneumoniae
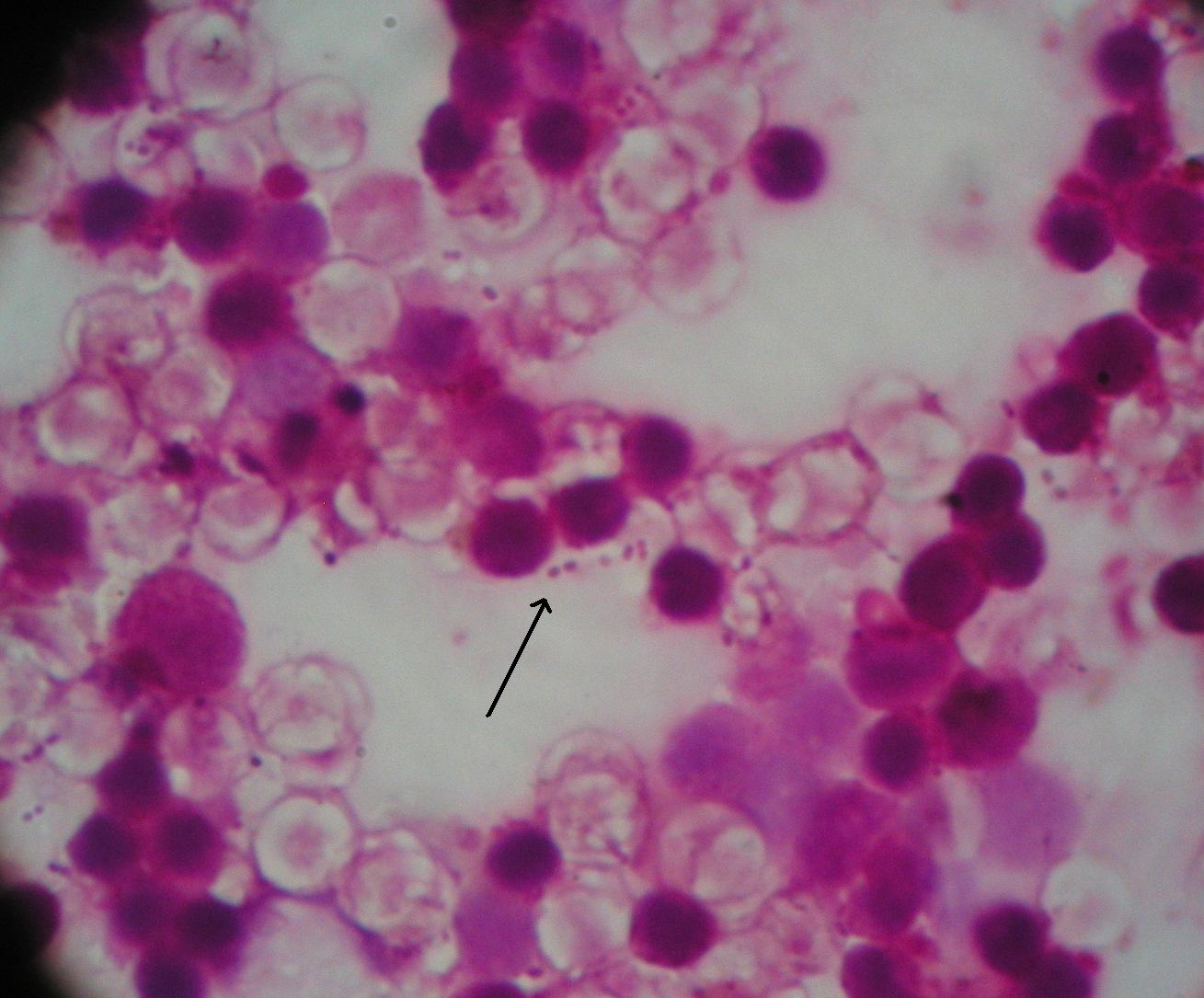
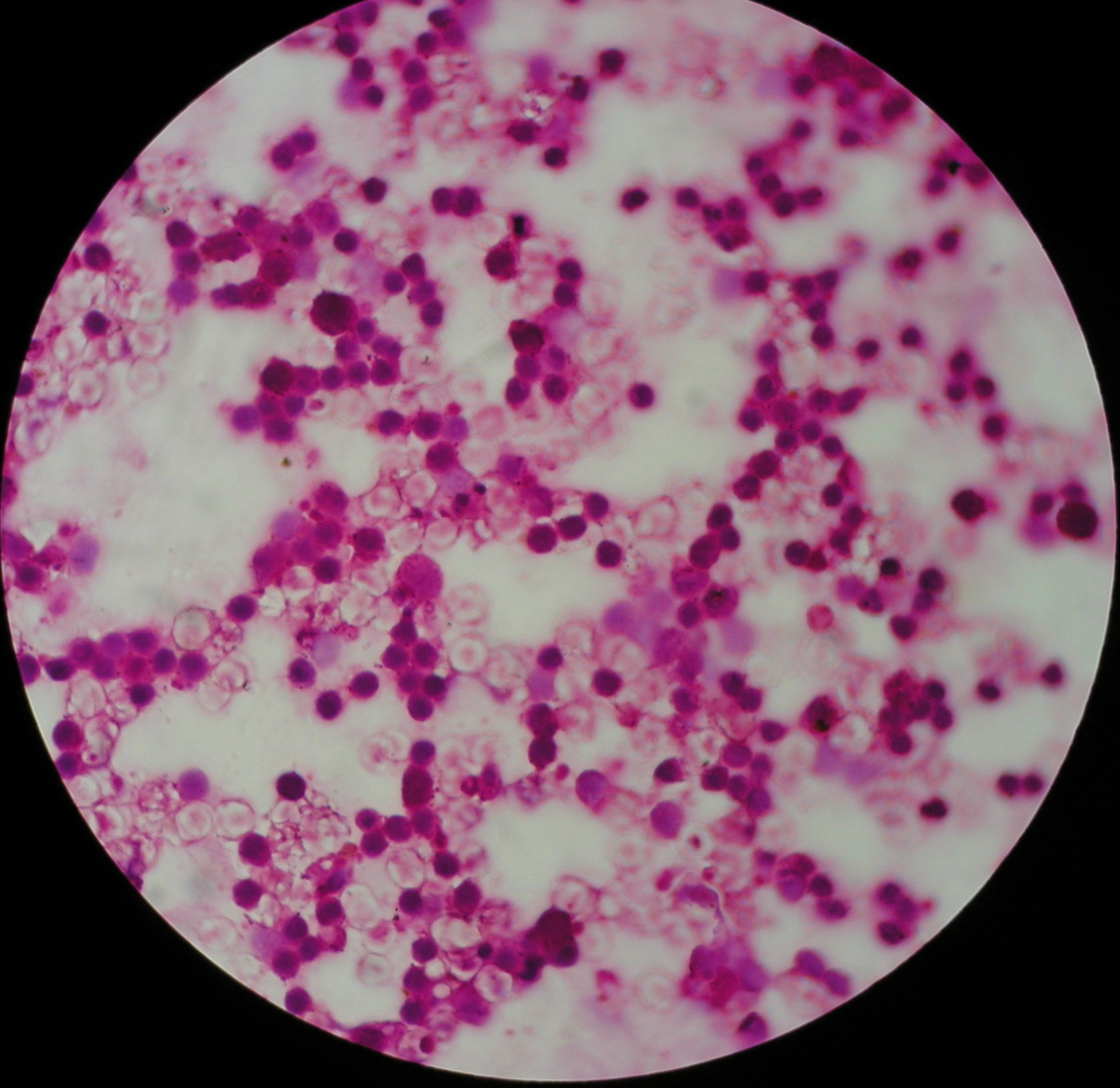
3. Enterococcus faecalis
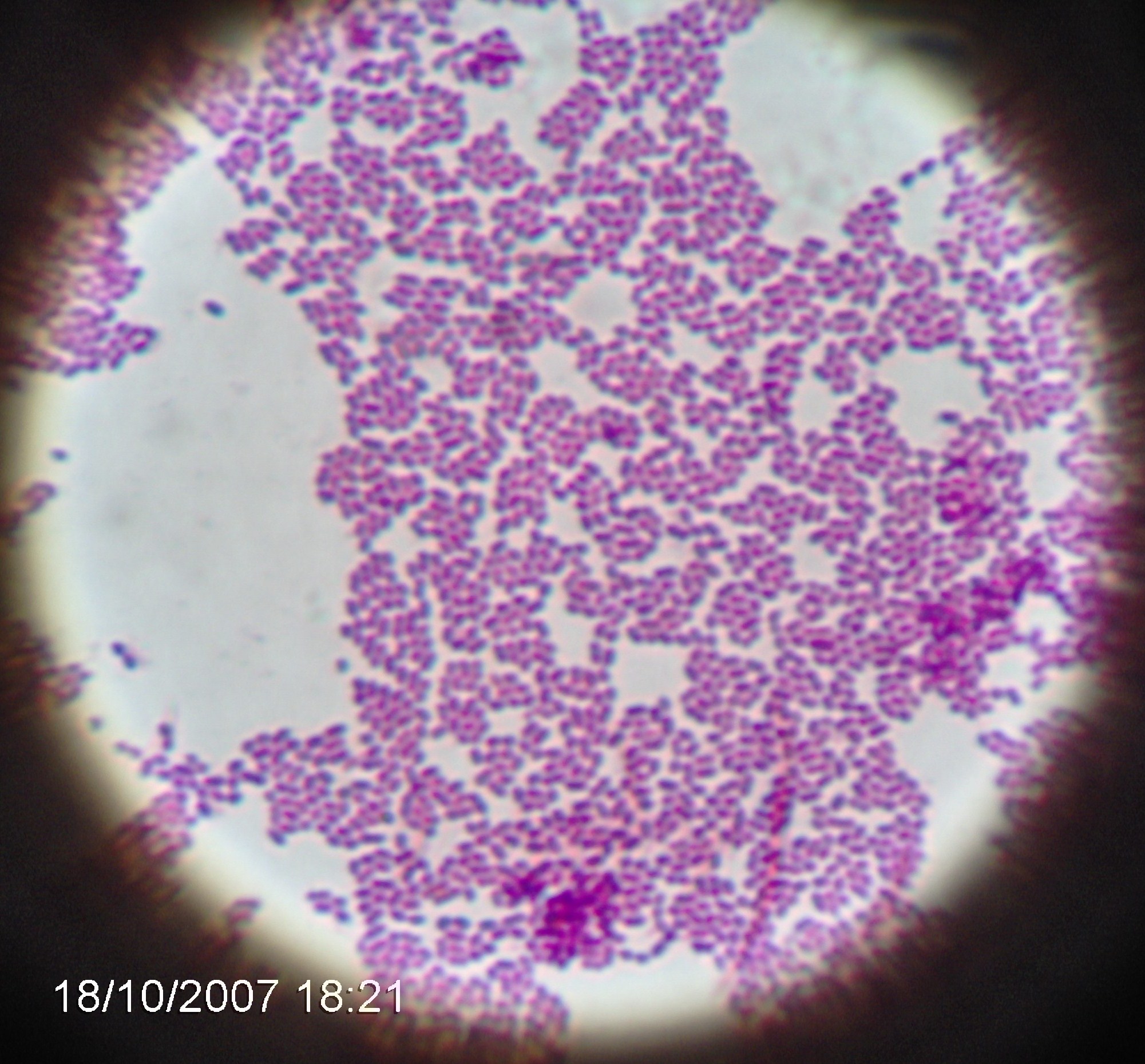
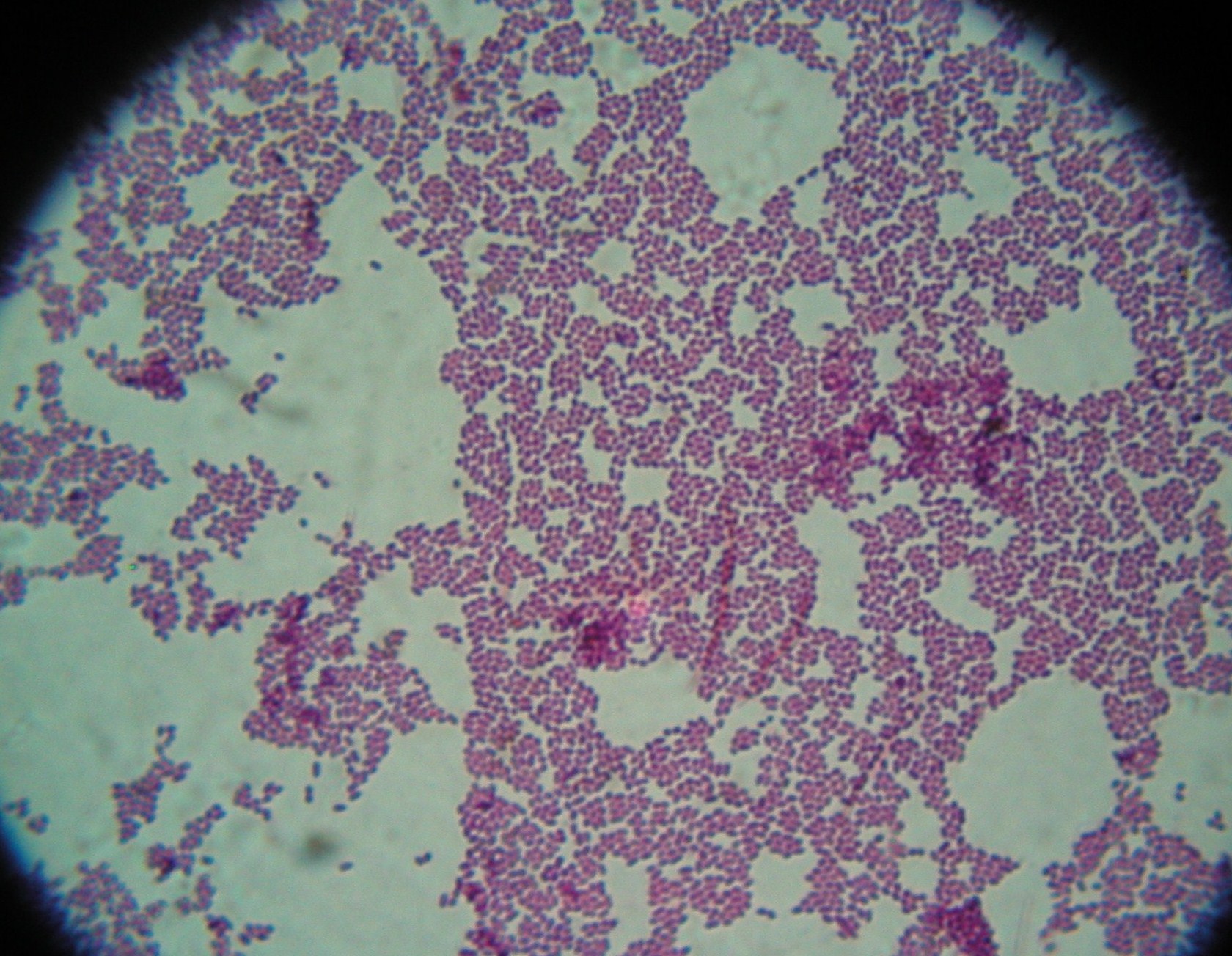
4. Coccosel agar - dla Enterokoków, zawiera żółć i eskulinę
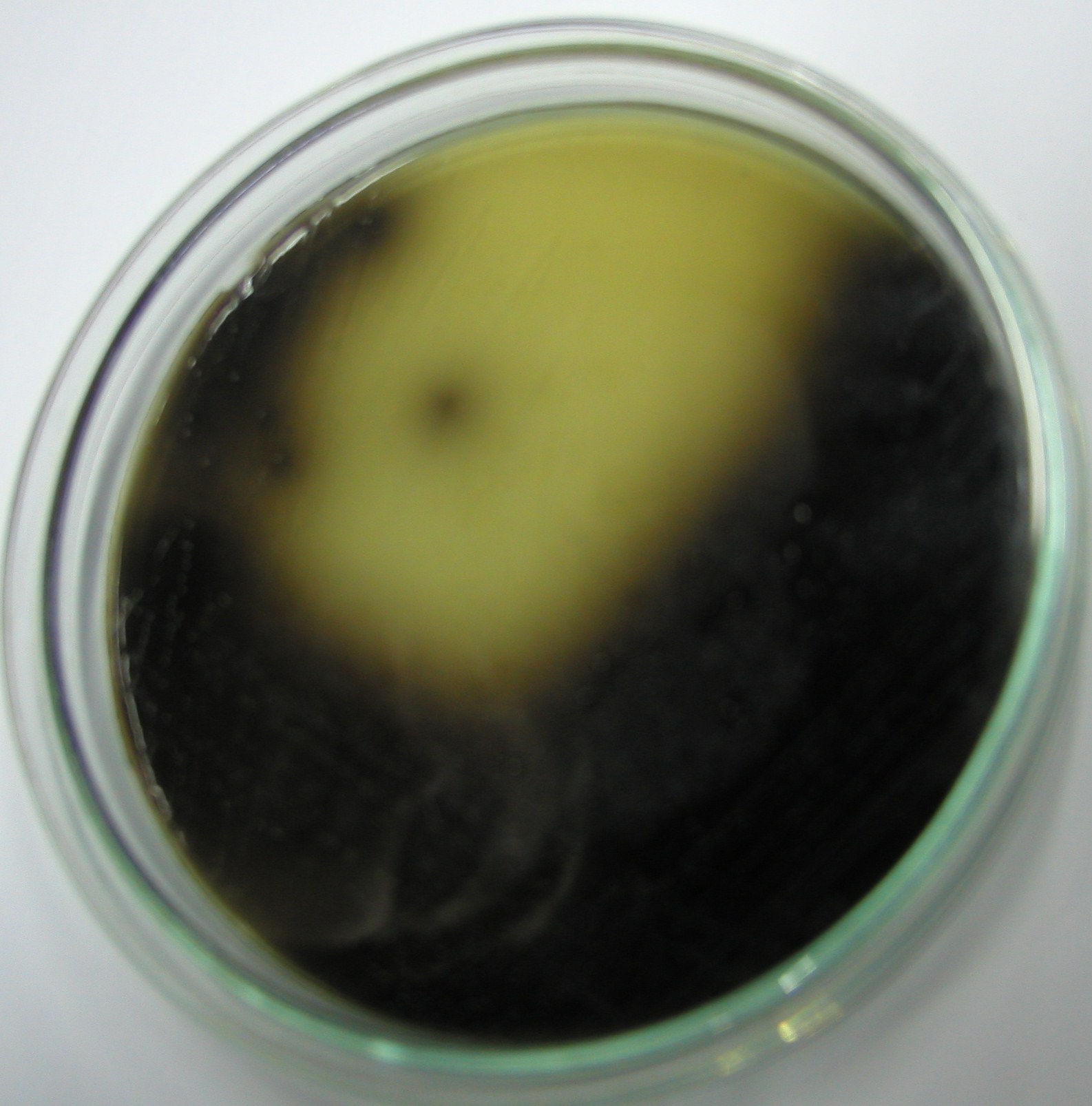
5. Streptococcus pyogenes, SP - bacytracyna, hemoliza beta
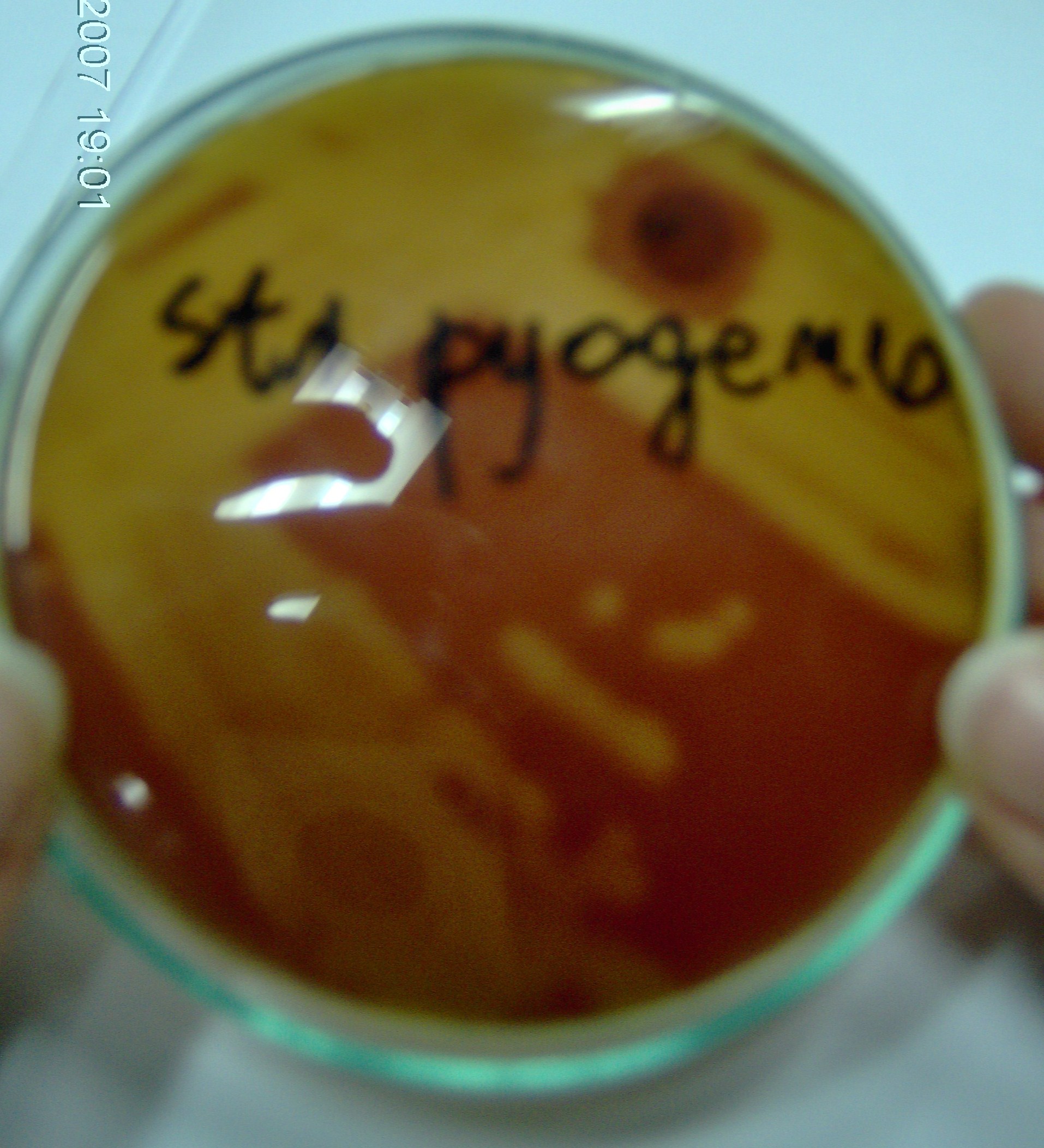
- na bacytracynę wrażliwe są jeszcze Micrococcus
- najważniejszy czynnik chorobotwórczości S. Pyogenes to białko M (w postaci fimbrii)
- egzotoksyna pirogenna - płonica
6. Streptococcus pneumoniae, OP - optiochina
układają się po dwie i wspólna otoczka, wrażliwe na optochinę (w przeciwieństwie do paciorkowców jamy ustnej) i na
kwasy żółciowe; dla S. Pneumoniae - test pęcznienia otoczek
ćw. 7 - Staphylococcus
1. Staphylococcus aureus
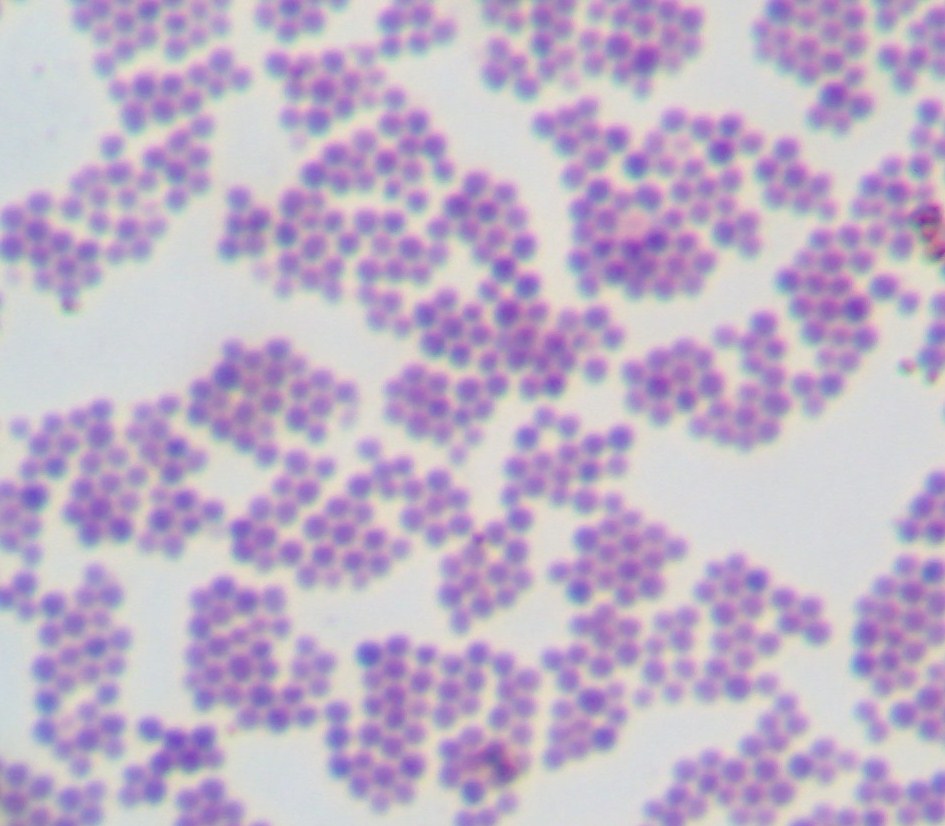
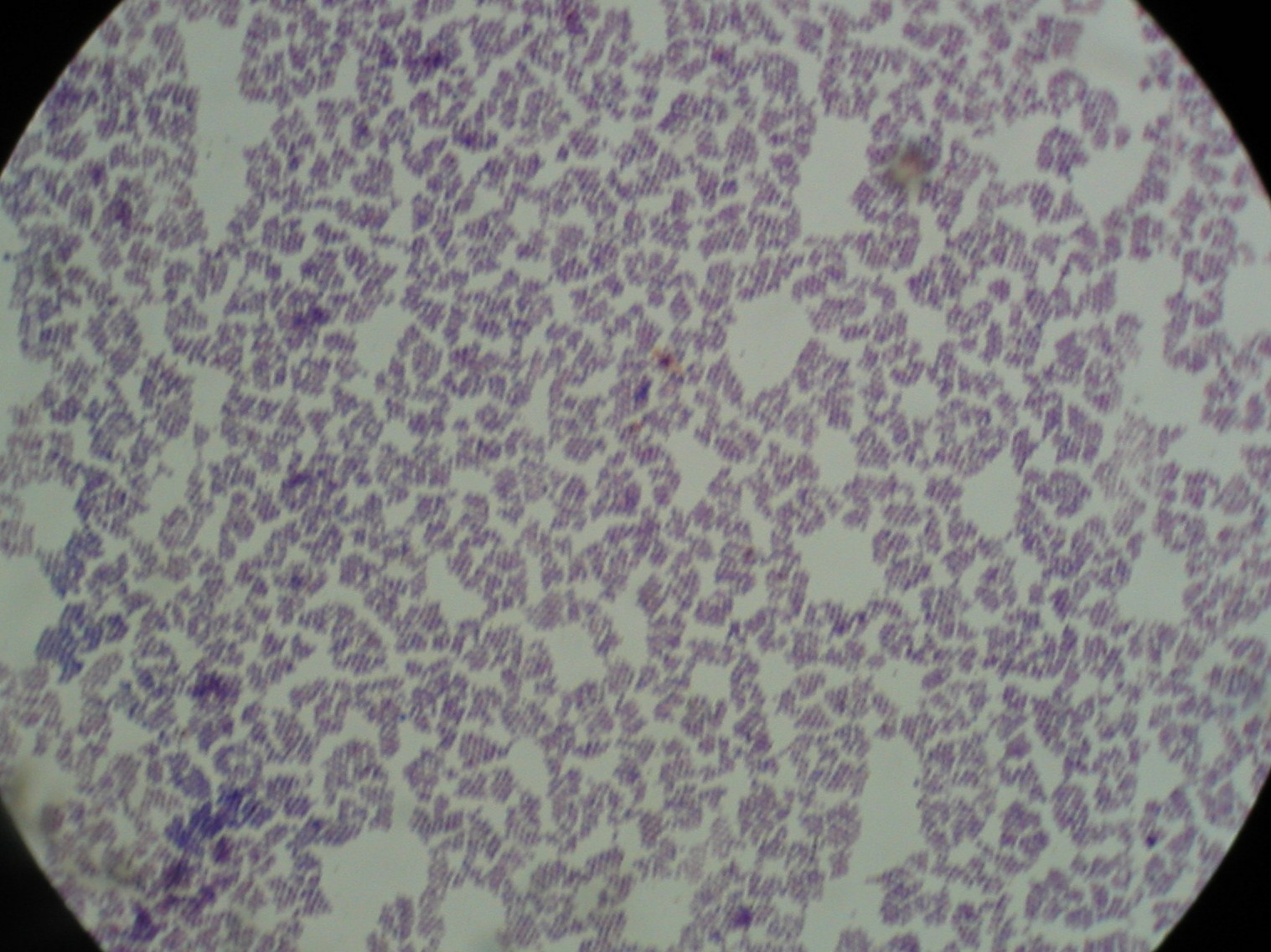
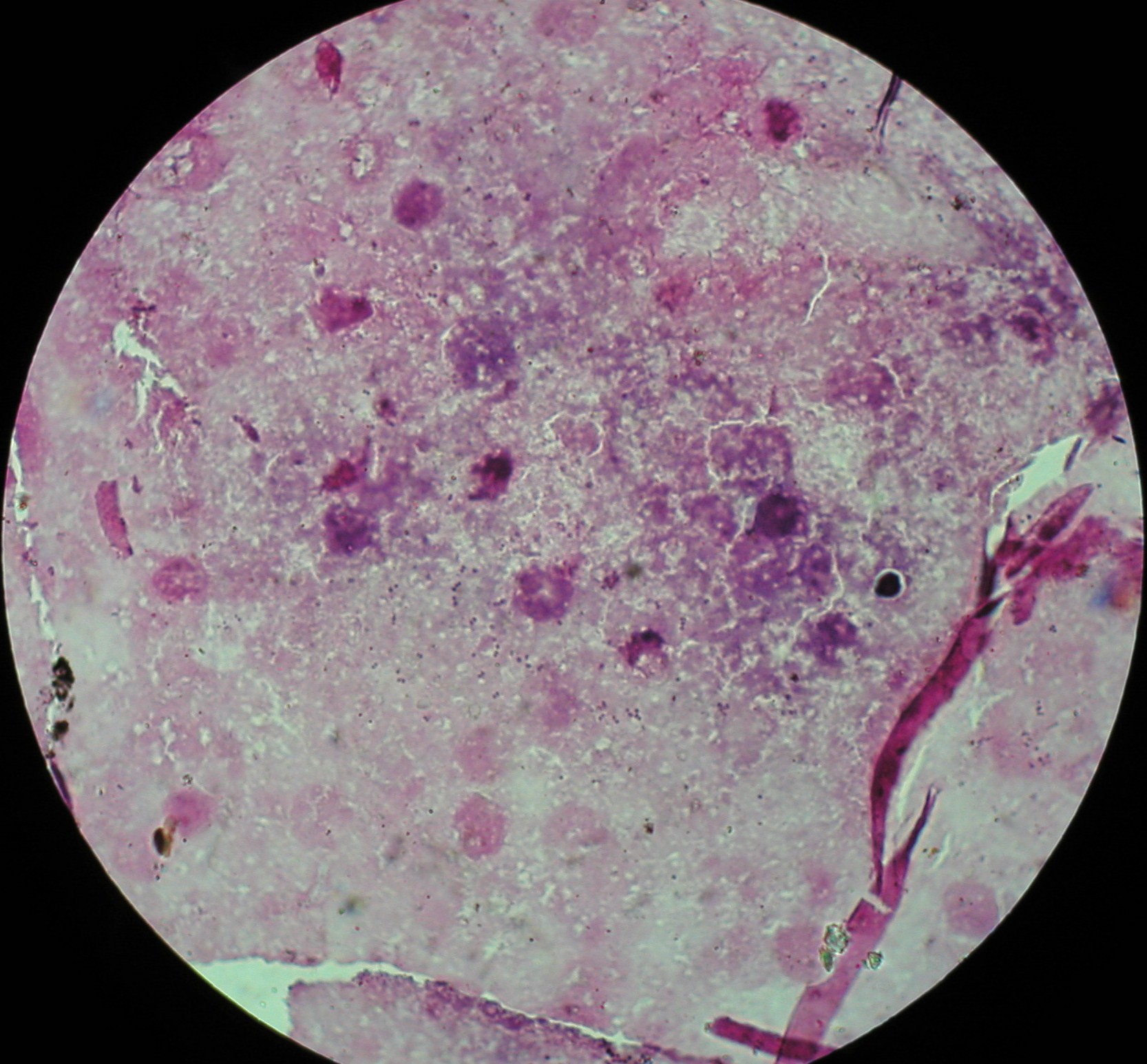
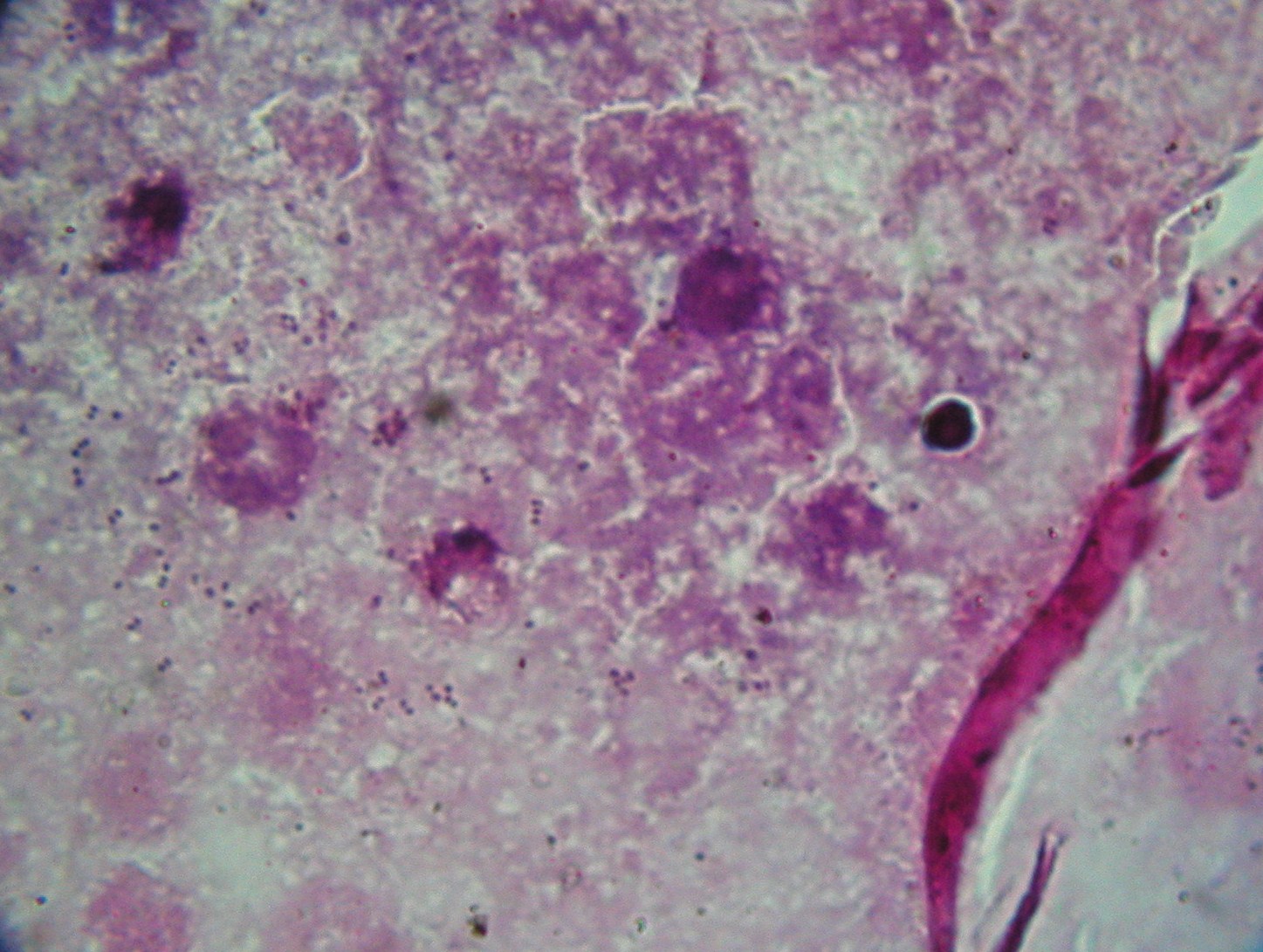
2. Ropa gronkowcowa
3. podłoże Chapmana
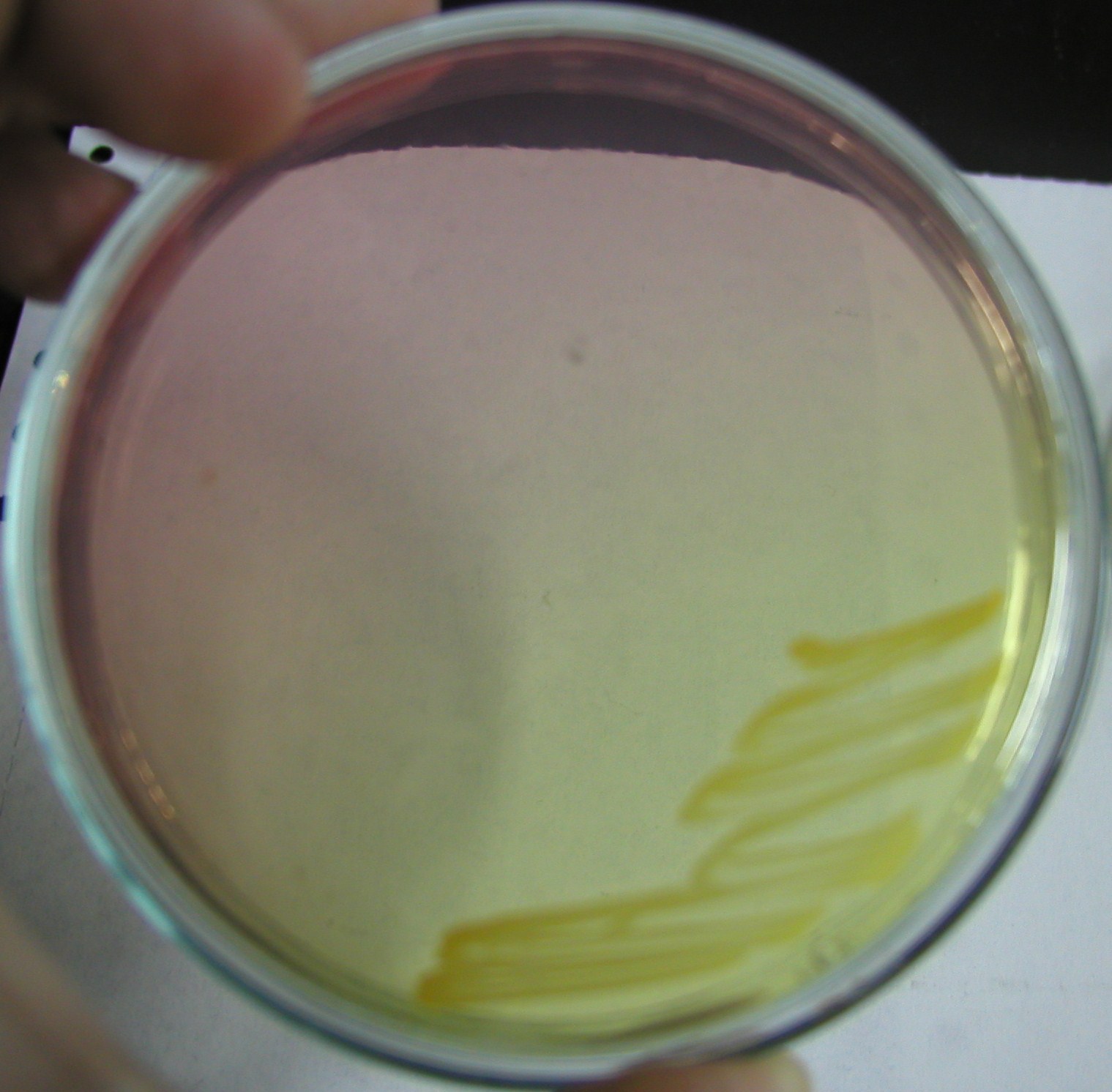
4. Furazolidon
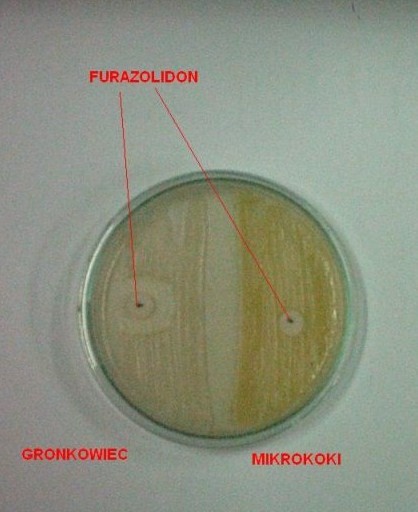
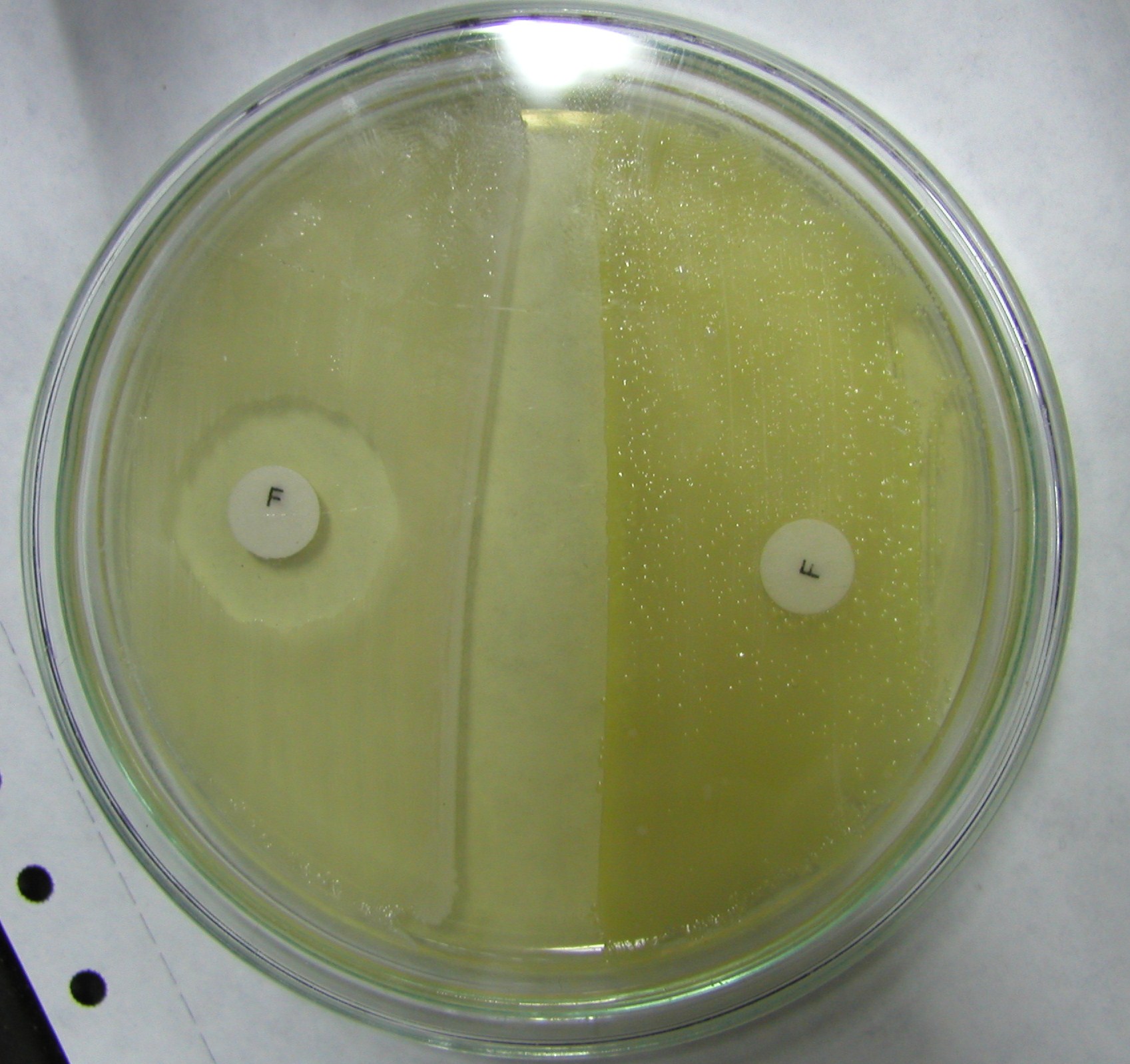
odróżnianie gronkowców od mikrokoków:
- gronkowce wrażliwe na furazolidon a mikrokoki nie
- mikrokoki wrażliwe na bacytracynę a gronkowce nie
- mikrokoki rozkładają glukozę tlenowo a gronkowce tlenowo i beztlenowo
5. Micrococcus
6. Staphylococcus aureus - gronkowiec złocisty - hemoliza beta

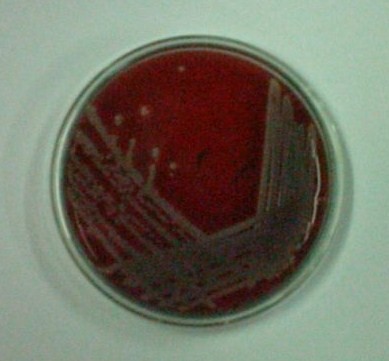
7. Staphylococcus epidermidis - nie ma hemolizy

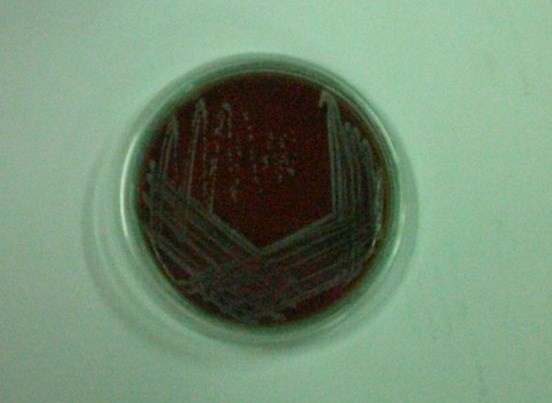
ćw. 8 - Prątki i Nokardie
1. Mycobacterium tuberculosis - prątek gruźlicy - metoda Ziehla-Neelsena
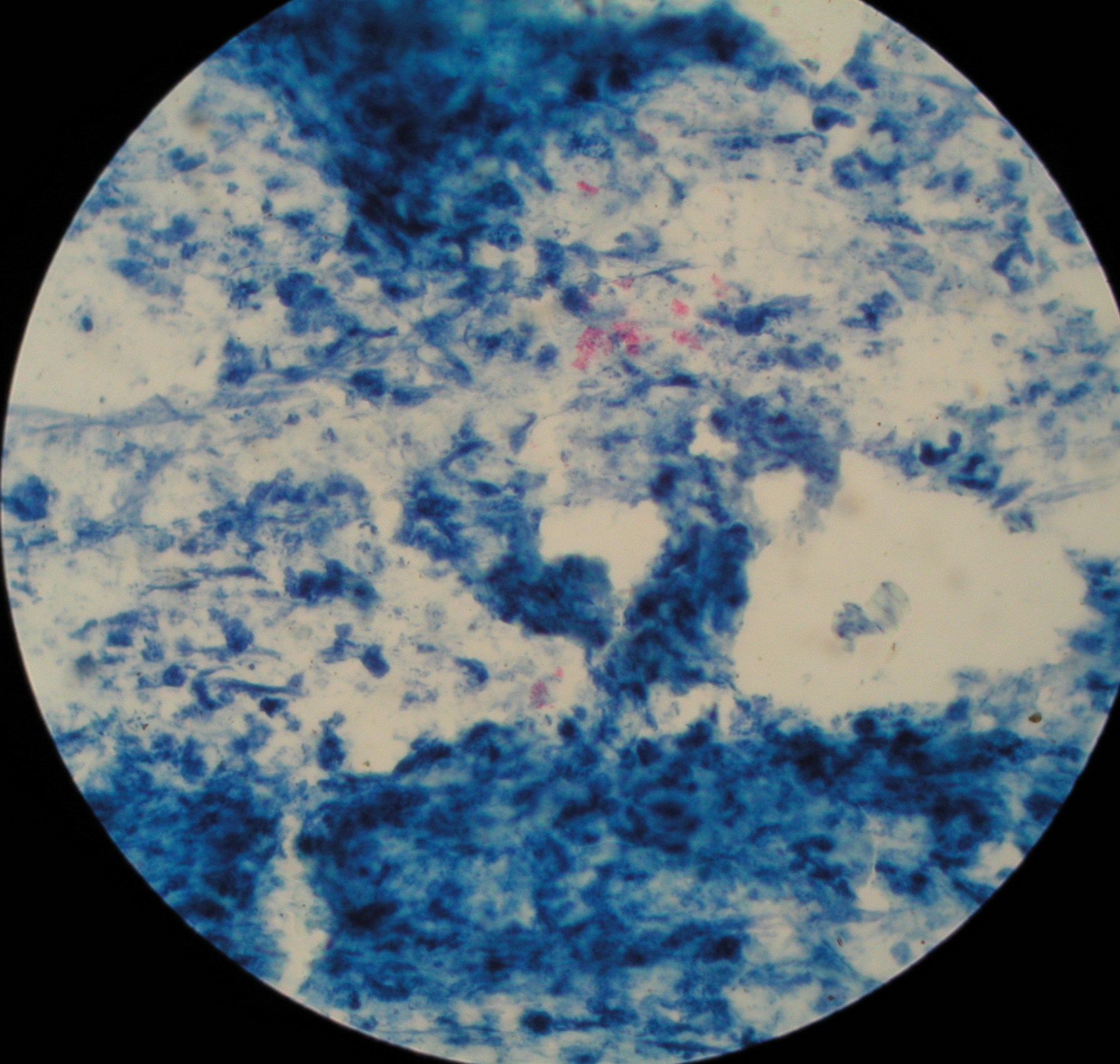
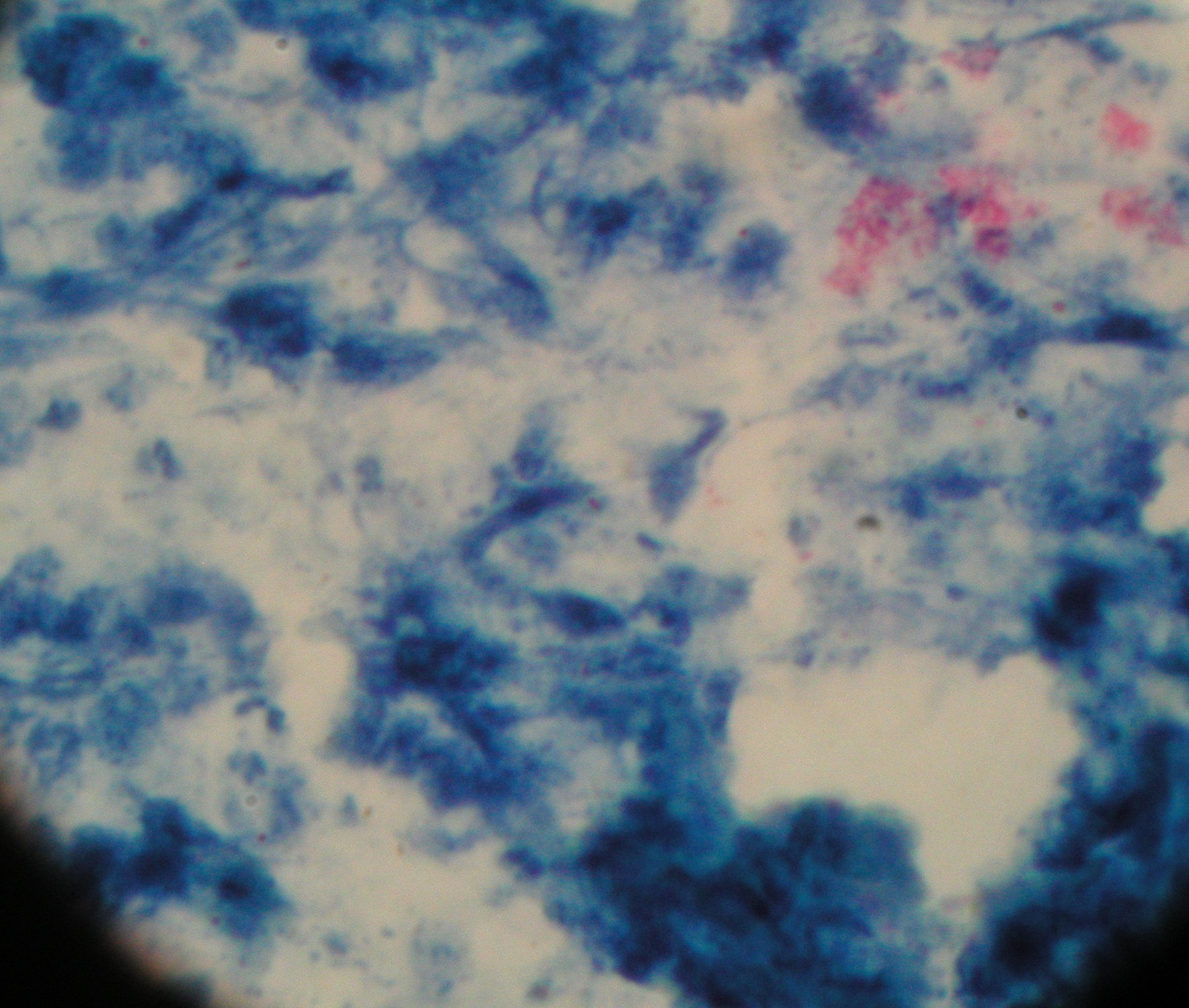
Metoda Ziehla - Neelsena : dla bakterii kwasoopornych ( w ścianie komórkowej mają dużo substancji woskowych i są
niewrażliwe na działanie kwasów i alkoholi) używa się fuksyny karbolowej i błękitu metylenowego
2. Nocardia asteroides - metoda Grama
Wyszukiwarka
Podobne podstrony:
Wskazwki do egzaminu praktycznego z mikrobiologii, 3 rok, mikrobiologia
Mikrobiologia egzamin praktyczny 11
Protokół egzaminu praktycznego, GUMed, Medycyna, Mikrobiologia, Mikrobiologia
Egzamin praktyczny Zadanie Nr 4
egzamin praktyczny 2007 komentarz
egzamin praktyczny i ustny, Medycyna ratunkowa, Pytania
kroplowy wlew dożylny, wytyczne 2010 - PRR, Rtwonictwo - egzamin praktyczny
FIZYKOTERAPIA EGZAMIN PRAKTYCZNY 2010, fizykoterapia, ~~FIZYKOTERAPIA
egzamin 2008 mikroby, Mikrobiologia, Pytania
Egzamin praktyczny 2003 Jesień opisy(1), RADIOLOGIA, RADIOLOGIA EGZAMIN
egzamin praktyczny 2007 - co nalezało zrobic, technik informatyk, praktyczny
2009 czerwiec zad 8 Egzamin praktyczny
Egzamin Praktyczny technik masażysta
EGZAMIN PRAKTYCZNY 12 2013 Mikro
egzamin praktyczny Służewski
2006 czerwiec zad 1 Egzamin praktyczny przykład rozwiązania
2013 czerwiec zad 2 Egzamin praktyczny
więcej podobnych podstron