Atom wodoru
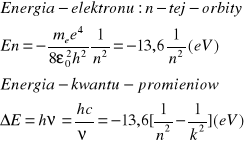
Orbitalny moment pędu elektronu w atomie
Wartość : l - orbitalna liczba kwantowa l = 0,1,2,3...(n-1)
![]()
Kierunek: Wektor orbitalnego momentu pędu nie może przyjąć dowolnej orientacji w przestrzeni, a jedynie taka dla której spełniony jest wzór![]()
![]()
- magnetyczna liczba kwantowa (-l, -(l-1),..(l-1),l
Spinowy moment pędu elektronu
Wartość:
s- spinowa liczba kwantowa (s = ½)
![]()
![]()
Kierunek: ms- magnetyczna spinowa liczba kwantowa
![]()
ms= ±1/2
Przyjmuje tylko 2 możliwe ustawienia, dla których rzut wektora na wybrany kierunek jest równy ![]()
Całkowity moment pędu elektronu w atomie
-Suma wektorowa orbitalnych i spinowych momentów pędu wszystkich elektronów
![]()
![]()
j- liczba kwantowa całkowitego momentu pędu
j= l±s = l±1/2
![]()
mj=-j, -j+1,…,j-1,j
Jz=rzut wektora całkowitego momentu pędu na kierunek z
Efekt Zemana- zjawisko rozprzestrzeniania się lini widmowych w obecności pola magnetycznego
Występuje rozszczepienie poziomów energetycznych opisywanych różna magnetyczną liczbą kwantową mj
Energia przesunięcia każdego podpoziomu jest proporcjonalna do ml i wprost proporcjonalna do pola magnetycznego ![]()
Energia przesunięcia każdego podpoziomu jest tym większa im większe przyłożymy pole magnetyczne.
Odległości pomiędzy obserwowalnymi liniami są proporcjonalne do pola magnetycznego.
![]()
poziom o mj = 0 nie ulega przesunięciu
Oddziaływanie spin-orbita (struktura subtelna)
Polega na oddziaływaniu magnetycznym miedzy spinowym i orbitalnym momentem magnetycznym, w skutek czego następuje rozszczepienie poziomów energetycznych atomie
![]()
- w wyniku oddziaływania między orbitalnym i spinowym momentem pędu pojawia się rozszczepienie poziomów energetycznych,
- stany s(l=0, j=s) nie ulegają rozszczepieniu
- im większa liczba kwantowa j tym wieksza energia stanu
- im mniejsza liczba kwantowa n tym wieksze rozszczepienie
- im wieksza liczba atomowa Z tym silniejsze rozszczepienie poziomów
Rezonans magnetyczny
Atomy wodoru składaja się z elektronu i protonu. Proton ład. e+ podobnie jak elektron posiada spin i sponowy moment magnetyczny: Jeżeli do materiału zawierającego atomy wodoru dostarczymy energii
![]()
to możemy spowodować odwrócenie spinu . Po pewnym czasie układ relaksuje emitując kwant promieniowania.
Zakaz Pauliego, budowa układu okresowego pierwiastków
Na powłoce n=2 może istnieć max 8 elektronów
Na powłoce n może 2n2
Na powłoce p(l=1)może max istnieć 6 bo 2(2l+1)
Na powłoce d(l=2) może istnieć maź 10 elektron
1s-2
2s-2
2p-6
3s-2
3p-6
3d-10
Gazy szlachetne maja całkowicie zapełnioną ostatnią powłokę elektronową.
Wiązania chemiczne
Kowalencyjne(H2, Cl2, F2,)powstaje przez uwspólnienie pary elektronów walencyjnych dzięki czemu atomy uzyskują konfiguracje najbliższą helowca.
Kowalencyjne spolaryzowane (HCL)Nierównomierne podzielenie pomiedzy atomami, elektrony spedzają wiecej czasu w pobliżu atomu bardziej elektro ujemnego.
Metaliczne( kryształ metaliczny) elektrony walencyjne są słabo związane i tworzą gaz elektronowy wspólny dla sąsiednich jonów dodatnich
Jonowe(NaCL, MgO,CaCl2,)Powstaje w skutek oddania jednego lub więcej elektronów walencyjnych do pierwiastka bardziej elektroujemnego.
Wodorowe(np. w DNA) powstaje miedzy atomem wodoru jednej molekuły a lekkim atomem elektroujemnym.
Van der Waalsa powstaje miedzy cząsteczkami polarnymi
Wiązanie Van der Waalsa powstaje między cząsteczkami obdarzonymi trwałym Momotem dipolowym.
Stany energetyczne cząsteczek, Ruch oscylacyjny i rotacyjny cząsteczek.
Największej dawki energi wymaga wzbudzenie elektronowe ∆Eel=10-18J -ruch oscylacyjny (wzbudzenie oscylacyjne) ∆Evib=10-20J,- ruchu rotacyjnego wzbudzenie rotacyjne ∆Eel=10-21J , -ruch translacyjny ∆Eel=10-40J Odległości pomiędzy stanami elektronowymi w cząsteczce są większe niż miedzy stanami oscylacyjnymi
W przybliżeniu oscylatora harmonicznego energia stanów oscylacyjnych jest wprost proporcjonalna do oscylacyjnej liczby kwantowej
![]()
n- oscylacyjna liczba kwantowa v- częstość drgań oscylatora
W przybliżeniu oscylatora harmonicznego odległości miedzy sąsiednimi poziomami oscylacyjnymi jest stała.
W opisie oscylacji uwzględniającym poprawkę na enharmoniczność odległości między sąsiednimi stanami energetycznymi zmniejszają się ze wzrostem oscylacji liczby kwantowej
W opisie rotacji cząsteczki dwuatomowej energia poziomu rotacyjnego zależy od rotacyjnej liczby kwantowej J![]()
J- rotacyjna liczba kwantowa 0,1,2...
B- stała rotacji danej molekuły
Stała rotacji B zależy od rozkładu masy atomów w cząsteczce
Odległość pomiędzy sąsiednimi poziomami rotacyjnymi ![]()
I wynoszą one kolejno 2B,6B,12B
Powstanie gałęzi P iR w widmie oscylacyjno- rotacyjnym wiążę się ze zmiana rotacyjnej liczby
o -1 i 1
Przewodnictwo elektryczne ciał stałych
Metale charakteryzują się dodatnim temperaturowym współczynnikiem oporu
Ze wzrostem temperatury opór elektryczny metali rośnie.
Dobremu przewodnikowi elektr towarzyszy dobra przewodność cieplna K/б=LT L- liczba Lorentza
![]()
Opór właściwy metali jest odwrotnie proporcjonalny do koncentracji elektronów n
Przewodność właściwa metali jest wprost proporcjonalna do koncentracji elektronów n
![]()
Zgodnie z funkcja Ferdiego-Diraca Przy danej temperaturze T obsadzony zostanie poziom energetyczny E: k-stała Boltzmana Ef - energia Ferdiego![]()
W niektórych metalach pasmo przewodzenia i pasmo walencyjne nakładają się
Półprzewodniki samoistne, domieszkowe, zjawiska na łączach, nadprzewodnictwo.
Pół-p samoistne Eg<2eV Pierwiastki z IV grupy Si Ge W niskich temperaturach elektrony związane są w pary i brak swobodnych nośników, więc zachowuja się jak Izolatory, po dostarczeniu energi w paśmie przewodnictwa pojawiaja się elektrony,a w walencyjnym dziury koncentracja dziur i elektronów jest sobie równa.
Pół-p Domieszkowe zawierają domieszkę pierwiastka z III i V grupyukł okresowego.
Pół-p typu n domieszkowany atom z grupy V nośnikami większościowymi SA elektrony w paśmie przenoszenia Ed<0,0eV 4 z elektronów walencyjne tworzą wiązania piąty jest wolny
Pół-p typu p domieszkowane atomy z grupy III
Atom akceptora tworzy 3 wiązania kowalencyjne 4-te wiązanie jest nie wysycane powstaje dziura. Nośnikami są dziury w paśmie walencyjnym.
Pół-p p-n połączenie p”+” n”-„ obniżenie bariery potencjału w porównaniu ze stanem równowagi i zwiększenie prądu dyfuzji. Połączenie p”-„ n”+” zwiększenie bariery potencjału w porównaniu ze stanem równowagi i zmniejszenie prądu dyfuzji.
Charakterystyka prądowo-napięciowa diody: WYKRESY. 3.8.3 Dioda świecąca (LED) *na złączu p-n elektron z pasma przewodnictwa rekombinuje z dziurą z pasma walencyjnego; uwalnia się przy tym energia rowna wielkości przerwy energetycznej Eg *energia ta może rozchodzic się w postaci drań w sieci (w krysztalkach Si i Ge) lub wyemitowanego kwantu promieniowania (w krysztalkach GaP, GaAs) λ=hc/Eg,
W pół przewodnikach pasmo przewodzeni jest oddalone od pasma walencyjnego o mniej niż <2eV
W kryształach półprzewodnikowych dominują wiązania kowalencyjne
Domieszka atomu V grupy ukł. okresowego w półprzewodniku zwiększa przewodnictwo elektryczne
W złączu p-n obszar zubożony powstaje w pobliżu powierzchni kontaktujących się półprzewodników
W złączu p-n obszar zubożony powstaje w wyniku rekombinacji nośników z atomami drugiego półprzewodnika.
W obszarze zaburzonym jest bardzo mała ilość nośników swobodnych.
W obszarze zaburzonym wytwarza się kontaktowa różnica potencjałów hamująca przepływ nośników w obu kierunkach
Kontaktowa różnica potencjałów hamuje wszystkie nośniki.
W stanie równowagi złącza prąd dryfu i prąd dyfuzji równoważą się.
Polaryzacje przewodzenia złącza uzyskamy
przy podłączeniu bieguna dodatniego źródła do półprzewodnika typu p, a ujemnego do typu n
Przy zaporowej polaryzacji złącza prąd jest mały i w niewielki stopniu zależy od napięcia.
W diodzie LED w skutek przepływu prądu jest wyemitowany kwant promieniowania. W diodzie LED w skutek rekombinacji elektron-dziura zostaje wyzwolony kwant promieniowania o długości fali hc/Eg h stała Planca c prędkość światła Eg-wielk. Przerwy energetycznej
Zjawisko nadprzewodnictwa polega na gwałtownym wzroście przewodnictwa materiału w niskich temperaturach.
Przejście metalu w stan nadprzewodnictwa zachodzi poniżej pewnej temperatury krytycznej i nie zależy od pola magnetycznego na powierzchni metalu.
Struktura jadra atomowego.
Jądro atomowe jest opisane przez A- liczbę masową i Z liczbę atomową
A- liczba nukleonów w jądrze(protony+neutrony)
Z- liczba protonów w jądrze
N- liczba neutronów w jądrze N=A-Z
Efektywny promień jądra atomowego r=r0A1/3=![]()
Im bardziej N>Z tym mniej stabilny pierwiastek
W rzeczywistości masa jądra M jest mniejsza niż suma mas wszystkich nuklidów Mc2<∑mc2,
Różnica między rzeczywista masa jądra atomowego a suma mas wszystkich nuklidów w jądrze jest zawsze ujemna.Energia wiązania różnica między energią spoczynkową i sumą poszczególnych nukleonów ∆Ew= ∑mc2- Mc2
Energia wiązania na nukleon ∆Ew n=∆Ew /Ajest największa w przypadku pierwiastków o średniej masie.
Im większa przewaga neutronów nad protonami tym jądro bardziej stabilne.
Promieniotwórczość naturalna
Rozpad alfa - samorzutna przemiana jadra, któremu towarzyszy emisja cząstki alfa czyli jadra helu![]()
Rozpad ten związany jest z procesem tunelowania cząstki alfa przez barierę potencjału. W rozpadzie alfa spełnione jest prawo zachowania liczby masowej i prawo zachowania ładunku.
Rozpad beta - samorzutna przemiana jądra w jądro o liczbie atomowej Z+1 czemu towarzyszy emisja elektronu beta + lub pozytonu beta -
W rozpadzie beta następuje samorzutna emisja pozytonu lub elektronu z jądra atomowego.
![]()
dla beta -
![]()
dla beta +
Promieniowanie gamma polega na emisji promieniowania gamma z jądra w stanie wzbudzonym, w wyniku czego jadro przechodzi do stanu podstawowego lub stanu wzbudzonego o niższej energi.
Pochłanianie i detekcja promieniowania
Współczynnik absorpcji promienowania dI=-µIdx
Współ masowy absorpcji promieniowania µm=µ/p
Najsilniej absorbowane promieniowanie przez materie to promieniowanie alfa.
Napięcie na liczniku Ge-Mull wybierane jest tak by liczba zliczeń nie zależała od napięcia
Człowiek o masie 80kg prześwietlony Rtg(WSB=1) otrzymał dawkę 0.25mSv=0,01J
1Gy(grej)=1J/kg=100rad
1Sv(siwert)=100rem=1Gy*WSB
Detekcja promieniowania odbywa się zazwyczaj na podstawie procesów pochłaniania promieniowania: Detektory śladowe -obserwacja torów (śladów) cząstek np. komora Wilsona -detektor jonizacyjny -rejestracja sygnału elektrycznego np. komora jonizacyjna , licznik Geigera-Millera detektory scyntylacyjne i fluorescencyjne - przejście naładowanej cząstki przez scyntylator wywołuje błysk światła.Komora Wilsona szklana komora zawierajaca parę nasyconą zamknięta ruchomym tłokiem, przez gwałtowne odsunięcie tłoka uzyskujemy spadek temp i ciśnienia para przechodzi w stan przesycenia cząstka promieniowania przelatując przez komore jonizuje ośrodek na jonach skrapla się para pozostawiając ślad przy urzyciu pola magnetycznego można wyznaczyć ładunek i energię cząstki Datowanie węglem wykorzystuje się przyswajanie przez organizm izotopu węgla C-14 który stanowi stałą część wegla atmosferycznego .po obumarciu proces przyswajania ustaje a C-14 stopniowo zanikana drodze rozpadu promieniotwórczego, polega to na pomiarze proporcji C-14 do całego wegla zawartego w organizmie.
Reakcje jądrowe
Reakcja rozszczepienia zachodzi głównie w przypadku jąder ciężkich
Energia wyzwolona w pojedynczym procesie symetrycznego rozszczepienia jadra Mo (energia wiązania na nukleon substratu i produktu wynoszą odpowiednio8,7i 8,8 MeV10MeV
Kryterium Lawsonia dla reakcji deutero-trytowej dane jest nierównością n τ >1020s/m3 gdzie n- gęstość plazmy τ- czas utrzymania wysokiej koncentracji plazmy.
Wyszukiwarka
Podobne podstrony:
Stale odporne na korozję, PG, Mechaniczny, sem7
nowoczesne materialy konstrukcyjne, PG, Mechaniczny, sem7
Fizyka - Test, PG Zarządzanie (Semestr 1), fizyka
Stale odporne na korozję, PG, Mechaniczny, sem7
Fizyka II s. Elektrostatyka 2, mechanika, BIEM- POMOCE, laborki z fizy, moje, laboratorium z fizyki,
Przysposobienie biblioteczne, Fizyka Techniczna PG, Semestr 1
Ocen stanu zdrowia i badania fizykalne test, badania fizykalne
Wyznaczanie gęstości cieczy, Weterynaria Lublin, Biofizyka , fizyka - od Bejcy, Mechanika
AGH e-Fizyka 04 Fale mechaniczne, Fizyka i Fizyka chemiczna
Fizyka - Teoria, PG Zarządzanie (Semestr 1), fizyka
,fizyka 1, Stany równowagi mechanicznej
TEST PG 6 lutego 2009 PIŁA, POLITOLOGIA PRACA SOCJALNA
badania fizykalnetyty, BADANIA FIZYKALNE - TEST
Fizyka test 1, Studia, pomoc studialna, Fizyka- sprawozdania
wyznaczanie modułu Younga11, Weterynaria Lublin, Biofizyka , fizyka - od Bejcy, Mechanika
BADANIA FIZYKALNE test, Badania fizykalne
więcej podobnych podstron