Budowa cząsteczek:
Teoria wiązań chemicznych:
1.Teoria elektronowa Lewisa i Kosela
2.Teoria orbitali molekularnych.
3.Teoria wiązań walencyjnych.
4.Teoria pola ligandów
5.Teoria pola krystalicznego
1)Teoria elektronowa Lewisa Kosela:
punkt wyjścia:
-bierność chemiczna gazówszlachetnych
-Konfiguracja elektronowa typu ns2p6 lub dwuelektronowa typu ns2 (Dublet)
Hipoteza:Atomy pierwiastków łączą się ze sobą(tzn. tworzą cząsteczki) czyli układ przyjmuje konfiguracje gazu szlachetnego.
Rodzaje wiązań chemicznych:
1. Jonowe
2. Kowalencyjne
-atomowe
-atomowe spolaryzowane
-koordynacyjne(donorowo-akceptorowe) (semipolarne)
3.Metaliczne (oddziaływania międzycząsteczkowe)
-wiązania wodorowe
-siły van der Waalsa
1) Wiązania jonowe:
ΔE >1,7. Atomy dwóch łączących się pierwiastków uzyskują konfigurację elektronową gazów szlachetnych w wyniku utraty elektronów pierwiastków elektrododatnego na rzecz atomów pierwiastków elektroujemnego. Wytworzone jony -dodatnie i ujemne-przyciągają się dzięki siłom elektrostatycznym tworząc w przypadku ciał stałych uporządkowaną strukturę zwaną siecią przestrzenną.
Związki jonowe:
-wysoka temp. topnienia
-w warunkach normalnych ciała stałę
-w stanie stałym nie przewodzą prądu elektrycznego
w roztworach:
-porozpuszczeniu w wodzie,
-po stopieniu
2. Wiązanie kowalencyjne
a) atomowe ΔE= 0-0,4:
Atomy tworzące cząsteczkę wykazują taką samą tendencje do przyjmowania i oddawania elektronów-konfiguracja gazów szlachetnuch uzyskiwana jest przez wytworzenie jednej, dwóch, trzech wspólnych par elektronowych.
Pola wolnych par elektronowych inne niż w parach tworzących wiązanie
b) atomowe spolaryzowane ΔE = 0,4-1,7
Atomy tworzące wiązanie wykazują zbliżoną tendencję do przyjmowania i oddawania elektronów. Konfiguracja gazów szlachetnycj uzyskiwana przez tworzenie jednej lub więcej par elektronowych. Przesunięcie pary elektronowej(polaryzacja wiązania) w stronę atomów pierwiastka bardziej elektroujemnego.
c) Wiązanie koordynacyjne.
Wspólna para elektronów pochodzi od jednego atomu, najczęściej: w związkach komplekspwych, kwasach tlenowych i ich anionach(np. Cu(NH3)42+ , H2SO4, Co(H2O)42+)
Związki kowalencyjne:
-niskie temp. wrzenia i topnienia,
-w warunkach normalnych ciecze i gazy
-w stanie stałym nie przewodzą prądu elektrycznego.
-w roztworach to słebe elektrolity-słabo przewodzą prąd elektryczny
3.Wiązanie metaliczne
Kryształy metaliczne-uporządkowane przemiennie jony dodatnie(kationy) i swobodnie poruszające sięelektrony(gaz elektronowy)
Wiązanie metaliczne-pozostające w równowadze elektrostaty kationy-elektrony
Gaz elektronowy-utworzony z elektronów walencyjnych
-ns-w mtalach grup głównych
-ns:(n-1)d - w kryształach metali grup pobocznych
Metale i stopy:
-wysoka temp. topnienia
-w warunkach normalnych ciałą stałe(wyjątek Hg)
-dobre przewodnictwo elektryczne i cieplne
-ciągliwe, kowalne
-połysk
Struktury ponadoktetowe:
PCl5, SF6
I teoria elektronowa Lewisa i Kosela
1) wprowadziła pojęcia wiązania jonowego i kowalencyjnego
2) Teoria jakościowa nie wyjaśnia kierunkowego charaktery wiązań kowalencyjnych np. H2O, CaCl2(budowa liniowa, płaska, przestrzenna)
3) Nie przewiduje siętworzenia innych związków niż wynikające w reguły oktetu.
4)W bardziej ogólny sposób zagadnienie wiązań chemicznych opisuje mechanika kwantowa.
3.Wiązanianiekowalencyjne-oddziaływania międzycząsteczkowe(molekularne), różnia się: geometrią, siłą, specyficznością.
a)Wiązanie wodorowe:
-wiązanie elektrostatyczne typu pośredniego R1X-H...YR2, gdzie X i Y to atomy N,O, F, lub innych pierwiastków elektroujemnych.
-bezpośrednim ogniwem łączącym dwie cząsteczki (lub jony o tym samym znaku) jest atom(jon) wodoru
-wodór w wiązaniach otoczony jest zawsze dwoma parami elektronowymi
-silniejsze od wiązań wan der Waalsa, słabsze od kolwalencyjnych [energia wiązania 12,6-29,3 kJ/mol]
-posiada ściśle ukierunkowany charakter(najczęściej 3 atomy:donor wodoru-wodór-akceptor wodoru leżą w jednej linii)
-długość wiązań (nm)
0,270 (O-H...O)
0,288 (O-H...N)
0,310(N-H...N)
-potwierdzenie doświadczalne wiązania m.in. - wysoka temp. wrzenia i topnienia(np. dla NH3, H2O, HF)w porównaniu w wodorkami innych homologów azotu, tlenu, fluoru; - odchylenie od prawa Raulta,
- IR
Asocjacja-łączenie się związków chemicznych za pomocą wiązań chemicznych.
b) Wiązenie van der Waalsa(siły van der Waalsa):
-niespecyficzna siła przyciągania pojawiająca się kiedy 2 atomy zbliża się na odległość ok. 0,3-0,4 nm.
-trzy rodzaje oddziaływań sił van der Waalsa:
1)Oddziaływanie w wyniku orientacji dipoli trwałych w cząsteczkach(HF, H2O)
2)Oddziaływanie wzajemne dipoli indukowanych na skutek zbliżania się jonu lub cząsteczki dipolowej do cząsteczki obojętnej.
3)Oddziaływanie(przyciąganie się) szybkozmiennych, falujących dipoli na skutek ruchu elektronów walencyjnych (siły dyspersyjne)
-słabsze i mniej specyficzne jak wiązanie wodorowe (i wiązanie chemiczne)
-skuteczność wiązania zależy od komplementarnośći przestrzennej cząsteczek(kształty cząsteczek są do siebie dopasowane)
- w wodzie np.główny udział dipoli trwałych, mniejszy sił dyspersyjnych (~19%), bardzo mały indukowanych dipoli(~4%)
-w benzynie, parafinie-przede wszystkim siły dyspersyjne
Momenty dipolowe:
-wszystkie cząsteczki z wiązaniami pośrednimi(kowalencyjne spolaryzowane, koordynacyjne) są dipolami.
-biegunowość cząsteczki określa elektryczny moment dipolowy (μ=q*l ; q-ładunek bezwzględnt jednego z biegunów, l- odległość łądunków.)
μ=[C*m, kulombometr]; [D, Debaj, jednostka pozaukładowa, 1D=3,333*10-30 C*m]
Cząsteczka niepolarna(apolarna) gdy moment dipolowy=0
Kwantowe teorie wiązania chemicznego:
2.Teoria orbitali molekularnych(cząsteczkowych)
Cząsteczka-układ złożony z atomów np. AB=A+B
1.Stan każdego z atomów-w stanie podstawywym przed utworzeniem cząsteczki-opisany funkcjami falowymi ψA, ψB
2.Po zbliżeniu się atomów do siebie na odpowiednią odległość każde z jąder działa przyciągająco na elektrony ze wszystkich atomów powodując: -przemieszczanie się,-nałożenie ich chmur elektronowych
3.Elektrony atomów tworzących cząsteczkę stają się nierozerwalne tworząc jeden wspólny orbital molekularny(cząsteczkowy) obejmujący wszystkie jądra atomowe.
4.Orbital molekularny jest liniową kombinacją orbitali atomowych.
ψAB= CA*ψA+Cb*ψB
Warunki tworzenia się orbitali atomowych:
1. muszą mieć porównywalną energię.
2. Muszą się nakłądać, im pokrywanie pełniejsze, tym wytworzone wiązania są mocniejsze.
3. Muszą wykazywać taką samą symetrię w stosunku do osi łączącej jądra cząsteczki.
Liczba tworzących się orbitali molekularnych jest równa liczbie nakłądających się orbitali atomowych: np. z nałożenia się 2 orbitali atomowych powstają 2 orbitale molekularne:
-wiążący ψAB+ o energii niższej
-antywiążący ψAB- o energii wyższej
z nałożenia się 3 orbitali atomowych powstają 3 orbitale molekularne:
-wiążący, -antywiążący, -niewiążący.
Typy orbitali molekularnych(wiązań)
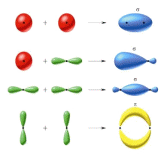
Rzad wiązania(RW)-liczba par elektronów na orbitalach wiążących minus(-) liczba par elektronów na orbitalach antywiążących lub RW=1/2(liczba elektronów na orbitalach wiążących - liczba elektronów na orbitalach antywiążących)
Cząsteczki homojądrowe(diagramy energetyczne dla H2,O2, N2,F2, CO)
3.Teoria wiązań walencyjnych-utworzenie wiązania chemicznego obejmuje kilka etapów w tym:
1)wzbudzenie atomu(m.in. rozparowywanie elektronów)
2)tworzenie się nowych orbitali tzw. zhybrydyzowanych(wymieszanych) przez kombinacje orbitali atomowych.
Powstające orbitale zhybrydyzowane posiadają: - jednakową energię i kształt, - określony kierunek przestrzenny.
3)Nakładanie się orbitali zhybrydyzowanych z innymi orbitalami (atomowymi, zhybrydyzowanymi) prowadzące do utworzenia się orbitalu molekularnego(cząsteczkowego) tj.wiązanie chemiczne σ, π
Wyszukiwarka