Imię i nazwisko: Łukasz Chłopczyński
Wydział : Biotechnologii i nauk o żywności
Kierunek : Biotechnologia
Grupa : IV
Ćwiczenie nr 31
Tytuł ćwiczenia: Wyznaczanie izotermy mieszania trzech cieczy.
Data wykonania ćwiczenia....................
Data oddania sprawozdania..................
Data zwrotu sprawozdania....................
Data ponownego oddania sprawozdania..............
Wstęp teoretyczny:
Rozpatrzmy układ trzech składników ciekłych, z których dwa wykazują ograniczoną rozpuszczalność wzajemną, np. woda i toluen, natomiast trzeci składnik, np. metanol lub aceton, rozpuszcza się w każdym z nich bez ograniczeń. Rozpatrywany układ trzech składników może być układem ciekłym dwufazowym lub jednofazowym, w równowadze z fazą gazową. Stan układu określają parametry intensywne: ciśnienie, temperatura, ułamki molowe składników w fazach gazowej i ciekłych.
W stałej temperaturze i pod stałym ciśnieniem najlepszym sposobem przedstawienia diagramu równowagi ciecz-ciecz w układzie trójskładnikowym jest trójkąt równoboczny, zwany trójkątem stężeń Gibbsa-Roosebooma, przedstawiony na poniższym rysunku.
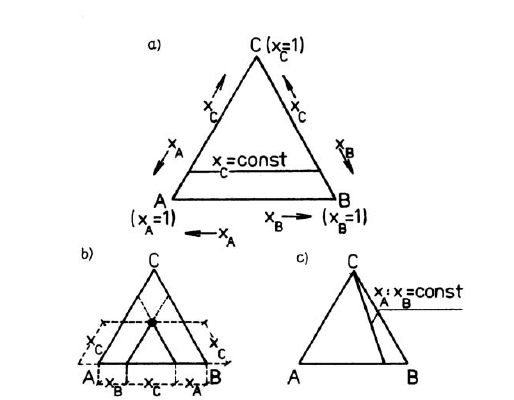
Wierzchołki trójkąta odpowiadają czystym składnikom A, B i C. Punkty leżące na bokach trójkąta określają skład układów dwuskładnikowych: A+B, A+C oraz B+C. Współrzędne dowolnego punktu, leżącego wewnątrz trójkąta, określają skład układu trójskładnikowego, jak pokazano na rysunku b). Linia równoległa do boku trójkąta, jak pokazano na rysunku a), odpowiada układowi o stałej zawartości składnika. Linia łącząca wierzchołek trójkąta z punktem leżącym na przeciwległym boku trójkąta, jak pokazano na rysunku c), reprezentuje wszystkie układy, o stałym stosunku ułamków molowych dwóch składników.
Układ – jest to ciało lub zespół ciał poddawanych obserwacji.
Faza – część układu jednolita fizycznie i oddzielona od innych części wyraźną powierzchnią rozdziału.
Składnik – jest to każde indywiduum chemiczne tzn. zbiór wszystkich substancji, niezależnie od stanu skupienia, których cząsteczki składają się z tych samych rodzajów atomów połączonych ze sobą w takich samych stosunkach.
Liczba stopni swobody – liczba parametrów układu, które można dowolnie dobrać nie naruszając w nim równowagi fazowej.
Reguła faz Gibasa:
Równowaga
fazowa jest to równowaga termodynamiczna, polegająca na
współistnieniu ze Sobą co najmniej dwóch faz jednego lub kilku
składników. Rozważmy układ złożony z
 składników i
składników i
 faz w którym nie zachodzi reakcja chemiczna. Podstawy teoretyczne
równowagi fazowej oparte są na założeniach.
faz w którym nie zachodzi reakcja chemiczna. Podstawy teoretyczne
równowagi fazowej oparte są na założeniach.
-
stan układu określają: ciśnienie – p, temperatura – T, i ułamki molowe każdego składnika w poszczególnych fazach. Liczba tych ułamków wynosi
 (co z „p” i „T” daje ogólną liczbę parametrów
(co z „p” i „T” daje ogólną liczbę parametrów
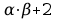 ).
). -
układ znajduje się w stanie równowagi termodynamicznej, a zatem w każdej części układu T i p – const.
Termodynamika wskazuje, że w takim układzie pot. chem. ui dowolnego składnika „i” jest równy we wszystkich fazach.
ui(1) = ui(2) = ui(B)
ui =ui▼ + RT axi
gdzie ui▼ = f(p,T) axi = fxi ∙ xi
Ponieważ potencjał st. ui▼ składnika „i” jest różny w poszczególnych fazach, ułamki molowe xi i aktywność axi muszą mieć takie wartości aby spełnione były zależności ui(1) = ui(2) = ui(B).
Oznacza
to, że dobierając xi(1)
w pierwszej fazie ułamki tego składnika w pozostałych fazach
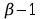 są ściśle określone. Dla
są ściśle określone. Dla
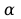 składników liczba tak określonych ułamków wynosi
składników liczba tak określonych ułamków wynosi
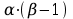
Równanie Clausiusa – Clapeyrona:
Jeżeli
układ zawiera jeden składnik nie reagujący chemicznie
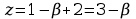 ,
więc w stanie równowagi mogą być 2 lub 3 fazy. Gdy mamy układ
dwufazowy ułamek molowy składnika „i” w każdej fazie jest
stały i jest wielkością niezmienną. Stan układu określa więc
ciśnienie p i temp T. Ponieważ
,
więc w stanie równowagi mogą być 2 lub 3 fazy. Gdy mamy układ
dwufazowy ułamek molowy składnika „i” w każdej fazie jest
stały i jest wielkością niezmienną. Stan układu określa więc
ciśnienie p i temp T. Ponieważ
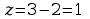 zatem jeden z 2 parametrów p lub T można dobrać dobrowolnie, a
drugi przybierze wartość zależną od pierwszego wynikającą z
praw równowagi termodynamicznej. Oznacza to, że obie wartości (p i
T) są od siebie zależne.
zatem jeden z 2 parametrów p lub T można dobrać dobrowolnie, a
drugi przybierze wartość zależną od pierwszego wynikającą z
praw równowagi termodynamicznej. Oznacza to, że obie wartości (p i
T) są od siebie zależne.
f(p,T) = 0 ; matematycznym wyrazem tej funkcji jest równanie C-C.
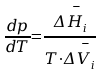
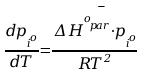
Gdzie
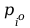 -
ciśnienie pary nasyconej przy czym
-
ciśnienie pary nasyconej przy czym
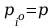 .
Gdy
.
Gdy
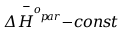
Po rozdzieleniu zmiennych i scałkowaniu :
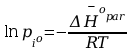 jak
widać
jak
widać
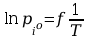
Gdzie
współczynnik kierunkowy -
Wyszukiwarka