TEST: Roztwory (wersja II)
1. Wpisz w odpowiednich miejscach grafu określenia: roztwór właściwy, roztwór nasycony, roztwór nienasycony, roztwór rozcieńczony.
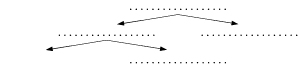
Od góry roztwór właściwy, od lewej pośrodku roztwór nienasycony, roztwór nasycony, na dole roztwór rozcieńczony
2. Korzystając z wykresu rozpuszczalności substancji, określ, ile gramów KCl należy rozpuścić w 100 g wody
w temperaturze 70ºC, aby otrzymać roztwór nasycony.
W 70stopniach rozpuszczalność wynosi 50g/100g H2O
3. W gospodarstwie domowym stosuje się ocet, czyli 10-procentowy roztwór kwasu octowego. Oznacza to, że:
a) w butelce znajduje się 10 g kwasu octowego;
b) 10 g kwasu octowego znajduje się w 0,5 dm3 wody;
c) 10 g kwasu octowego znajduje się 100 g roztworu;
d) 10 g kwasu octowego znajduje się w 100 g wody.
Odpowiedz:C
4. Które z niżej podanych stwierdzeń są prawdziwe?
a) Rozpuszczalność gazów maleje wraz ze wzrostem temperatury.
b) Rozpuszczalność substancji wzrasta wraz ze wzrostem szybkości mieszania roztworu.
c) Rozpuszczalność substancji wzrasta wraz ze stopniem rozdrobnienia substancji.
d) Rozpuszczalność substancji zależy od rodzaju substancji.
e) Rozpuszczalność substancji nie zależy od temperatury.
f) Rozpuszczalność ciał stałych zwykle wzrasta wraz ze wzrostem temperatury.
Prawdziwymi zdaniami są: a,d,f.............................................
5. W 0,4 dm3 roztworu znajduje się 80 g siarczanu(VI) miedzi(II). Oblicz stężenie molowe roztworu.
Mmol CuSO4 = 160g /mol
80g to 0,5 mola
Cm=n/V
Cm=0,5mol/0,4 dm3
Cm=1,25mol/dm3
6. Korzystając z wykresu rozpuszczalności substancji, uzupełnij zdania.
a) W 100 g wody w temperaturze 70ºC znajduje się ....140g......... KNO3.
b) Jest to roztwór ...............nasycony.................. .
c) Jeśli roztwór ten ogrzejemy do 80ºC, to ..........będzie nienasycony.......................................................... .
d) Jeśli roztwór składający się ze 100 g wody i 110 g KNO3 oziębimy z 60ºC do 40ºC,
to ................................................nastąpi krystalizacja nadmiaru soli....................................................................... .
7. Oblicz, ile kilogramów soli pozostanie po odparowaniu do sucha 50 kg wody morskiej, jeżeli zawartość soli
w wodzie morskiej wynosi 3,5%.
Mr=50kg=50000g
Cp=3,5%
MS(masa soli po odparowaniu)=C% * mr / 100% = 1750g
8. Wyjaśnij pojęcie „stężenie molowe” roztworu.
wikipedia
9. Oblicz i wyjaśnij, czy po zmieszaniu 100 cm3 wodnego roztworu chlorowodoru o stężeniu 0,1
oraz 200 cm3 roztworu wodorotlenku wapnia o stężeniu 0,1 otrzymamy roztwór obojętny, kwasowy
czy zasadowy.
n-liczba moli
n HCl = V * Cm = 0,1dm3 * 0,1ol/dm3 = 0,01mol
n Ca(OH)2 = 0,02mol
Ca(OH)2 + 2 HCl = CaCl2 + 2 H2O
z równania wynika że Ca(OH)2 jest więcej moli i roztwór będzie zasadowy
10. Podaj definicję roztworu właściwego.
wikipedia
11. 40 g Pb(NO3)2 rozpuszczono w 160 g wody. Oblicz stężenie procentowe tak otrzymanego roztworu.
C%= MS/mr )100% =
Mr=MW + MS= 160 + 40=200
C%=20%
12. Co należy zrobić, aby dokonać przemian?
![]()
Podaj dwa sposoby dokonania przemiany I i dwa sposoby dokonania przemiany II.
I przemiana
.........oziębić układ lub dodać soli...................
II przemiana
............podgrzać układ lub dolać rozpuszczlnika.......................
13. Oblicz stężenie procentowe 1,25-molowego roztworu NaOH. Gęstość roztworu wynosi 1,02 .
C%= 100%*Mmol*Cm/d
D=1,02g/cm3=1020g/dm3
Mmol=40g/mol
C%=4,9%
14. Zmieszano 2 dm3 roztworu o stężeniu 2 z 500 cm3 roztworu o stężeniu 1 .
Oblicz stężenie molowe tak otrzymanego roztworu.
n1=2dm3*2 mol/dm3= 4mol
n2=0,5mol
n=n1+n2
n=4,5mol
V=2dm3+0,5dm3=2,5
Cm=n/V
Cm=1,8mol/dm3
15. W tabeli podano wartości rozpuszczalności gazów w wodzie w różnych temperaturach.
Gaz
|
Rozpuszczalność [ ]
|
||||
|
0ºC |
20ºC |
40ºC |
60ºC |
80ºC |
CO2 |
0,335 |
0,167 |
0,097 |
0,058 |
0,027 |
O2 |
0,007 |
0,004 |
0,003 |
0,002 |
0,001 |
SO2 |
29,60 |
10,60 |
5,54 |
3,25 |
2,13 |
Na podstawie danych z tabeli:
a) określ, jak zmienia się rozpuszczalność gazów wraz ze wzrostem temperatury;
b) wyjaśnij, którego z gazów, CO2 czy SO2, jest więcej w kwaśnych deszczach;
c) narysuj wykres zależności rozpuszczalności tlenu od temperatury.
A maleje
B SO2
C http://www.chemia.dami.pl/gimnazjum/gimnazjum7/woda3.htm
16. Do 30 g 20-procentowego roztworu kwasu siarkowego(VI) dodano 20 g wody.
Oblicz stężenie procentowe tak otrzymanego roztworu.
MS=c%* mr/100 =30 * 20/100=6g
MW=24g +20g=44g
C%=12%
roztwór stężony
mol
dm3
mol
dm3
roztwór
nienasycony
roztwór
nasycony
g
cm3
mol
dm3
mol
dm3
g
100 g H2O
Wyszukiwarka
Podobne podstrony:
2584
2001 12 19 2584 Council
2584
2584
więcej podobnych podstron