Wstęp teoretyczny
Elektroliza - rozkład elektrolitu pod wpływem prądu stałego przepływającego przez elektrolizer. Pojęcie to obejmuje wszystkie zjawiska związane z tym procesem, a zatem:
właściwą reakcję elektrochemiczną zachodzącą na elektrodach metalicznych i związaną z przeniesieniem ładunku,
transport jonów do i od powierzchni elektrody,
wtórne reakcje chemiczne zachodzące w pobliżu elektrody.
PRAWA ELEKTROLIZY FARADAYA:
Masy substancji wydzielonych na elektrodach (lub ilość substancji, która uczestniczyła w reakcji elektrochemicznej) w czasie elektrolizy są proporcjonalne do wartości ładunku przepływającego przez roztwór:
m = k · Q = kIt ,
gdzie: m to masa substancji wydzielonych na elektrodzie (w gramach), Q - ładunek elektryczny (w kulombach), I - natężenie prądu (w amperach), t - czas elektrolizy (w sekundach), k - współczynnik proporcjonalności, nazywany równoważnikiem elektrochemicznym danej substancji - jest to masa substancji wydzielona na elektrodzie przez ładunek 1C, czyli przez prąd o natężeniu 1A w ciągu 1s.
Jednakowe ładunki elektryczne wydzielają na elektrodach z różnych elektrolitów masy substancji m proporcjonalne do M / z:
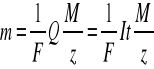
![]()
,
gdzie: F to współczynnik proporcjonalności, nazywany stałą Faradaya, która wynosi 96486,70 ± 0,5 C(A·s), M - masa molowa substancji, z - liczba elektronów biorących udział w elementarnym procesie elektrodowym. [1]
ELEKTRODA (PÓŁOGNIWO) - układ złożony z dwóch faz przewodzących, z których jedną jest metal lub inny stały przewodnik, a drugą jest elektrolit. Potencjał elektrody jest ściśle związany z powstawaniem podwójnej warstwy elektrycznej na granicy faz elektroda/elektrolit. [2]
Siła elektromotoryczna ogniwa zmienia się wraz ze zmianą aktywności jonów. Zależność potencjału półogniwa od aktywności elektrodowo czynnych jonów wyraża RÓWNANIE NERNSTA:
![]()
w którym E to potencjał elektrody, E0 - standardowy potencjał elektrody, R - stała gazowa (8,314 J · K-1 · mol-1), T - temperatura [K], z - wartościowość jonu, F - stała Faradaya (9,64846 · 104C · mol-1), ln a = 2,303 log a. [3]
[1] Walenty Szczepaniak „Metody instrumentalne w analizie chemicznej”
Wydawnictwo Naukowe PWN Warszawa 1996 Strona 207
[2] Walenty Szczepaniak „Metody instrumentalne w analizie chemicznej”
Wydawnictwo Naukowe PWN Warszawa 1996 Strona 173
[3] Walenty Szczepaniak „Metody instrumentalne w analizie chemicznej”
Wydawnictwo Naukowe PWN Warszawa 1996 Strona 179
Opracowanie wyników
Masa katod przed elektrolizą :
m1 = 15,13155 g
m2 = 15,25530 g
m3 = 15,06400 g
Masa katod po elektrolizie :
M1 = 15,18255 g
M2 = 15,30460 g
M3 = 15,11335 g
Obliczenie masy wydzielonej miedzi :
M1 - m1 = 15,18255 g - 15,13155 g = 0,0510 g
M2 - m2 = 15,30460 g - 15,25530 g = 0,0493 g
M3 - m3 = 15,11335 g - 15,06400 g = 0,0494 g
Wydajność elektrolizy obliczamy ze wzoru:
masa wydzielonej miedzi
W = · 100 %
Masa miedzi w badanym roztworze
Masa CuSO4 · 5H2O = 249,5 g
Szkiełko 28,18130 g
Szkiełko z naważką 29,18500 g
Siarczan 1,0037 g
Obliczenie masy Cu w roztworze :
1 g CuSO4 · 5H2O - 100 ml
x g CuSO4 · 5H2O - 20 ml
----------------------------------------
x = 0,2 g CuSO4 · 5H2O
0,2 g CuSO4 · 5H2O - 249,5 g
x g Cu - 64,5 g Cu
-----------------------------------------
x = 0,0517 g Cu
![]()
![]()
![]()
3
Wyszukiwarka
Podobne podstrony:
2919
MED CW 7 PLC S7 swiatla id 2919 Nieznany
2919
2919
2919
2919
2919
zapadalność na choroby zakaźne 1 I 15 X 2919 2020
więcej podobnych podstron