W przeciwieństwie do termodynamiki procesów odwracalnych, która zajmuje się stanami układów niezmiennymi w czasie i ustala warunki równowagi wyłącznie z energetycznego punktu widzenia, kinetyka reakcji chemicznych zajmuje się zmianami zachodzącymi w układach w czasie i bada szybkości, z jakimi układy te zbliżają się do stanu równowagi. W kinetyce, reakcje klasyfikuje się na podstawie liczby cząsteczek (atomów, jonów, rodników) uczestniczących w elementarnej przemianie chemicznej czyli cząsteczkowości reakcji oraz na podstawie liczby substancji, których stężenia lub ciśnienia cząstkowe decyduj ąo szybkości procesu czyli rzędowości reakcji
Szybkość reakcji definiuje się zas pomocą pochodnych stężenia substratu lub produktu względem czasu:
![]()
(1)
gdzie:
v- szybkość reakcji
c- stężenie substratu
x- stężenie produktu
t- czas, w którym przereagowała część substratu lub powstała pewna część produktu
Szybkość reakcji jest funkcją stężenia poszczególnych reagentów: A, B, C.... Jeżeli reakcja jest z założenia jednokierunkowa i biegnąca do końca, to jej szybkość można wyrazić równaniem:
v = k[A]a[B]b[C]c….
(2)
Współczynniki potęgowe a, b, c są charakterystyczne dla danej reakcji I określają cząstkowe rzędy reakcji względem poszczególnych substratów. Całkowitym rzędem reakcji nazywamy sumę wykładników potęgowych przy stężeniach tych spośród substratów, które są wyszczególnione w równaniu kinetycznym na szybkość reakcji. W równaniu (2) stała k oznacza współczynnik proporcjonalności, zwany stała szybkości reakcji, zależny przede wszystkim od temperatury, obecności katalizatora, rodzaju rozpuszczalnika. Poznanie rzędu reakcji ma istotne znaczenie w badaniach mechanizmu przemian chemicznych, dlatego też ich wyznaczenie należy do podstawowych zadań kinetyki chemicznej.
Dla reakcji, w której bierze udział tylko jeden substrat równanie kinetyczne przyjmuje następującą postać:
![]()
(3)
Scałkowanie powyższego równania różniczkowego prowadzi do użytecznego w praktyce równania kinetycznego (5):
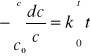
(4)
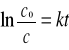
(5)
gdzie: c0 stężenie początkowe w chwili t = 0
c stężenie substratu po upływie czasu t
Dla reakcji I rzędu charakterystyczna jest liniowa zależność w układzie współrzędnych ln c= f(t)
Ln c = ln c0 - kt
(6)
![]()
(7)
Równanie (6) umożliwia sprawdzenie w prosty sposób, czy dana reakcja jest pierwszego rzędu, a jednocześnie pozwala wyznaczyć graficznie stała szybkości k, jako nachylenie (tgα) prostej ln c = f(t):
![]()
(8)
Kinetykę reakcji substancji barwnych można badać metodą spektrofotometryczną poprzez pomiar zmian absorpcji A w czasie. Zgodnie z prawem Lamberta-Beera absorpcja A( absorbancja, ekstynkcja) jest wielkością proporcjonalną do stężenia reagenta. Z tego względu, dla wyznaczenia rzędu reakcji metodą graficzną, można zamiast stężeniem, posługiwać się doświadczalnymi wartościami absorpcji. W przypadku reakcji pierwszego rzędu, równanie kinetyczne (6) zyskuje następującą postać:
ln A = ln A0 - kt
(9)
Zbadanie, czy reakcja jest rzeczywiście pierwszego rzędu polega na przedstawieniu wyników doświadczenia w układzie współrzędnych ln A = f(t), a następnie sprawdzenie czy punkty doświadczalne układają się na prostej. Uzyskanie liniowej zależności wskazuje jednoznacznie, że badana reakcja jest pierwszego rzędu, a wyznaczanie stałej szybkości k sprowadza się do znalezienia współczynnika kierunkowego prostej.
Proces redukcji KmnO4 za pomocą kwasu szczawiowego (H2C2O4) zachodzi bardzo szybko w roztworze zawierającym MnSO4 i towarzyszy temu powstanie barwnego jonu kompleksowego [Mn(C2O4)3]-3:
4Mn2+ + MnO4- + 8H+ + 15 C2O42- 5[Mn(C2O4)3]-3 + 4H2O
Utworzony barwny anion rozpada się następnie na bezbarwne produkty wg równania:
[Mn(C2O4)3]-3 Mn2+ + 5/2 C2O42- + CO2
Jest to jednocześnie najwolniejszy etap, decydujący o kinetyce reakcji. Kinetykę rozpadu barwnego anionu można śledzić spektrofotometrycznie poprzez pomiar zmian absorpcji w czasie. Zakłada się na wstępie, że jest to reakcja pierwszego rzędu, a następnie weryfikuje doświadczalnie przyjęte założenia. Długość fali odpowiadającą maksimum absorpcji barwnego anionu wyznacza się na drodze eksperymentalnej. W przypadku anionu [Mn(C2O4)3]-3 maksimum absorpcji odpowiada 440 nm.
Celem ćwiczenia jest zbadanie kinetyki rozpadu kompleksowego anionu szczawianu manganu [Mn(C2O4)3]-3 w oparciu o wybraną postać równania kinetycznego, a następnie wyznaczenie stałej szybkości tej reakcji.
Tabela wyników pomiaru
Czas t [min] |
Seria I A1 |
Seria II A2 |
Seria III A2 |
Seria I lnA1 |
Seria II lnA2 |
Seria III lnA3 |
0 |
|
|
|
|
|
|
0.5 |
|
|
|
|
|
|
1,5 |
|
|
|
|
|
|
2,0 |
|
|
|
|
|
|
2,5 |
|
|
|
|
|
|
3,0 |
|
|
|
|
|
|
3,5 |
|
|
|
|
|
|
4,0 |
|
|
|
|
|
|
4,5 |
|
|
|
|
|
|
5,0 |
|
|
|
|
|
|
5,5 |
|
|
|
|
|
|
6 |
|
|
|
|
|
|
7 |
|
|
|
|
|
|
8 |
|
|
|
|
|
|
9 |
|
|
|
|
|
|
11 |
|
|
|
|
|
|
13 |
|
|
|
|
|
|
15 |
|
|
|
|
|
|
17 |
|
|
|
|
|
|
19 |
|
|
|
|
|
|
21 |
|
|
|
|
|
|
23 |
|
|
|
|
|
|
25 |
|
|
|
|
|
|
Tabela wyników obliczeń
pomiar |
Stała szybkości [min-1] |
Stała szybkości k [s-1] |
Stała szybkości [min-1] |
Stała szybkości k [s-1] |
I seria |
|
|
|
|
II seria |
|
|
|
|
III seria |
|
|
|
|
Wyszukiwarka