ZAKŁAD CHEMI FIZYCZNEJ
Laboratorium Studenckie
ĆWICZENIE 11: OGRANICZONA MIESZALNOŚĆ CIECZY. WYKRES FAZOWY DLA UKŁADU GLICERYNA - ALKOHOL IZOAMYLOWY 1 - RZĘDOWY.
WYKONALI:
Paweł Witkowski 28.12.2000
Filip Kondratowicz
WSTĘP:
Rozróżnia się roztwory cieczy o nieograniczonej lub ograniczonej rozpuszczalności, jak również zupełnej niemieszalności. Ciecze znacznie różniące się budową, naturą chemiczną lub polarnością w pewnych zakresach składu tworzą dwie fazy ciekłe, z których każda jest nasyconym roztworem jednej cieczy w drugiej. Warunkiem stabilności względem dyfuzji fazy dwuskładnikowej jest dodatnia wartość drugiej pochodnej molowej entalpii swobodnej względem ułamka molowego, przy ustalonym ciśnieniu i temperaturze:
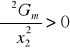
Ponieważ molowa entalpia swobodna jest równa sumie funkcji mieszania ![]()
i udziałów czystych składników:
![]()
Wobec tego:
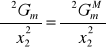
Zatem:
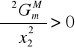
Dwie ciecze są całkowicie mieszalne tzn. tworzą układ jednofazowy przy każdym stosunku składników, jeżeli krzywa ![]()
, jako funkcja ułamka molowego jest krzywą wklęsłą w całym zakresie składu od 0 do 1. Gdzie dwie ciecze tworzą roztwór doskonały:
![]()
Wówczas:
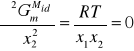
Wobec tego ciecze tworzące roztwory doskonałe są całkowicie mieszalne. Aby nastąpił rozpad na dwie fazy ciekłe krzywa ![]()
musi być wypukła. Nadmiarowa entalpia swobodna musi być dodatnia ![]()
:
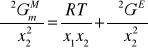
Wynika stąd:
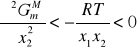
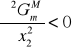
Mamy tu do czynienia z zależnością faz skoniugowanych od temperatury, którą przedstawia się graficznie w układzie współrzędnych: temperatura - ułamki molowe, wagowe. Krzywe składu obu faz wyznaczają na wykresie fazowym obszar ograniczonej mieszalności.
OPRACOWANIE WYNIKÓW:
1) Wyniki pomiarów są zestawione w tabeli:
Nr próbki |
Skład objętościowy |
|
|
Temperatury zmierzone |
|
|
Temperatura średnia |
|
|
ml A |
ml B |
|
|
|
|
|
|
1 |
1,10 |
4,40 |
0,14 |
0,86 |
89 / 89,5 / 89 |
0,01 |
0,06 |
89,17 |
2 |
1,40 |
4,20 |
0,18 |
0,82 |
92 / 91,5 / 91,5 |
0,01 |
0,06 |
91,67 |
3 |
1,80 |
3,60 |
0,25 |
0,75 |
93 / 92,5 / 92,5 |
0,02 |
0,05 |
92,67 |
4 |
2,20 |
3,30 |
0,31 |
0,69 |
94 / 93,5 / 93,5 |
0,02 |
0,05 |
93,67 |
5 |
2,50 |
3,10 |
0,35 |
0,65 |
95 / 94,5 / 94 |
0,02 |
0,04 |
94,50 |
6 |
2,80 |
2,80 |
0,40 |
0,60 |
93,5 / 93 / 93 |
0,03 |
0,04 |
93,17 |
7 |
3,00 |
2,50 |
0,45 |
0,55 |
92 / 92 / 91,5 |
0,03 |
0,03 |
91,83 |
8 |
3,30 |
2,20 |
0,50 |
0,50 |
90 / 89,5 / 89,5 |
0,03 |
0,03 |
89,67 |
9 |
3,60 |
2,00 |
0,55 |
0,45 |
87 / 86,5 / 86 |
0,03 |
0,03 |
86,50 |
10 |
3,80 |
1,80 |
0,59 |
0,41 |
83 / 82,5 / 82 |
0,04 |
0,02 |
82,50 |
11 |
4,00 |
1,50 |
0,64 |
0,36 |
75 / 74 / 73 |
0,04 |
0,02 |
74,00 |
12 |
4,20 |
1,20 |
0,70 |
0,30 |
58 / 56,5 / 56 |
0,04 |
0,02 |
56,83 |
Gdzie: A - alkohol izoamylowy I - rzędowy, B - gliceryna
Ułamki molowe obliczamy z prostych zależności, na przykład dla ![]()
:
![]()
, gdzie ![]()
Zatem:
Dla ![]()
: 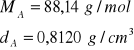
![]()
![]()
![]()
, gdzie ![]()
Zatem:
Dla ![]()
: 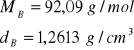
![]()
![]()
2) Następnie sporządzamy wykres fazowy w układzie T=f(x) i wyznaczamy linię na której leżą środki odcinków wyznaczonych przez składy mieszanin skoniugowanych (wykres dołączony).
3) Tak zwane krzywe składu obu faz które uzyskaliśmy, wyznaczają na wykresie fazowym obszar ograniczonej mieszalności. Zbiegają się one w tzw. krytycznej temperaturze mieszania (punkt K). Punkt K leży na prostej łączącej środki odcinków, wyznaczonych przez składy mieszanin skoniugowanych w różnych temperaturach. Zatem temperatura krytyczna mieszanin wynosi ![]()
, a skład krytyczny ![]()
. Jest to temperatura i skład mieszaniny alkoholu izoamylowego i gliceryny w których te dwie substancje ulegają wymieszaniu i powyżej tych wartości mieszają się bez ograniczeń.
1
3
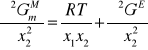
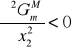
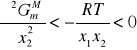
Wyszukiwarka