Grupa V - Technologia żywności
Krzak Dorota, Krzaczyńska Mariola, Krzeczek Alicja, Kubik Agnieszka, Kuc Joanna, Kuziora Kacper, Kwarcińska Patrycja, Kwiecień Katarzyna, Kwiecień Katarzyna Magdalena, Janik Anna, Latra Karolina, Libuszewska Joanna, Lopotan Nadiya, Lorenc Olga
Sprawozdanie z ćw. 1 - Spektrofotometria
Wstęp teoretyczny
Spektrofotometria to dział analizy instrumentalnej, pozwalający na oznaczenie stężenia określonego składnika w roztworze, dzięki wykorzystaniu zdolności tego składnika do absorpcji (pochłaniania) promieniowania elektromagnetycznego. Absorpcja ma charakter selektywny, czyli każda substancja inaczej absorbuje światło. Stąd można wysnuć wniosek, iż poziom absorpcji jest charakterystyczny dla każdej substancji. Związek, który ma zdolność do pochłaniania światła (w zakresie 180-800 nm) nazywamy chromoforem. Posiada on ugrupowanie atomów z wielokrotnymi wiązaniami π (grupę karbonylowa, tiolowa, alkenowa, azowa, nitrowa, nitrozowa, fenylowe); bądź są to związki aromatyczne, heterocykliczne z pierścieniami skondensowanymi, lub też jony metali przejściowych o niezapełnionych powłokach elektronowych. Chromofory mają swoje maximum i minimum absorpcji.
Pochłanianie światła przez substancje jest zależne od następujących praw:
Prawo Lamberta - mówiące iż, natężenie światła monochromatycznego, przechodzącego przez jednorodny układ absorbujący, jest zależne od grubości warstwy absorbującej.
Prawo Beera - mówiące iż, natężenie światła monochromatycznego, przechodzącego przez jednorodny układ absorbujący, jest proporcjonalny do stężenia substancji absorbującej.
Prawo addytywności absorpcji, mówiące iż w układzie wieloskładnikowych, absorpcja jest równa sumie absorbancji poszczególnych składników przy określonej fali.
Aby oznaczyć stężenie określonego składnika, należy przeprowadzić absorpcję przy długości fali odpowiadającej maximum absorpcji tego składnika. Pomiary stężenia składnika polegają na sporządzeniu próbek wzorcowych, odpowiadających składowi chemicznemu badanej próbki, dokonaniu pomiaru absorpcji poprzez przepuszczeniu przez wiązkę światła próbek wzorcowych i badanej próbki, sporządzeniu wykresu zależności absorbancji od stężenia próbek wzorcowych. Wykres ten pozwala porównać poziom absorpcji próbek wzorcowych z badaną próbką, dzięki czemu można oszacować stężenie substancji w badanej próbce.
Cel doświadczenia
Oznaczenie stężenia albuminy surowicy wołowej
Wykonanie
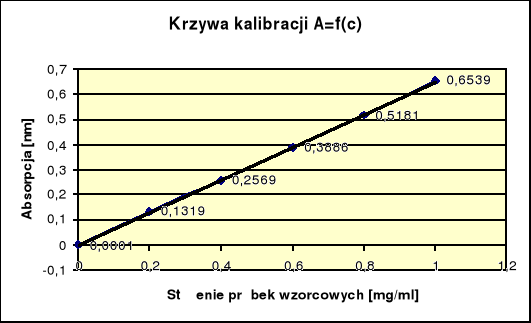
Do oznaczenia albuminy wykorzystano metodę krzywej kalibracji. Mając do dyspozycji roztwór albuminy o stężeniu wzorcowym 1mg/ml, wodę destylowaną; sporządzono serię wzorcowych stężeń białek o następujących stężeniach: 0,2 mg/ml; 0,4 mg/ml; 0,6 mg/ml; 0,8mg/ml; 1 mg/ml oraz próbkę z samą wodą destylowaną. Ilościowo każda próbka zajmowała 1 ml. Kolejno przy użyciu spektrofotometru zmierzono absorbancję wszystkich próbek wzorcowych, przepuszczając wiązkę światła o długości fal 280 nm.
Zestawienie wyników pomiaru i ich opracowanie. Obliczenie stężenia białka.
Wyniki pomiarów:
Cm badanych próbek |
Absorpcja |
0 |
0,0001 |
0,2 |
0,1319 |
0,4 |
0,2569 |
0,6 |
0,3886 |
0,8 |
0,5181 |
1 |
0,6539 |
|
0,2684 |
x - stężenie białka w badanej próbce
Opracowanie wyników:
Wyniki pomiarów można przedstawić w postaci równania funkcji:
y=ax+c, gdzie:
y - wartość mierzona
x - stężenie analitu
a - współczynnik kierunkowy
b - przesunięcie prostej regresji
W procesie kalibracji współczynniki a i b równania y=ax+c można obliczyć na podstawie wzorów:
![]()
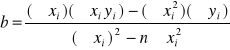
n |
xi |
yi |
xiyi |
xi2 |
yi2 |
1 |
0 |
0,0001 |
0 |
0 |
0,00000001 |
2 |
0,2 |
0,1319 |
0,02638 |
0,04 |
0,01739761 |
3 |
0,4 |
0,2569 |
0,10276 |
0,16 |
0,06599761 |
4 |
0,6 |
0,3886 |
0,23316 |
0,36 |
0,15100996 |
5 |
0,8 |
0,5181 |
0,41448 |
0,64 |
0,26842761 |
6 |
1 |
0,6539 |
0,6539 |
1 |
0,42758521 |
suma: |
3 |
1,9495 |
1,43068 |
2,2 |
0,93041801 |
a = 0,651329
b = -0,00075
y = 0,651329x - 0,00075
Obliczenie współczynnika korelacji rk pozwala na określenie zgodności punktów (xiyi) z prostą regresji. Jeżeli rk jest bliskie ±1, to punkty rozłożone są wzdłuż linii prostej.
![]()
rk= 0,999945; z tego wynika iż punkty (xiyi) są rozłożone wzdłuż linii prostej. Pozwala to na obliczenie stężenia białka na podstawie równania prostej regresji y = 0,651329x - 0,00075.
Badane białko wykazało absorbancję 0,2684; więc:
Y=0,2684; x=?
0,2684=0,651329x - 0,00075 / +0,00075
0,26915=0,651329x / :0,651329
x=0,4132
Stężenie białka wynosi 0,4132 mg/ml
Stężenie rzeczywiste = 0,33 mg/ml
Obliczone stężenie jest niezgodne ze stężeniem rzeczywistym.
Obliczenie błędu względnego:
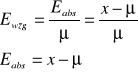
Eabs - błąd bezwględny (absolutny)
X - wartość zmierzona
μ - wartość rzeczywista
![]()
Dyskusja wyniku
Biorąc pod uwagę precyzyjność i dokładność urządzenia, rozbieżność wyników najprawdopodobniej wynika z niedokładnego wypłukania i osuszenia kuwety po zbadaniu absorpcji próbek wzorcowych.
Wyszukiwarka