Reakcje charakterystyczne kationów III grupy analitycznej wg Freseniusa
kation Co2+
Położenie kobaltu w szeregu napięciowym: Fe, Co, Ni,...... H
Roztwarzanie kobaltu metalicznego:
Coo + 2H+ → Co2+ + H2
3Coo + 2NO3- + 8H+ → 3Co2+ + 2NO + 4H2O
Stężone kwasy siarkowy i azotowy pasywują kobalt
---------------------------------------------------------------------------------------------------------------
Reakcje charakterystyczne:
1) Co2+ + S2- ⇔ CoSα przy pH>3
CoSα ⇒ CoSβ nierozpuszczalny w 1M HCl
CoSβ + 2H2O2 + 2H+ → 3Co2+ + S0 + 2H2O
3CoSβ H+ → 3Co2+ + 3S0 + 2NO + 4H2O
2) Co2+ + OH- + NO3- ⇔ Co(OH)NO3
Co2+ + 2OH- ⇔ Co(OH)2
Co(OH)2 + 2OH- ⇔ ×
4Co(OH)2 + O2 + 2H2O ⇔ 4Co(OH)3
w środowisku zasadowym zw. kobaltu(II) utleniają się tlenem z powietrza
3) Co2+ + 6NH3.H2O ⇔ [Co(NH3)6]2+ + 6H2O
Co2+ + NH3.H2O + NO3- ⇔ Co(OH)NO3 + NH4+
(może pojawić się też przejściowo osad soli zasadowej)
4[Co(NH3)6]2+ + O2 + 2H2O ⇔ 4[Co(NH3)6]3+ + 4OH-
4) Co2+ + 4SCN- ⇔ [Co(SCN)4]2-
kompleks powstaje w stężonych roztworach SCN-
5) Co2+ + [Hg(SCN)4]2- ⇔ Co[Hg(SCN)4]
6) Co2+ + 7NO2- + 3K+ + 2CH3COOH ⇔ K3[Co(NO2)6] + NO + 2CH3COO- + H2O
Reakcje charakterystyczne kationów III grupy analitycznej wg Freseniusa
kation Ni2+
Położenie bizmutu w szeregu napięciowym: Co, Ni, Sn, .... H
Roztwarzanie niklu metalicznego:
Nio + 2H+ → Ni2+ + H2 reakcja powolna
3Nio + 2NO3- + 8H+ → 3Ni2+ + 2NO + 4H2O
Stężone kwasy siarkowy i azotowy pasywują nikiel
---------------------------------------------------------------------------------------------------------------
Reakcje charakterystyczne:
1) Ni2+ + S2- ⇔ NiSα
NiSα ⇒ NiSβ nierozpuszczalny w 1M HCl
NiSβ + 2H2O2 + 2H+ → 3Ni2+ + S0 + 2H2O
3NiSβ H+ → 3Ni2+ + 3S0 + 2NO + 4H2O
2) Ni2+ + 2OH- ⇔ Ni(OH)2
Ni(OH)2 + 2OH- ⇔ ×
tlen z powietrza ani woda utleniona nie utleniają Ni(OH)2
Ni(OH)2 + ClO- ⇔ NiO2 + Cl- + H2O
3) Ni2+ + 6NH3.H2O ⇔ [Ni(NH3)6]2+ + 6H2O
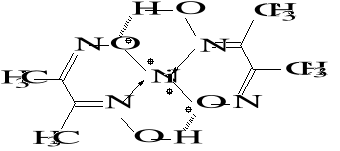
4) Aniony HDMG− wytrącają z kationami Ni2+ czerwony osad kompleksu wewnętrznego:
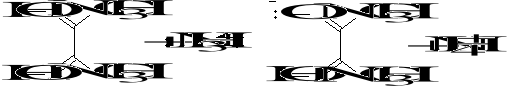
H2DMG HDMG−
(dimetyloglioksym) (anion dimetyloglioksymu)
Ni2+ + 2HDMG− Ni(HDMG)2
Reakcje charakterystyczne kationów III grupy analitycznej wg Freseniusa
kationy Fe2+ i Fe3+
Położenie żelaza w szeregu napięciowym: Zn, Fe, Co… H
Roztwarzanie żelaza metalicznego:
Feo + 2H+ → Fe2+ + H2 (w kwasach nieutleniających oraz w rozc. kw. azotowym(V))
Feo + NO3- + 4H+ → Fe3+ + NO + 2H2O
Stężone kwasy siarkowy i azotowy na zimno pasywują żelazo
---------------------------------------------------------------------------------------------------------------
Reakcje charakterystyczne Fe2+:
1) Fe2+ + S2- ⇔ FeS
FeS + 2H+ ⇔ Fe2+ + H2S (w kw. utleniających powstaje S0)
2) Fe2+ + 2OH- ⇔ Fe(OH)2 pH > 7,2
Fe(OH)2 + 2OH- ⇔ ×
4Fe(OH)2 + O2 + 2H2O ⇔ 4Fe(OH)3
Utlenianie Fe(II) w środowisku zasadowym zachodzi szybko
3) Fe2+ + 2NH3.H2O ⇔ Fe(OH)2 + 2NH4+ (strącenie jest niecałkowite)
Fe(OH)2 + NH3.H2O ⇔ ×
4) Fe2+ + K+ + [Fe(CN)6]3- ⇔ KFe[Fe(CN)6]
błękit Turnbulla
Fe2+ + 2K+ + [Fe(CN)6]4- ⇔ K2Fe[Fe(CN)6]
przy braku O2 osad biały
5) Fe2+ + 2 HDMG− Fe(HDMG)2
reakcja analogiczna jak do niklu(II), czerwony kompleks żelaza jest jednak rozpuszczalny
Reakcje charakterystyczne Fe3+:
1) 2Fe3+ + 3S2- ⇔ Fe2S3 środowisko zasadowe
2Fe3+ + H2S ⇔ 2Fe2+ + So + 2H+ środowisko kwaśne
Fe2S3 + 4H+ ⇔ 2Fe2+ + So + 2H2S
2) Fe3+ + 3OH- ⇔ Fe(OH)3 pH > 2
Fe(OH)3 + OH- ⇔ ×
3) Fe3+ + 3NH3.H2O ⇔ Fe(OH)3 + 3NH4+
Fe(OH)3 + NH3.H2O ⇔ ×
4) Fe3+ + CH3COO- ⇔ [Fe(CH3COO)]2+ pH ≈ 7
czerwony kompleks
[Fe(CH3COO)]2+ + 2H2O + 2CH3COO- ⇔ Fe(OH)2CH3COO + 2CH3COOH
5) Fe3+ + K+ + [Fe(CN)6]4- ⇔ KFe[Fe(CN)6]
błękit pruski
6) Fe3+ + 6SCN- ⇔ [Fe(SCN)6]3-
[Fe(SCN)6]3- + 6F- ⇔ [FeF6]3- + 6SCN-
niektóre ligandy rozkładają kompleks rodankowy
7) 2Fe3+ + 2I- ⇔ 2Fe2+ + I2
Reakcje charakterystyczne kationów III grupy analitycznej wg Freseniusa
kation Mn2+
Położenie manganu w szeregu napięciowym: Al, Mn, Zn, ...... H
Roztwarzanie manganu metalicznego:
Mno + 2H+ → Mn2+ + H2 w rozc. kwasach
Mno + SO42- + 4H+ → Mn2+ + SO2 + 2H2O
W stężonym kwasie siarkowym
---------------------------------------------------------------------------------------------------------------
Reakcje charakterystyczne:
1) Mn2+ + S2- ⇔ MnS
MnS + 2H+ ⇔ Mn2+ + H2S (w kw. utleniających powstaje S0)
2) Mn2+ + 2OH- ⇔ Mn(OH)2 pH > 8
Mn(OH)2 + 2OH- ⇔ ×
4Mn(OH)2 + O2 + 2H2O ⇔ 4Mn(OH)3
w środowisku zasadowym Mn(OH)2 utlenia się szybko tlenem z powietrza
3) Mn2+ + 2NH3.H2O ⇔ Mn(OH)2 + 2NH4+ (strącenie niecałkowite)
Mn(OH)2 + 2NH3.H2O ⇔ ×
4) Mn2+ + H2O2 + 2OH- ⇔ MnO2 + 2H2O
5) 2MnO2 + 3PbO2 + 4H+ ⇔ 2MnO4- + 3Pb2+ + 2H2O
(w środowisku stęż.HNO3 na gorąco)
2Mn2+ + 5PbO2 + 4H+ ⇔ 2MnO4- + 5Pb2+ + 2H2O
zbyt duża ilość jonów Mn(II) redukuje manganian(VII)
2MnO4- + 3Mn2+ + 2H2O ⇔ 5MnO2 + 4H+
Reakcje charakterystyczne kationów III grupy analitycznej wg Freseniusa
kation Cr3+
położenie chromu w szeregu napięciowym: Mn, Cr, Fe, ...H
Roztwarzanie chromu metalicznego:
Cro + 2H+ → Cr2+ + H2
4Cr2+ + O2 + 4H+ → 4Cr3+ + 2H2O (tlen z powietrza błyskawicznie utlenia Cr2+)
Stężone i rozcieńczone kwasy utleniające (np. siarkowy i azotowy) pasywują chrom
---------------------------------------------------------------------------------------------------------------
Reakcje charakterystyczne:
1) Cr3+ + 3S2- + 3H2O ⇔ 2Cr(OH)3 + 3HS-
2) Cr3+ + 3OH- ⇔ Cr(OH)3 pH > 5
Cr(OH)3 + OH- ⇔ [Cr(OH)4]- pH > 11
3) [Cr(OH)4]- ⇔ Cr(OH)3 + OH-
przy ogrzaniu proces przebiega całkowicie
[Cr(OH)4]- + NH4+ ⇔ Cr(OH)3 + NH3.H2O
4) Cr3+ + 3NH3.H2O ⇔ Cr(OH)3 + 3NH4+
Cr(OH)3 + 6NH3.H2O ⇔ [Cr(NH3)6]3+ + 3OH- + 6H2O
proces bardzo powolny
5) 2Cr(OH)3 + 3H2O2 + 4OH- ⇔ 2CrO42- + 8H2O
2CrO42- + 2H+ ⇔ Cr2O72- + H2O
5) Cr2O72- + 3H2O2 + 8H+ ⇔ 2Cr3+ + 3O2 + 7H2O
produktem przejściowym jest nietrwały błękitny nadtlenek chromu CrO5
Reakcje charakterystyczne kationów III grupy analitycznej wg Freseniusa
kation Al3+
położenie glinu w szeregu napięciowym: Mg, Al, Zn, ....H
Roztwarzanie glinu metalicznego:
2Alo + 6H+ → 2Al3+ + 3H2
2Alo + 2OH- + 6H2O → 2[Al(OH)4]- + 3H2
Stężone i rozcieńczone kwasy utleniające (np. siarkowy i azotowy) pasywują glin
---------------------------------------------------------------------------------------------------------------
Reakcje charakterystyczne:
1) Al3+ + 3S2- + 3H2O ⇔ 2Al(OH)3 + 3HS-
2) Al3+ + 3OH- ⇔ Al(OH)3 pH > 4
Al(OH)3 + OH- ⇔ [Al(OH)4]- pH > 9
3) Al3+ + 3NH3.H2O ⇔ Al(OH)3 + 3NH4+
Al(OH)3 + NH3.H2O ⇔ ×
przy dużych stężeniach amoniaku powstaje pewna ilość [Al(OH)4]-
3) [Al(OH)4]- + NH4+ ⇔ Al(OH)3 + NH3.H2O
przy ogrzaniu proces przebiega całkowicie
4) Al3+ + 3CH3COO- + 2H2O ⇔ Al(OH)2(CH3COO) + 2CH3COOH (na gorąco)
5) Al3+ + aluminon ⇔ czerwony osad kompleksu organicznego (lak)
reakcja na gorąco w buforze octanowym (1M CH3COOH/1M CH3COONa)
Reakcje charakterystyczne kationów III grupy analitycznej wg Freseniusa
kation Zn2+
położenie cyku w szeregu napięciowym: Mn, Zn, Fe, ..... H
Roztwarzanie cynku metalicznego:
Zno + 2H+ → Zn2+ + H2
Zno + 2OH- + 2H2O → 2[Zn(OH)4]2- + H2
3Zno + 2NO3- + 8H+ → 3Zn2+ + 2NO + 4H2O (obok NO powstają też NH4+ i N2O)
---------------------------------------------------------------------------------------------------------------
Reakcje charakterystyczne:
1) Zn2+ + S2- ⇔ ZnS (także H2S przy pH > 1,5)
ZnS + 2H+ ⇔ Zn2+ + H2S (w kw. utleniających powstaje S0)
2) Zn2+ + 2OH- ⇔ Zn(OH)2 przy pH > 6,5
Zn(OH)2 + 2OH- ⇔ [Zn(OH)4]2- przy pH > 12
3) Zn2+ + 2NH3.H2O ⇔ Zn(OH)2 + 2NH4+
obecność jonów NH4+ powoduje że, Zn(OH)2 wytrąca się częściowo
Zn(OH)2 + 4NH3.H2O ⇔ [Zn(NH3)4]2+ + 2OH- + 4H2O
4) Zn2+ + [Hg(SCN)4]2- ⇔ Zn[Hg(SCN)4]
Zn2+ + Cu2+ + 2[Hg(SCN)4]2- ⇔ ZnCu[Hg(SCN)4]2
Zn2+ + Co2+ + 2[Hg(SCN)4]2- ⇔ ZnCo[Hg(SCN)4]2
w obecności b. małych ilości jonów Cu2+ lub Co2+
5) Zn2+ + 2K+ + [Fe(CN)6]4- ⇔ K2Zn[Fe(CN)6]
Wyszukiwarka