Wydział: M i IM |
1.Jarosław Indra 2.Marcin Groń |
ROK II |
Grupa: 2 |
Zespól: 6 |
|
Chemia Fizyczna
|
Temat: Ogniwa galwaniczne. SEM ogniw galwanicznych |
Numer ćwiczenia 11 |
|||
Data wykonania: 20-10-1998 |
Data oddania: 27-10-1998 |
Data zaliczenia: |
Ocena: |
||
Cel ćwiczenia:
Celem ćwiczenia jest zapoznanie się z budową i mechanizmem działania odwracalnych ogniw galwanicznych.
Wprowadzenie:
W ćwiczeniu tym zajmiemy się pomiarem SEM różnych ogniw galwanicznych.
W pierwszej części badać będziemy ogniwa chemiczne bez przenoszenia.
Do tego celu potrzebne nam będą dwie zlewki, klucz elektrolityczny mostek pomiarowy, ogniwo Westona, galwanometr, dwie blaszki miedziane używane jako elektrody, akumulator, wodne roztwory: (0,01M ; 0,1M ; 1M)-CuSO4
0,01M-AgNO3 oraz NH4NO3 używany w kluczu elektrolitycznym. Przygotowujemy trzy ogniwa według schematów:
1) Cu|CuSO4(0,01M)||NH4NO3||AgNO3(0,01M)|Ag
2) Cu|CuSO4(0,1M)||NH4NO3||AgNO3(0,01M)|Ag
3) Cu|CuSO4(1M)||NH4NO3||AgNO3(0,01M)|Ag
Po przygotowaniu ogniw podłączamy je po kolei do mostka pomiarowego.
Wykonujemy pomiar SEM poszczególnych ogniw w porównaniu z ogniwem wzorcowym którym jest ogniwo Westona. Pomiar wykonujemy trzy razy w odstępach dwu minutowych celem określenia stabilności ogniwa.
Wdrugiej części badamy ogniwo stężeniowe przygotowane według schematu:
Cu|CuSO4(1M)||NH4NO3||CuSO4(0,1M)|Cu
Pomiary prowadzimy w identyczny sposób jak poprzednie.
Wykonanie:
Ogniwa chemiczne:
T=293K
Schemat ogniwa |
Zmierzona SEM (mV) |
Wyliczona SEM (mV) |
Cu|CuSO4(0,01M)||NH4NO3||AgNO3(0,01M)|Ag
|
383,5 |
405 |
Cu|CuSO4(0,1M)||NH4NO3||AgNO3(0,01M)|Ag |
375,35 |
346,9 |
Cu|CuSO4(1M)||NH4NO3||AgNO3(0,01M)|Ag |
321,4 |
289 |
Eobl. = E0 - 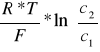
gdzie: c2>c1
F= 96520![]()
R=8,31 J/mol*K
T=293K
E0(293K) =![]()
= 0,405mV![]()
![]()
(przy temp.298K)
![]()
(przy temp.298K)
Ogniwa stężeniowe:
T = 293K
Ezm. = 40,4mV Eobl.= 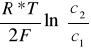
=30mV
c2>c1
Wnioski:
Porównując wartości SEM zmierzonych i obliczonych zauważamy duże różnice. Przyczyną tych różnic jest fakt, że we wzorze Nernsta na SEM pod wartością logarytmu występują aktywności a my do obliczeń przyjęliśmy stężenia roztworów. Spowodowane jest to pewnym uproszczeniem przyjmującym, że roztwory te są roztworami doskonałymi.
ai = Xi*gi
Dla roztworów doskonałych wartość współczynnika aktywności „g” jest równa 1.Przyczyną takiego błędu również była niestabilność ogniw. Niestabilność ta spowodowana jest częściowo przez dyfuzję jednego elektrolitu do drugiego przez klucz elektrolityczny.
Wyszukiwarka