Akwakompleksy metali
Akwakompleksy, czyli związki koordynacyjne w których ligandami są cząsteczki wody, są najprostszą postacią w jakiej jon metalu może istnieć w wodzie. Akwakompleksy powstają w środowisku, jedynie gdy brak jest innych dostępnych ligandów. Powstanie akwakompleksu związane jest z obecnością dwóch wolnych par elektronów na cząsteczce wody, które chętnie przechodzą na puste orbitale p i d metali tworząc wiązanie koordynacyjne.
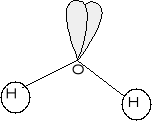
Rys. Schemat budowy cząsteczki wody; szare chmury przedstawiają wolne pary elektronowe
W zależności od panujących w środowisku warunków, niektóre skoordynowane cząsteczki wody (obecne w akwakompleksie) mogą utracić proton (H+), proces ten określamy mianem deprotonacji. Stopień, w jakim zachodzi deprotonacja akwakompleksów, jest w dużej mierze właściwością danego metalu, w procesie tym również nie bez znaczenia jest wartość odczynu środowiska. Należy pamiętać, że proces deprotonacji jest reakcją kwasowo-zasadową, a tym samym proces jest silnie warunkowany przez stężenie jonów wodorowych w środowisku. Proces deprotonacji można przedstawić schematycznie w następujący sposób:
![]()
lub w skróconym zapisie z pominięciem cząsteczek skoordynowanej wody
![]()
gdzie:
Meaq - akwakompleks metalu,
b - wartościowość kationu,
n - liczba skoordynowanych cząsteczek wody
Przy czym proces deprotonacji może przebiegać dalej, aż do utworzenia obojętnych wodorotlenków. Ponieważ reakcje te są związane z rozdzieleniem dwóch ładunków, są one uprzywilejowane w przypadku jonów metali o większym ładunku i mniejszym promieniu jonowym, zwykle wyrażanym jako Z2/r. Zależność tą szczególnie dobrze widać w przypadku metali grup głównych, natomiast dla metali przejściowych istotna role odgrywają również inne czynniki.
Biorąc pod uwagę, że reakcje deprotonacji są reakcjami typu kwas-zasada, pH silnie będzie modyfikować ich przebieg, a więc dla każdego akwakompleksu istnieje taka wartość pH (pKa), w której mamy równe stężenia sprotonowanego kompleksu i jego pierwszego stopnia deprotonacji. Zgodnie z definicją pKa1 jest wartością pH, przy której akwakompleks jest w połowie całkowicie sprotonowany a w połowie pojedynczo zdeprotonowany.
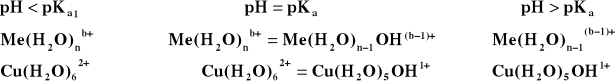
Tak więc w roztworze o pH<pKa1 jony metalu są przeważnie skompleksowane przez cząsteczki wody, podczas gdy jony wodorotlenkowe zastępują cząstki wody, gdy pH > pKa1.
Tabela 1. Wartości pH a pKa1 metalu
Jon metalu |
Z2/r [1/nm-1] |
pKa1 |
Jon metalu |
Z2/r [1/nm-1] |
pKa1 |
Na+ K+ Be2+ Mg2+ Mn2+ Fe2+ Co2+ |
8,6 6,6 68 47 48 43 45,2 |
14,48 >14 6,5 11,42 10,70 10,1 9,6 |
Ni2+ Cu2+ Zn2+ Cd2+ Hg2+ Al3+ Fe3+ |
48 46 46 37 34 133 115 |
9,4 7,53 9,6 11,7 3,7 5,14 2,19 |
Dane z tabeli wskazują, że cząsteczki akwakompleksów jonów metali jednowartościowych (głównie litowce) istnieją w niemal całym zakresie pH w postaci sprotonowanej.
W przypadku berylowców deprotonowanie zachodzi znacznie łatwiej, przy czym wartość pK, uzależniona jest od wartości Z2/r. Dla jonów wapnia i magnezu proces deprotonacji akwakompleksów zachodzi jedynie w alkalicznym środowisku. Proces deprotonacji nabiera szczególnego znaczenia w przypadku metali przejściowych, których punkt pKa1 leży w zakresie odczynu spotykanego naturalnie w środowisku.
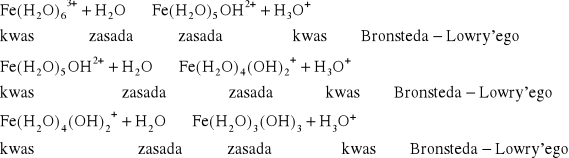
W przypadku jonów trójwartościowych, ze względu na małą wartość pKa1 mogą one w procesie deprotonacji utracić kilka protonów, co w konsekwencji prowadzi do ich strącenia w postaci obojętnych wodorotlenków. Przykładem takiego procesu mogą być jony żelaza (III):
ZADANIA:
Oblicz zawartość poszczególnych form akwakompleksów jonów żelaza (III), dla potrzeb zadania przyjmij iż roztwór glebowy ma pH7. Źródłem jonów Fe3+ jest proces rozpuszczania wodorotlenku żelaza (III).
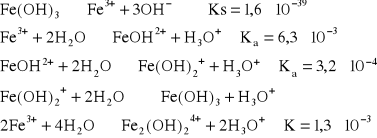
Oblicz zawartość jonów Pb2+ oraz PbOH+ w warunkach odczynu pH 5,7 i 9. Wskaż, która z analizowanych form dominuje w poszczególnych wariantach pH. Iloczyn rozpuszczalności Pb(OH)2 wynosi 10-20, Ka1=1,94*10-8
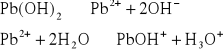
Oblicz zawartość jonów Hg2+ oraz HgOH+ w warunkach odczynu pH 5.5 i 7. Wskaż, która z analizowanych form dominuje w poszczególnych wariantach pH. Iloczyn rozpuszczalności Hg(OH)2 wynosi 3,16*10-26, Ka1=3,9*10-4
Katedra Gleboznawstwa i Rekultywacji
Przedmiot: Fizyka i chemia gleb
2
Wyszukiwarka