Numer grupy: 5 |
Data wykonywania ćwiczenia: 29.11.2009r. |
Symbol zespołu: F |
Symbol i tytuł ćwiczenia: Ćwiczenie 9-1 „Oznaczanie grubości osadzonej powłoki miedzianej i wydajności prądowej elektrolizy” |
Skład zespołu:
|
|
Ocena wystawiona przez prowadzącego: |
|
CEL ĆWICZENIA:
Celem ćwiczenia było wykonanie powłoki miedzianej na płytce metalowej wykonanej z innego metalu a następnie wyznaczenie jej grubości:
Miejscowej - metodą kroplową
Średniej - na podstawie przyrostu masy płytki
Naszym celem było również obliczenie wydajności prądowej elektrolizy.
WSTĘP TEORETYCZNY
Elektroliza jest to proces rozkładu elektrolitu, mający miejsce podczas przepływu prądu elektrycznego przez zdysocujowany elektrolit. Elektrolit ten może być zdysocjowany rozpuszczeniem w rozpuszczalniku, lub roztopieniem pod wpływem temperatury (wtedy mamy do czynienia z termoelektrolizą). Proces elektrolizy polega na wędrówce jonów do elektrod: do dodatniej elektrody (anody) ujemnych jonów (anionów), a do ujemnej elektrody (katody) jonów dodatnich (kationów), czego efektem są dwie reakcje chemiczne odbywające się równolegle i bilansujące się: w otoczeniu anody jest to reakcja utleniania, a w otoczeniu katody reakcja redukcji. W naszym doświadczeniu anodę stanowiły dwie blaszki miedziane, na których zachodzi proces utleniania miedzi do jonów miedzi Cu2+. Natomiast katodę stanowiła blaszka wykonana z mosiądzu, który chcieliśmy pokryć miedzią.
Zastosowana przez nas metoda pokrywania przedmiotu warstwą pożądanego metalu nosi miano galwanostegii. W metodzie tej przedmiot pokrywany włączamy właśnie w obwód prądu jako katodę a metal, który ma się osadzić (posiada cechy bardziej pożądane) pełni rolę anody. Powłoką poza miedzią może być również: nikiel, srebro, chrom, lub złoto. Chronią one w ten sposób materiał konstrukcyjny przed korozją. Ochrona ta jest tym lepsza im grubsza jest dana powłoka. Dzięki zastosowaniu wzoru m=k I t, oraz uwzględnieniu wymiarów przedmiotu który ma być pokryty jesteśmy w stanie dobrać odpowiednie warunki procesu ( czas, natężenie prądu) aby uzyskać powłokę o pożądanej grubości.
WYKONANIE ĆWICZENIA
Układ doświadczalny składał się z: zasilacza prądu stałego, wagi analitycznej, 2 płytek miedzianych, płytki mosiężnej, stopera, elektrolizera wypełnionego wodnym roztworem CuSO4.
Przygotowanie płytki - płytka mosiężna została dokładnie oczyszczona za pomocą papieru ściernego z powłoki miedzianej pozostałej po poprzednim ćwiczeniu, następnie wypłukana kolejno w ciepłej wodzie, zimnej wodzie, acetonie oraz została osuszona na powietrzu. Została także zważona na wadze analitycznej (m1)
Anody i katoda zostały zanurzone w elektrolizerze wypełnionym elektrolitem. Anody oraz katoda podłączone zostały kabelkami do zasilacza prądu stałego.
Elektroliza - układ został podłączony do zasilacza prądu stałego. Proces ten trwał 20minut (czas odliczany stoperem) prądem o natężeniu 0,5A , w temperaturze otoczenia.
Po zakończeniu elektrolizy (po upływie 20min) wyłączono zasilacz, płytkę mosiężną wyjęto i wypłukano w wodzie destylowanej i acetonie - wysuszono następnie ponownie zważono na wadze analitycznej (m2).
Określamy wymiary powłoki galwanicznej za pomocą linijki oraz wyznaczam pole dowierzchni tej powłoki ze wzoru na pole prostokąta pomnożonego przez dwa (galwanizacja miała miejsce na obydwu stronach płytki).
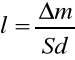
Wyznaczamy średnią grubość powłoki galwanicznej - średnią grubość powłoki galwanicznej obliczyliśmy stosując wzór:
Gdzie, l - jest średnią grubością osadzonej powłoki miedzianej [cm]
S - jest całkowitą powierzchnią powłoki galwanicznej [cm2]
∆m - przyrost masy płytki powstały w wyniku elektrolizy [g] ∆m=m2-m1
d - gęstość powłoki miedzianej [g∙cm-3] (dcu = 8,92g∙cm-3)
Miejscowa grubość powłoki miedzianej
Stosując 0,2588 molowy roztwór AgNO3 rozpuszczaliśmy powłokę miedzianą powstałą podczas elektrolizy w dwóch miejscach ( na środku oraz na krawędzi płytki). Na czystą płytkę pokrytą miedzią nanosiliśmy po 1 kropli roztworu na każde z wyznaczonych miejsc, po czym za pomocą stopera odmierzaliśmy każdorazowo 60 sek. I zaraz potem wycieraliśmy miejsca delikatnie za pomocą papieru tak, aby nie ścierać powłoki miedzianej mechanicznie, lecz aby usunąć powstający osad. Czynności te prowadziliśmy do momentu pojawienia się warstwy mosiężnej. Miejscowa grubość powłoki została obliczona ze wzoru:
![]()
Gdzie, l - jest grubością powłoki w danym miejscu (na środku płytki lub krawędzi) [μm]
n - jest ilością kropel roztworu zużytego do rozpuszczenia powłoki
a - jest stałą podającą grubość powłoki rozpuszczanej przez 1 kroplę roztworu w danym czasie (60s) w danej temperaturze.
Obliczyliśmy wydajność prądową elektrolizy stosując następujący wzór:
![]()
Gdzie, md=∆m - przyrost masy płytki [g]
mt - masa miedzi osadzona na płytce w wyniku elektrolizy (zgodnie z prawem Faradaya: masa substancji przekształconej na elektrodzie podczas elektrolizy jest proporcjonalna do natężenia prądu i czasu trwania elektrolizy)
I - natężenie prądu [A]
t - czas elektrolizy [s]
k - równoważnik elektrochemiczny miedzi [g∙C-1] obliczony ze wzoru:
![]()
z-liczba moli wymienianych elektronów![]()
F - stała Faradaya,
M - masa molowa miedzi
OPRACOWANIE WYNIKÓW
Masa płytki przed elektrolizą ![]()
Masa płytki po elektrolizie ![]()
Pole powierzchni powłoki galwanicznej ![]()
Średnia grubość powłoki miedzianej:![]()
![]()
![]()
Miejscowa grubość powłoki miedzianej (wyznaczona metoda kroplową):
![]()
Ilość kropli zużytych na rozpuszczenie powłoki miedzianej na środku płytki - 6 kropli
Miejscowa grubość powłoki ![]()
Ilość kropli zużytych na rozpuszczenie powłoki miedzianej na krawędzi płytki - 7 kropli
Miejscowa grubość powłoki ![]()
Średnia miejscowa grubość powłoki - ![]()
Wydajność prądowa elektrolizy:
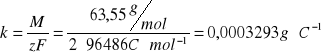
![]()
![]()
SPOSTRZEŻENIA i WNIOSKI
Cel doświadczenia został w zrealizowany. Poprzez zastosowanie elektrolizy udało nam się pokryć blaszkę mosiężną warstwą miedzi ![]()
oraz zmierzyć grubość tej powłoki (zarówno średniej dla całej płytki ![]()
, jak i w określonych punktach![]()
![]()
).
Wyniki świadczą, że grubości powłoki w różnych miejscach płytki nie jest jednakowa. Co więcej średnia grubość powłoki miedzianej w dużym stopniu odbiega od grubości punktowej. Wobec tego możemy wysnuć wniosek, że w pewnych miejscach płytka ma znaczne braki a grubość powłoki osadzonej miedzi jest nierównomierna. Należy także mieć świadomość, że błąd pomiaru grubości powłoki metodą kroplową jest dosyć wysoki.
Obliczyliśmy także wydajność prądową elektrolizy ![]()
- uzyskany przez nas wynik jest większy od 1, świadczy to o tym że na katodzie zachodziły równocześnie dwa procesy:
Cu2+ + 2e → Cu / Cu+ + e → Cu.
![]()
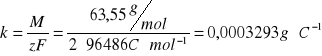
![]()
![]()
![]()
Wyszukiwarka