Sprawozdanie pobrane ze StudentSite.pl |
|
Chcesz więcej? Wejdź na: http://www.studentsite.pl/materialy_studenckie.html |
|
Możesz także wspomóc swoimi sprawozdaniami innych: http://www.studentsite.pl/panel_materialy_studenckie/add |
|
KF PŚk |
Imię i nazwisko: XYZ| |
Wydział, grupa: XYZ |
|||
Symbol ćwiczenia: M 3 |
Temat: WYZNACZANIE STOSUNKU Cp/CV METODĄ CLEMENTA DESORMES'A
|
||||
Data wykonania: |
Data oddania do poprawy: |
Ocena: |
|||
1.Termodynamika - nauka o energii, dział fizyki zajmujący się badaniem energetycznych efektów wszelkich przemian fizycznych i chemicznych, które wpływają na zmiany energii wewnętrznej analizowanych układów. Wbrew rozpowszechnionym sądom termodynamika nie zajmuje się wyłącznie przemianami cieplnymi, lecz także efektami energetycznymi reakcji chemicznych, przemian z udziałem jonów, przemianami fazowymi, a nawet przemianami jądrowym i energią elektryczną.
Przemiany gazowe należą do procesów termodynamicznych, w opisywaniu których znajdują zastosowanie zasady termodynamiki. Stan gazu określony jest przez podanie trzech jego parametrów: temperatury T, objętości V i ciśnienia p. Jeżeli masa gazu pozostaje stała, wówczas wymienionych wyżej wielkości nie można zmieniać w sposób dowolny, gdyż są one ze sobą związane, tzw. Równanie stanu.
Dla gazu doskonałego równanie to nosi nazwę równania Clapeyrona i ma postać:
PV=m/M∗RT
gdzie: m-masa, M-masa cząsteczkowa, R - uniwersalna stała gazowa (R=8.314 ∗ 103 J / kmol ∗ K).
Przemiana gazowa może obejmować zmianę wszystkich trzech parametrów stanu. Można jednak stworzyć takie warunki, by jeden z parametrów pozostał niezmieniony.
Proces zachodzący w stałej temperaturze nazywa się izotermicznym, przy stałym ciśnieniu - izobarycznym, w stałej objętości - izochorycznym. Wykresy ilustrujące te sytuacje:
p
T2
T1
V
Izotermy ( T2 > T1 )
PV = const. ( prawo Boyle'a i Mariotte'a )
V
P2
P1
T
Izobary ( p2 < p1)
V = const. ( prawo Gay - Lussaca )
p
V2
V1
T
Izochory ( V2 < V1) p = const. ∗ T ( prawo Charlesa ).
Pomiar wartości - metodą CLEMENTA - DESORMERSA.
W naczyniu zamkniętym kranem i połączonym z manometrem znajduje się gaz pod ciśnieniem równym ciśnieniu atmosferycznemu, w temperaturze t, równej temperaturze otoczenia. Gaz ten poddajemy trzem przemianom.
Przemiana I (izotermiczna) - za pomocą pompki zwiększamy ciśnienie gazu do wartości p0 + p1. Stan gazu po tej przemianie opisuje następujące parametry: ciśnienie p = p0 + p1, objętość właściwą v, temperaturę t. Przez objętość właściwą rozumiemy objętość 1g gazu.
Przemiana II (adiabatyczna) - otwieramy kran na krótką chwilę i ponownie zamykamy z chwilą wyrównania się ciśnienia w naczyniu z ciśnieniem atmosferycznym. Gaz rozprężając się wykonuje pracę, a jego temperatura ulega obniżeniu. Nowy stan gazu (stan II) określają parametry: ciśnienie p0, objętość właściwa v', temperatura t'.
Przemiana III (izochoryczna) - po zamknięciu kranu gaz dzięki wymianie ciepła z otoczeniem uzyskuje znów temperaturę początkową, a jego ciśnienie wzrasta do wartości p0 + p2 ( p2 < p1). Po tej przemianie stan gazu scharakteryzowany jest ciśnieniem p0 + p2, objętością właściwą v' i temperaturą t. Ponieważ w stanie III gaz posiada tę samą temperaturę t, którą posiadał w stanie I związek między początkową i końcową objętością właściwą oraz początkowym i końcowym ciśnieniem możemy wyrazić prawem Boyle'a i Mariotte'a.
|
h |
h' |
κ |
1 |
27 |
7 |
1,35 |
2 |
25 |
6 |
1,3158 |
3 |
25 |
6,5 |
1,3513 |
4 |
25 |
6,5 |
1.3513 |
5 |
26 |
6,75 |
1.3506 |
6 |
26 |
6,75 |
1.3506 |
7 |
25 |
7 |
1.3589 |
8 |
25 |
6,75 |
1.3699 |
9 |
25 |
6 |
1.3158 |
10 |
25 |
6,5 |
1.3513 |
Opracowanie wyników:
1 Obliczam średnią arytmetyczną k:
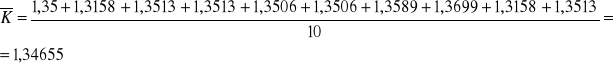
2.Obliczam średni błąd kwadratowy średniej arytmetycznej k
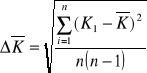
Obliczam:
(1,35-1,34655)2=0,0000119
(1,3158-1,34655)2=0,0009456
(1,3513-1,34655)2=0,0000226
(1,3513-1,34655)2=0,0000226
(1,3506-1,34655)2=0,0000164
(1,3506-1,34655)2=0,0000164
(1,3589-1,34655)2=0,0001525
(1,3699-1,34655)2=0,0005452
(1,3158-1,34655)2=0,0009456
(1,3513-1,34655)2=0,0000226

Obliczona wartość κ wraz z oszacowanym błędem wynosi: 1,34655 ± 0,005477
Dla powietrza wykładnik adiabaty wynosi 1,4 błąd wynika z występowania błędów pomiarowych:
Błędy systematyczne przy tej metodzie pomiarów mogą być spowodowane niedoskonałością narzędzi, np. minimalną nieszczelnością układu, przesunięciem skali, niedokładnym wyskalowaniem podziałki.
Błędy przypadkowe mogą powodować niedokładne odczyty wartości spowodowane przez niedoskonały wzrok, zaniżanie i zawyżanie wyników przy zaokrąglaniu.
Wyszukiwarka