ĆWICZENIA LABORATORYJNE Z CHEMII
4. STATYKA CHEMICZNA
BADANIE WPŁYWU STĘŻENIA REAGENTÓW NA STAN RÓWNOWAGI CHEMICZNEJ
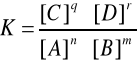
Jeżeli reakcja chemiczna o równaniu nA + mB qC + rD osiągnie stan równowagi, wówczas stężenia reagentów spełniają zależność:
gdzie K- stała równowagi reakcji; [A], [B], [C], [D] - stężenia molowe reagentów,
m, n, r, q - współczynniki stechiometryczne reakcji.
Wpływ zmian stężenia reagentów, ich ciśnienia oraz temperatury na stan równowagi reakcji, określa jakościowo reguła Le Chateliera-Brauna, zwana też regułą przekory.
Reguła ta brzmi; jeżeli układ będący w stanie równowagi poddamy działaniu bodźca zewnętrznego (tj. zmiana stężenia reagentów, zmiana ciśnienia lub temperatury), to
w układzie tym zajdą takie przemiany, które działanie tego bodźca zmniejszą.
Reguła przekory pozwala przewidzieć wpływ zmian stężenia jednej z substancji uczestniczącej w reakcji na stan równowagi chemicznej układu.
WYKONANIE ĆWICZENIA:
Do probówki nalać 2 cm3 roztworu chlorku żelazowego FeCl3 i 2 cm3 roztworu rodanku potasowego KSCN, wymieszać i rozdzielić do czterech probówek. Jedną
z nich (0) pozostawić jako wzorcową. Do drugiej (1) probówki dodać dwie krople nasyconego roztworu rodanku potasowego, do trzeciej (2) nasyconego roztworu chlorku żelazowego, do czwartej (3) - wrzucić kilka kryształków chlorku potasowego KCl. Obserwować różnicę intensywności zabarwienia w trzech probówkach w porównaniu z probówką wzorcową. Wyniki obserwacji zanotować w tabeli wyników.
Przed dodaniem proszę WYMIESZAĆ odczynniki!!!
Nr probówki |
Dodatkowy odczynnik |
Zmiana intensywności zabarwienia |
Stała równowagi reakcji |
Zmiana stęż. reagentów (wzrost, spadek) |
|
|
|
|
|
produkty |
substraty |
0 |
- |
- |
|
- |
- |
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
OPRACOWANIE WYNIKÓW:
Reakcja między roztworem chlorku żelazowego i rodanku potasowego doprowadza
do wytworzenia barwnego niezdysocjowanego rodanku żelazowego Fe(SCN)3
i ustalenia się stanu równowagi zgodnie z równaniem:
- w postaci cząsteczkowej
FeCl3 + 3 KSCN ↔ Fe(SCN)3 + 3 KCl
- w postaci jonowej
Fe3+ + 3Cl- + 3K+ +3SCN- ↔ Fe(SCN)3 + 3K+ 3Cl-
- w postaci skondensowanej
Fe3+ + 3SCN- ↔ Fe(SCN)3
Stan równowagi można przesunąć przez dodanie poszczególnych reagentów, co uwidacznia się zmianą zabarwienia roztworu. W tabeli wyników zapisać, jaka jest zmiana stężenia każdego z reagentów wywołana dodaniem jednego z nich.
Wyszukiwarka
Podobne podstrony:
3.kinetyka chemiczna, Politechnika Rzeszowska Budownictwo, IBD, Chemia
COŚ1, Politechnika Rzeszowska Budownictwo, IBD, Chemia
COŚ 3, Politechnika Rzeszowska Budownictwo, IBD, Chemia
6.twardosc, Politechnika Rzeszowska Budownictwo, IBD, Chemia
5.co2 agresywny, Politechnika Rzeszowska Budownictwo, IBD, Chemia
8.oznaczanie zelaza w cemencie, Politechnika Rzeszowska Budownictwo, IBD, Chemia
7.siarczany, Politechnika Rzeszowska Budownictwo, IBD, Chemia
harmonogram 2011 2012, Politechnika Rzeszowska Budownictwo, IBD, Materiały budowlane
sprawozdanie 01 nowe, Politechnika Rzeszowska Budownictwo, IBD, Fizyka
materialy bud, Politechnika Rzeszowska Budownictwo, IBD, Materiały budowlane
mechanika4, Politechnika Rzeszowska Budownictwo, IBD, Fizyka
Katedra Geodezji im, Politechnika Rzeszowska Budownictwo, IBD, Geodezja
pierwsza str fiz, Politechnika Rzeszowska Budownictwo, IBD, Fizyka, sprawozdanie
cw22, Politechnika Rzeszowska Budownictwo, IBD, Fizyka
pierwsza str teczki fiz, Politechnika Rzeszowska Budownictwo, IBD, Fizyka, sprawozdanie
spr 5, Politechnika Rzeszowska Budownictwo, IBD, Fizyka
więcej podobnych podstron