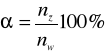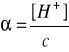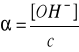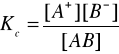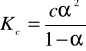Dysocjacja elektrolitów - rozpad na jony pod wpływem wody.
Substancje, których roztwory wodne przewodzą prąd elektryczny - elektrolity. Substancje, których roztwory wodne nie przewodzą prądu elektrycznego - nieelektrolity
Elektrolitami słabymi są kwasy - HF, H2SO3, HNO2, H2S, CH3COOH, H2O*CO2, zasady - NH3 H2O. |
|
Stopień dysocjacji
np.
|
Pojęcie to po raz pierwszy wprowadził Arrhenius i jest ono często wykorzystywane do porównywania mocy elektrolitów. Stopień dysocjacji elektrolitu określa się stosunkiem liczby moli cząsteczek zdysocjowanych na jony do liczby moli cząsteczek substancji rozpuszczonej.
|
Stała dysocjacji Kc
|
- jest wielkością stałą w określonej temperaturze, niezależną od stężenia. Dlatego może służyć jako miara mocy elektrolitów. Im elektrolit jest mocniejszy, tym wartość stałej Kc jest większa. dla elektrolitu mocnego wartość Kc > 1 dla elektrolitów słabych 10-7 < Kc < 10-3 |
Prawo rozcieńczeń Oswalda - związek pomiędzy stopniem dysocjacji a stałą dysocjacji. |
|
w ułamku ! |
gdy < 0,05 ( < 5%) lub
|
Obliczyć stopień dysocjacji elektrolitu wiedząc że w roztworze znajduje się 0,2 mola cząsteczek zdysocjowanych oraz 0,8 mola cząsteczek niezdysocjowanych.
|
20% |
|
Obliczyć stężenie molowe jonów potasu w 0,1 molowym roztworze siarczku potasu (=100%)
|
0,2 M |
|
Obliczyć stężenie molowe jonów wapnia w roztworze zawierającym 1,11 g chlorku wapnia w 100 cm3 roztworu (=100%)
|
0,1 M |
|
Obliczyć stopień dysocjacji kwasu cyjanowodorowego w roztworze o c = 0,1 M. Stała dysocjacji HCN wynosi 7,2*10-10.
|
8,5*10-5 |
|
Obliczyć stopień dysocjacji kwasu azotowego (III) (K=2*10-4) w 0,01 molowym roztworze?
|
13% |
|
Obliczyć stopień dysocjacji kwasu jednoprotonowego (K=4*10-4) w roztworze o stężeniu jonów H+ 0,1 M.
|
0,4% |
|
Obliczyć stężenie molowe roztworu jednoprotonowej zasady (K=10-4) wiedząc że stężenie jonów OH- wynosi 0,02 M.
|
4 M |
Stopień i stała dysocjacji 1 / 5
Wyszukiwarka
Podobne podstrony:
9068
9068, Dokumenty(1)
9068
9068
więcej podobnych podstron