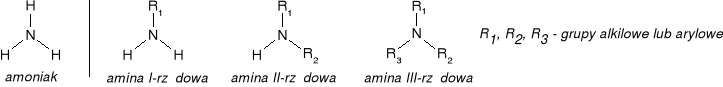
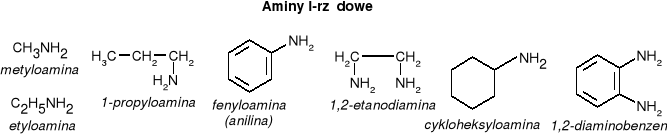
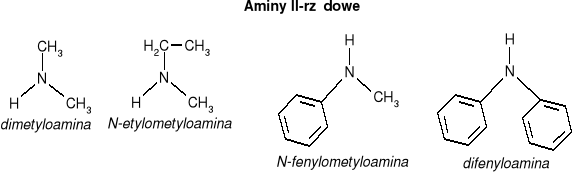
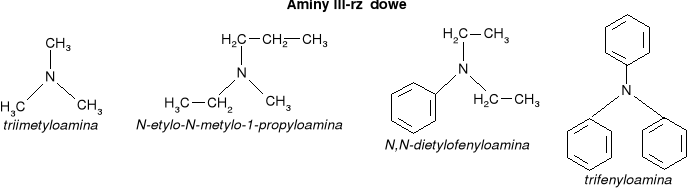
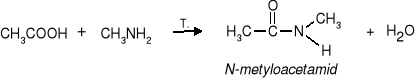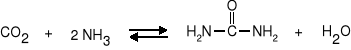AMINY - organiczne pochodne amoniaku
|
|
|
|
|
metylo-, dimetylo-, trimetylo-, etyloamina - gazy o zapachu amoniaku
pozostałe aminy I - rzęd. to ciała stałe lub ciecze o niskich temp. wrzenia; dobrze rozp. w wodzie; aminy II i III - rzęd. gorzej rozp. się w wodzie
stan skupienia amin aromatycznych zależy od rzędowości i podstawnika
- ciecze (anilina; N,N-dimetyloanilina; o-toluidyna; m-toluidyna)
- ciała stałe (trifenyloamina; p-toluidyna; nitroanilina)
aminy aromatyczne są silnymi truciznami; mniej toksyczne są aminy alifatyczne
|
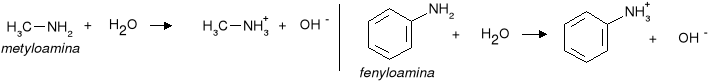
Aminy mają podobnie jak amoniak właściwości zasadowe - ich roztwory wodne zawierają jony wodorotlenowe
|
|
Aminy alifatyczne są słabymi zasadami o mocy porównywalnej z mocą amoniaku, a aminy aromatyczne są od nich słabszymi zasadami. Słaby charakter zasadowy amin aromatycznych jest spowodowany oddziaływaniem wolnej pary elektronowej grupy aminowej z sekstetem elektronowym pierścienia aromatycznego.
|
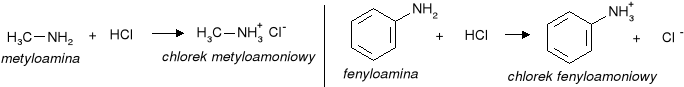
1. Tworzenie soli w reakcji z kwasami.
|
2. Tworzenie amidów z kwasami karboksylowymi w wyniku ogrzewania
(dotyczy amin I i II rzędowych)
|
|
3. Aminy aromatyczne ulegają łatwo substytucji w pierścieniu aromatycznym
|
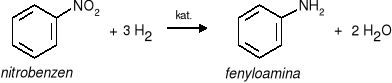
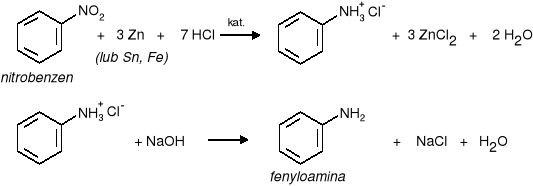
a) amin aromatycznych - przez redukcję związków nitrowych
|
|
|
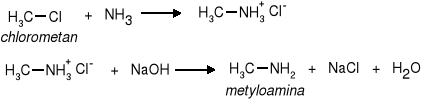
b) amin alifatycznych - przez podstawienie atomu fluorowca amoniakiem i wydzielenie aminy zasadą.
|
|
|
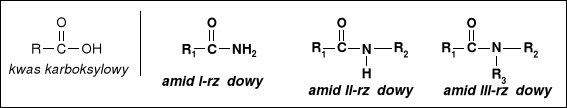
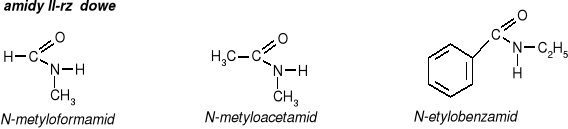
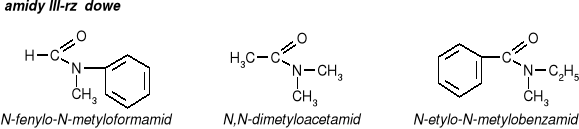
pochodne kwasów karboksylowych w których grupa OH- grupy karboksylowej została zastąpiona grupą aminową NH2
|
|
|
|
|
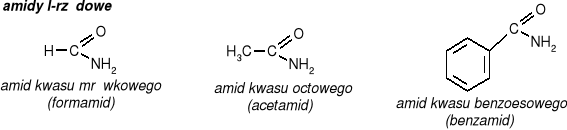
Właściwości fizyczne acetamidu:
biała krystaliczna substancja
dobrze rozpuszczalny w wodzie
odczyn roztworu wodnego obojętny
|
Właściwości fizyczne amidów:
są na ogół ciałami stałymi (wyjątek: formamid i jego
N-alklopochodne które są cieczami)
|
Reakcje charakterystyczne:
|
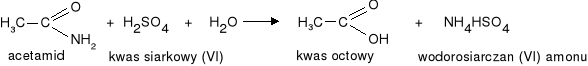
1. Hydroliza w środowisku kwaśnym (pod wpływem mocnych kwasów nieorganicznych)
|
|
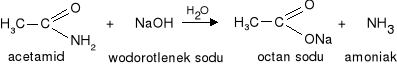
2. Hydroliza w środowisku zasadowym (pod wpływem wodorotlenków litowców)
|
|
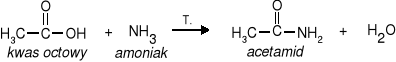
1. Ogrzewanie kwasów karboksylowych z amoniakiem lub aminami
|
|
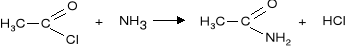
2. Reakcja chlorków kwasowych z amoniakiem lub aminami
|
|
|
Kwas węglowy ze względu na obecność w swojej cząsteczce dwóch grup karboksylowych może tworzyć pochodne organiczne np. mocznik
|
Właściwości fizyczne mocznika:
biała krystaliczna substancja
dobrze rozpuszczalny w wodzie
odczyn roztworu wodnego obojętny
|
Reakcje charakterystyczne:
1. Hydroliza w środowisku kwaśnym (pod wpływem mocnych kwasów nieorganicznych)
|
|
2. Hydroliza w środowisku zasadowym (pod wpływem wodorotlenków litowców)
|
|
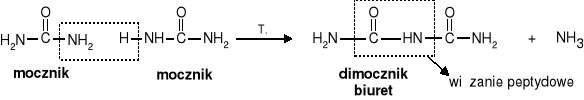
3. Reakcja kondensacji dwóch cząsteczek mocznika. W wyniku reakcji tworzy się cząsteczka dimocznika zw. biuretem. Biuret zawiera wiązanie peptydowe, (wiązanie peptydowe wykrywa się za pomocą reakcji z jonami miedzi (II) - reakcja biuretowa).
|
|
synteza amoniaku I dwutlenku węgla w reakcji odwrotnej do reakcji hydrolizy
|
|
w pocie i moczu zwierząt i ludzi jako produkt przemiany białek
jako półprodukt w syntezie środków leczniczych i mas plastycznych
|