Kucaba Janusz 22.10.2005
I TD
Sprawozdanie z ćw. nr. 23
Sprawdzanie praw elektrolizy Faradaya
Zagadnienia do samodzielnego przygotowania.
1. Przepływ prądu przez elektrolity
Jeśli związek jonowy np. NaCl, ulegnie rozpuszczeniu w wodzie, której cząsteczki mają budowę rozciągniętych dipoli, to w wyniku oddziaływania elektrycznego na spolaryzowane cząsteczki związku jonowego nastąpi rozpad tych ostatnich na oddzielne jony. Zjawisko to nosi nawę dysocjacji elektrolitycznej, natomiast roztwór związku ulegającego rozpadowi na jony, nazywa się elektrolitem.
W roztworach wodnych dysocjacji ulegają: kwasy, zasady i sole, przy czym tworzące się jony wodoru i metali są dodatnie, zaś jony grupy wodorotlenowej OH lub reszty kwasowej (np. Cl- , NO3-) - ujemne. W elektrolicie jony znajdując się w stanie bezwładnego ruchu cieplnego zderzają się wzajemnie oraz z cząsteczkami wody. Zderzenie się jonów o znakach przeciwnych powoduje zobojętnienie ich ładunków i utworzenie cząsteczki substancji rozpuszczonej (np. NaOH). Zjawisko to nosi nazwę rekombinacji jonów.
Stosunek liczby cząstek ulegających dysocjacji, do całkowitej liczby cząstek zawartych w roztworze nazywamy stopniem dysocjacji elektrolitu, przy czym jego wartość wzrasta ze wzrostem temperatury i maleje ze wzrostem stężenia roztworu. Zjawisko dysocjacji występuje również po stopieniu związku jonowego
Po wprowadzeniu elektrolitu CuSO4 płyt metalowych i połączeniu ich ze źródłem napięcia rozpoczyna się, pod wpływem wytworzonego pola elektrycznego, uporządkowany ruch jonów, równoznaczny z przepływem prądu elektrycznego. Aniony po zetknięciu z anodą oddają nadmiar elektronów, zaś kationy zobojętniają się na katodzie tworząc cząsteczki odpowiednich związków. Reakcje zachodzące na elektrodach noszą nazwę pierwotnych, gdyż w rzeczywistości zobojętnione jony reagują z materiałem elektrody lub z wodą w elektrolicie, otrzymane substancje różnią się od bezpośrednich produktów rozkładu. Zjawisko to nosi nazwę elektrolizy. Ilościowo zjawisko to ujmują prawa Faradaya.
2. Pierwsze i drugie prawo Faradaya.
I Prawo Faradaya
Masa m substancji wydzielonej z elektrolitu na elektrodzie jest wprost proporcjonalna do natężenia I przepływającego prądu oraz czasu przepływu t.
![]()
![]()
II Prawo Faradaya
Równoznacznik elektrochemiczny k substancji wydzielonej z elektrolitu jest wprost proporcjonalny do jej równoważnika chemicznego ![]()
.
![]()
Wykonanie ćwiczenia.
Przyrządy: analityczna waga laboratoryjna, elektrody miedziowe z zamocowaniem, amperomierz, zasilacz, sekundomierz.
Połączyłem obwód według schematu:Sprawdziłem poprawność obwodu elektrycznego zamykając obwód na krótki czas. Równocześnie regulowałem natężenie prądu w obwodzie, tak by nie przekraczał 0,5A/dm2. Natężenie prądu wyznaczyłem w oparciu o powierzchnię elektrody.
Wyjąłem katodę, oczyściłem starannie papierem ściernym, wypłukałem wodą. Wyznaczyłem masę m1 katody korzystając z analitycznej wagi laboratoryjnej.
Umieściłem ponownie katodę w elektrolicie, włączyłem prąd uruchamiając jednocześnie zegar. Utrzymałem stałą wartość natężenia prądu przez czas t = 30 minut.
Po upływie tego czasu przerwałem przepływ prądu. Opłukałem katodę wodą, osuszyłem i wyznaczyłem masę m2 katody. Masę wydzielonej miedzi obliczyłem ze wzoru m = m2 - m1. Przekształcając wzór m = k I t obliczyłem równoważnik elektrochemiczny miedzi.
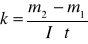
Z układu okresowego pierwiastków odczytałem masę atomową miedzi mCu, wartościowość miedzi w = 2 i ze wzoru wyrażającego II prawo Faradaya obliczyłem stałą Faradaya:
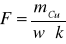
Wyniki umieściłem w tabelce:
Wnioski.
I |
m1 |
t |
m2 |
m |
k |
k±Δk |
F |
F±ΔF |
[ mA ] |
[ kg ] |
[ s ] |
[ kg ] |
[ kg ] |
|
|
|
|
250 |
0.084052 |
1800 |
0.084199 |
0.000147 |
0,0327•10-5 |
0,0327•10-5 ±0,00084•10-5 |
97094801 |
97094801 ±48547401,1 |
Δm = Δm1 = Δm2 = 0,000005kg
ΔI = ± 1,5 mA (zakres - 300; klasa - 0,5)
Δt = ± 5s
mCu = 63,5
![]()
![]()
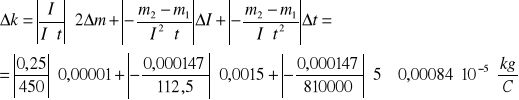
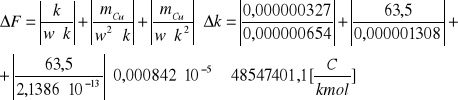
![]()
%![]()
%![]()
%
![]()
%![]()
%![]()
%
Ćwiczenie polegało na przeprowadzeniu procesu analizy w roztworze wodnym CuSo4 w wyniku czego na katodzie osadziła się Cu, którą później zważyłem na wadze laboratoryjnej. Uważam, iż stała Faradaya, która została przeze mnie policzona jest inna od właściwej z powodu błędów w pomiarach, oraz błędów które wynikły z klasy przyrządu pomiarowego oraz z dokładności wagi laboratoryjnej.
mA
Wyszukiwarka
Podobne podstrony:
23, Elektroliza, Molenda Piotr
Cwiczenie 23 - Kompensacyjny miernik skutecznosci zerowania MZK-2, UTP-ATR, Elektrotechnika i elektr
E2p, UTP-ATR, Elektrotechnika i elektronika dr. Piotr Kolber, sprawozdania
Cel ćwiczenia, UTP-ATR, Elektrotechnika i elektronika dr. Piotr Kolber, sprawozdania
Ogniwo, UTP-ATR, Elektrotechnika i elektronika dr. Piotr Kolber, sprawozdania
Badanie przebiegow pradow i napiec sinusoidalnych w elementach RLC, UTP-ATR, Elektrotechnika i elekt
zadania sieci elektroenergetycznych, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materia
RLC, UTP-ATR, Elektrotechnika i elektronika dr. Piotr Kolber, sprawozdania
Laboratorium Napędu Elektrycznegoćw19, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, mater
Laboratorium Stacji Elektroenergetycznych, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, m
sprawko elektra nr 1, UTP-ATR, Elektrotechnika i elektronika dr. Piotr Kolber, sprawozdania, elektra
Rozruch silnika asynchronicznego, UTP-ATR, Elektrotechnika i elektronika dr. Piotr Kolber, sprawozda
Teoria(23), elektronika
Porazenie, UTP-ATR, Elektrotechnika i elektronika dr. Piotr Kolber, sprawozdania
ele, UTP-ATR, Elektrotechnika i elektronika dr. Piotr Kolber, sprawozdania
Badanie silnika asynchronicznego, UTP-ATR, Elektrotechnika i elektronika dr. Piotr Kolber, sprawozda
Licznik pradu zmiennego, UTP-ATR, Elektrotechnika i elektronika dr. Piotr Kolber, sprawozdania
Jednofazowe zasilacze sieciowe, UTP-ATR, Elektrotechnika i elektronika dr. Piotr Kolber, sprawozdani
więcej podobnych podstron