OPRACOWANIE WYNIKÓW
1. Obliczam wartość pH roztworu buforowego w poszczególnych próbkach z równania Hendersona-Hasellbacha:
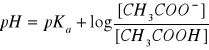
przyjmuję wartość pKa=4,76. Obliczam wartość stężenia kwasu octowego (wyjściowe stężenie 1M). Stężenie octanu sodu w roztworze kazeiny wynosi 0,1M, uwzględniam również stężenie wyjściowe octanu sodu 1M. Objętość końcowa 4ml.
Przykłady obliczeń:
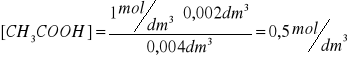
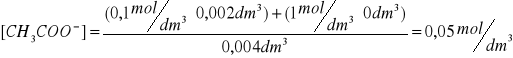
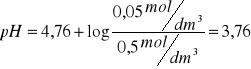
Wyniki zestawiłem w tabeli:
Nr |
kw.Octowy 1M [ml] |
Octan sodu 1M [ml] |
[CH3COOH] [mol/dm3] |
[CH3COO-] [mol/dm3] |
pH |
1 |
2,0 |
0,0 |
0,50 |
0,05 |
3,76 |
2 |
1,8 |
0,2 |
0,45 |
0,1 |
4,11 |
3 |
1,6 |
0,4 |
0,40 |
0,15 |
4,33 |
4 |
1,4 |
0,6 |
0,35 |
0,2 |
4,52 |
5 |
1,2 |
0,8 |
0,30 |
0,25 |
4,68 |
6 |
1,0 |
1,0 |
0,25 |
0,3 |
4,84 |
7 |
0,8 |
1,2 |
0,20 |
0,35 |
5,00 |
8 |
0,6 |
1,4 |
0,15 |
0,4 |
5,19 |
9 |
0,4 |
1,6 |
0,10 |
0,45 |
5,41 |
10 |
0,2 |
1,8 |
0,05 |
0,5 |
5,76 |
Zawartość białka w roztworze obliczam z wzorcowej zależności pomiędzy stężeniem białka, C, wyrażonym w g/l i zmierzoną absorbancją A:
C= 32,2*A - 0,30
Nr |
pH |
Absorbancja A [-] |
Stężenie białka c [g/l] |
1 |
3,76 |
0,075 |
2,1150 |
2 |
4,11 |
0,021 |
0,3762 |
3 |
4,33 |
0,020 |
0,3440 |
4 |
4,52 |
0,019 |
0,3118 |
5 |
4,68 |
0,021 |
0,3762 |
6 |
4,84 |
0,029 |
0,6338 |
7 |
5,00 |
0,039 |
0,9558 |
8 |
5,19 |
0,141 |
4,2402 |
9 |
5,41 |
0,175 |
5,3350 |
10 |
5,76 |
0,251 |
7,7822 |
Obliczony przeze mnie punkt izoelektryczny wynosi ok. 4,5, natomiast tabelaryczna wartość wynosi 4,7.
Błąd pomiaru:
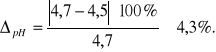
Wnioski:
Otrzymany przeze mnie punkt izoelektryczny przy pH równym 4,5 odbiega minimalnie od wartości teoretycznej, jedynie 4,3% (błąd wynika ze źle pracującego kalorymetru podczas pomiaru absorbancji). Kazeina ma największe stężenie jonu obojnaczego w środowisku kwaśnym. Uważam, że pomiar został wykonany z jak największą dokładnością, o czym świadczy mały błąd pomiarowy.
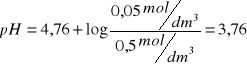
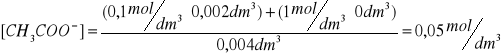
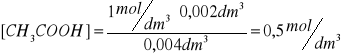
Wyszukiwarka
Podobne podstrony:
41, CHEMIA FIZYCZNA SPRAWKA 4 SEM
chemia fizyczna 21, CHEMIA FIZYCZNA SPRAWKA 4 SEM
OPRACOWANIE WYNIKÓW, CHEMIA FIZYCZNA SPRAWKA 4 SEM
Fizyczna strona główna czysta, CHEMIA FIZYCZNA SPRAWKA 4 SEM
91, CHEMIA FIZYCZNA SPRAWKA 4 SEM
fizyczna 99, CHEMIA FIZYCZNA SPRAWKA 4 SEM
91 fizyczna, CHEMIA FIZYCZNA SPRAWKA 4 SEM
sprawozdanie nr 27, CHEMIA FIZYCZNA SPRAWKA 4 SEM
fizyczna ćw. 23, CHEMIA FIZYCZNA SPRAWKA 4 SEM
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
28fizyczna, inżynieria materiałowa - semestr 4, Inżynieria Materiałowa pwr - semestr 4, Chemia Fizyc
spr 8.5 obliczenia1, semestr 4, chemia fizyczna, sprawka laborki, 8.5
6, semestr 4, chemia fizyczna, sprawka laborki, 6.11
moje 4, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
sekuła, inżynieria materiałowa - semestr 4, Inżynieria Materiałowa pwr - semestr 4, Chemia Fizyczna,
fizyczna 2011 egzamin - teoria, technologia chemiczna, chemia fizyczna2010-2011, sem 4, fizyczna egz
więcej podobnych podstron