POLITECHNIKA CZĘSTOCHOWSKA
KATEDRA FIZYKI
LABORATORIUM Z PRZETWORNIKÓW
ELEKTRYCZNYCH
TEMAT: WYZNACZANIE RÓWNOWAŻNIKA ELEKTROCHEMICZ-
NEGO MIEDZI I STAŁEJ FARADAY'A.
Ćwiczenie wykonane przez:
Sroka Sebastian
Rok I , Gr.V
WSTĘP TEORETYCZNY
Drobiny związków chemicznych o wiązaniu jonowym w środowisku o dużej przenikalności elektrycznej łatwo ulegają rozpadowi na jony. Wynika to z osłabienia sił kolumbowskiego oddziaływania między jonami w drobinie. Sytuacja taka ma miejsce w przypadku soli, zasad lub kwasów w roztworze cieczy dipolowej. Cieczą tą najczęściej w praktyce jest woda (ε = 81). Proces rozpadu drobin na jony pod wpływem rozpuszczalnika nazywamy dysocjacją elektrolityczną. Jonami dodatnimi (kationami) są zawsze jony metalu lub wodorowe, zaś jonami ujemnymi (anionami) są jony reszty kwasowej lub grupy OH. Równocześnie zachodzi proces odwrotny. Jony przeciwnych znaków spotkawszy się w toku termicznych ruchów mogą tworzyć obojętne drobiny. Ten proces określony jest mianem rekombinacji jonów. Intensywność obu tych procesów jest zależna od stężenia roztworu i jego temperatury. W każdych warunkach ustala się ściśle określony dla tych warunków stan równowagi dynamicznej między tymi dwoma procesami, któremu odpowiada określone stężenie jonów w roztworze, lub ściślej; określony stopień dysocjacji. Stopień dysocjacji określony jest przez stosunek liczby drobin zdysocjonowanych do ogólnej liczby drobin w danej objętości roztworu, np. w jednostce objętości: α =.
Wstawienie do roztworu elektrolitycznego elektrod metalowych lub węglowych i wytworzenie między nimi różnicy potencjałów powoduje uporządkowany ruch jonów - anionów ku katodzie (+) oraz kationów ku katodzie (-). Docierające do elektrod jony zobojętniają się oddając ładunek elektrodzie, same zaś bądź wydzielają się w czystej chemicznie postaci, bądź wchodzą w reakcje z atomami elektrod lub innymi atomami otoczenia.
Tak więc przepływowi prądu przez elektrolit towarzyszą reakcje chemiczne. Przepływ prądu przez elektrolit i towarzyszące mu reakcje chemiczne określa się mianem elektrolizy. Ku elektrodom nie poruszają się same jony powstałe w wyniku dysocjacji. Jony te w wyniku elektrostatycznego oddziaływania z dipolowymi drobinami rozpuszczalnika otaczają się nimi. Proces ten w ogólnym przypadku nazywamy solwatacją, a w przypadku wodnych roztworów hydratacją jonów. Wynikiem solwatacji jonów jest zmniejszona ich ruchliwość, co wydatnie zmniejsza przewodnictwo właściwe elektryczne elektrolitów określone równaniem :
(1) σ = = zen α ( ua + uk )
gdzie:
e - ładunek elementarny
z - wartościowość jonów
n - liczba drobin substancji elektrolitycznej w jednostce objętości
α - stopień dysocjacji
ua i uk - ruchliwość anionów i kationów
przy czym:
u = []
Wraz ze wzrostem temperatury rośnie stopień dysocjacji oraz ruchliwość jonów, a więc przewodnictwo elektrolitów również rośnie (odwrotnie niż w metalach).
Wspomniane już wspomniane wydzielanie się substancji chemicznych na elektrodach podlega prawom Faradaya. Pierwsze z nich mówi, że masa substancji wydzielonej na każdej z elektrod jest proporcjonalna do wartości ładunku przeniesionego przez elektrolit:
(2) m = kQ = k I t
gdzie:
k - równoważnik elektrochemiczny równy liczbowo masie substancji wydzielonej przez prąd o natężeniu 1 A w ciągu 1 s
I - natężenie prądu płynącego przez elektrolit
t - czas przepływu prądu
Q = I t - ładunek przeniesiony przez elektrolit.
Drugie prawo Faradaya stwierdza, że masy substancji wydzielonych na dowolnej elektrodzie z dowolnego roztworu takim samym prądem i w ciągu tego samego czasu mają się do siebie tak, równoważniki chemiczne tych substancji. A więc :
(3) =
gdzie:
R =
A - masa atomowa substancji
z - wartościowość
Uwzględniając (2) i (3) można napisać:
(4) =
lub
(5) = = = F
gdzie:
F - stała Faradaya
Stosując stałą Faradaya można przepisać równanie (2) w postaci :
(6) m = I t
Z równania (5) wynika, że F ma wymiar ładunku elektrycznego, zaś z równania (6) wynika, że gdy I t = F , wydzielona zostanie masa m = R, czyli masa jednego równoważnika chemicznego. Stała Faradaya jest równa ładunkowi związanemu z wydzielonej na dowolnej elektrodzie jednego gramo- lub kilogramorównoważnika chemicznego. Stosując konsekwentnie układ SI używać należy pojęcia kilogramorównoważnika. W tym przypadku wartość stałej Faradaya wynosi F = (96488 3.2)⋅103 [ ]
Elektroliza ma wielostronne zastosowania przemysłowe w oczyszczaniu metali, w produkcji aluminium i w wielu gałęziach przemysłu chemicznego.
W elektrotechnice stosujemy powszechnie tzw. miedź elektrolityczną, oczyszczaną drogą elektrolizy w wannach elektrolitycznych. Jako są używane grube płyty miedzi podlegającej oczyszczeniu, jako katody - cienkie blachy z czystej miedzi. Podczas elektrolizy tylko jony miedzi osiadają na katodach, a zanieczyszczenia spadają na dno wanny. Do oczyszczenia 1 kg miedzi w jednej wannie potrzeba 850 A⋅h [przy k' = 1,185 g/ (A⋅h)].
Aluminium wytwarza się w procesie termoelektrolizy, tj. elektrolizy w wysokiej temperaturze. Jako surowiec wyjściowy służy tlenek glinu (Al2O3) rozpuszczony w roztopionym kriolicie o temperaturze ok. 1220 K ( 950 0 C ). Wanny płaskie, każda o powierzchni dna ok. 10 m2, są wykonywane ze stali i wyłożone na dnie płytami węglowymi służącymi za katody. Jako anody są używane bloki węglowe, których końce są zanurzone w elektrolicie. Podczas przepływu prądu elektrycznego jony glinu osiadają na dnie wanny, zostają zneutralizowane i jako płynne aluminium zalegają dno wanny. Ujemne jony tlenu dochodzą do anod, powodując ich spalenie się. Na tonę aluminium zużycie anod wynosi 600 do 700kg, a zużycie energii elektrycznej 17 000 do 18 000 kW⋅h.
Jedną z najbardziej rozpowszechnionych dziedzin zastosowań elektrolizy jest galwanostegia, tj. elektrolityczne nakładanie powłok metalowych ochronnych lub ozdobnych. Można tu wymienić: chromowanie, posrebrzanie, pozłacanie, miedziowanie, kadmowanie. Procesy te odbywają się w wannach elektrolitycznych. Dużą trwałością i przyczepnością odznaczają się powłoki z miedzi. Dlatego przedmioty przeznaczone do powlekania innymi metalami bywają najpierw miedziowane. Warstwy metalu można nakładać również na prze dmioty niemetalowe. W tym celu należy je posypać proszkiem grafitowym, odznaczającym się dostateczną kondyktuwnością. Tak robi się formy metalowe, np. rzeźb.
Schemat układu pomiarowego.
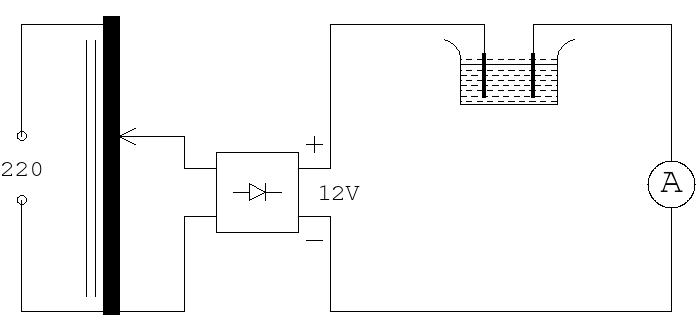
Tabela pomiarów.
L.p.
|
m1 [mg] |
m2 [mg] |
m [mg] |
I [A] |
t [s] |
1 |
48700 |
48738 |
38 |
0.1 |
1200 |
2 |
48738 |
48780 |
42 |
0.1 |
1200 |
OPRACOWANIE WYNIKÓW
WZORY:
F = - stała Faradaya
k = - równoważnik elektrochemiczny miedzi
m = m2 - m1 - masa wydzielonej miedzi
m1 - masa początkowa katody
m2 - masa końcowa katody
t - czas elektrolizy
k = = = 3.16 ⋅ 10-4 []
F = = = 10.06 ⋅ 10-4
5.Rachunek błędów.
ε -błąd względny
Δ - błąd bezwzględny
Δk= || ⋅ |Δm| + || ⋅ |ΔI| + || ⋅ |Δt|
ε m = ⋅ 100% m = 3.29 ⋅ 10-4 []
ΔF = || ⋅ |Δm| + || ⋅ |ΔI| + || ⋅| Δt|
ε F = ⋅ 100% F = 9.6487 ⋅ 104 []
Δe = || ⋅ |Δm| + || ⋅ |ΔI| + || ⋅ |Δt|
ε e = ⋅ 100% e = 1.602 ⋅10-19 C
NA = 6.022 ⋅ 1023 mol-1
Tabela wyników.
a) dla m = 32⋅10-3 g
|
Wynik |
Błąd względny |
Jednostka |
Błąd bezwględny |
k |
3.16⋅10-4 |
4.6% |
[ g /C ] |
14.583⋅10-6 |
F |
10.06⋅104 |
4.6% |
[ C /mol ] |
4629 |
e |
1.67⋅10-19 |
4.6% |
[ C ] |
7.6869⋅10-21 |
b) dla m = 42⋅10-3 g
|
Wynik |
Błąd względny |
Jednostka |
Błąd bezwględny |
k |
3.5⋅10-4 |
4.56% |
[ g /C ] |
15.958⋅10-6 |
F |
9.0857⋅104 |
4.3% |
[ C /mol ] |
3935.57 |
e |
1.508⋅10-19 |
4.5% |
[ C ] |
6.815⋅10-21 |
WNIOSKI
Przyczynami powstawania błędów, mniejszych lub większych, są:
- wahające się natężenia prądu I, które podczas całego doświadczenia powinno być stałe;
- niedokładność zważenia katody przed i po wykonaniu doświadczenia;
-przypadkowe wytarcie osadzonej miedzi na katodzie podczas osuszania, a także niewystarczająco dokładne oczyszczenie katody przed przystąpieniem do ćwiczenia.
Wyszukiwarka