LABORATORIUM
TECHNOLOGIA BIOKONWERSJI
Temat ćwiczenia:
Oznaczanie witaminy C w produktach naturalnych
Pietrasiak Maciej Rembisz Daria Zając Karolina
II grupa dziekańska Piątek 12:15- 16:00
CZĘŚĆ TEORETYCZNA
Kwas askorbinowy
Witamina C jest jednym z najbardziej niezbędnych związków, jakie powinniśmy dostarczyć do naszego organizmu - należy do grupy związków egzogennych. Za witaminę C uważa się kwas L-askorbinowy i kwas L-dehydroaskorbinowy. Funkcja biologiczna kwasu askorbinowego polega głównie na tworzeniu odwracalnego układu oksydoredukcyjnego KA <-> KDA. Układ taki chroni różne substancje przed utlenieniem.
Kwas L-askorbinowy jest związkiem krystalicznym, dobrze rozpuszczalnym w wodzie
a jego roztwory mają smak kwaśny. Wykazuje właściwości redukujące. W warunkach
beztlenowych jest odporny na wysoką temperaturę. Kwas dehydroaskorbinowy jest mniej
trwały w tych warunkach i tym tłumaczy się straty witaminy C podczas ogrzewania. W
obecności tlenu obie formy ulegają nieodwracalnemu utlenianiu do produktów nieaktywnych
biologicznie, zwłaszcza w obecności jonów niektórych metali, szczególnie Cu2+ i Fe3+. Witamina C należy do jednych z najmniej stabilnych witamin. Łatwo ulega utlenianiu, jest bardzo wrażliwa na obróbkę termiczną. Wystąpienie czynników cofających dysocjację stabilizują ten związek. Te czynniki to m.in. mocne kwasy. Podczas wykonywania oznaczenia witaminy C w różnych produktach należy wydobywać ją delikatnie. Czynnikami przyspieszającymi proces utleniania są: pH słabo kwaśne i alkaliczne, wysoka temperatura, enzymy.
Funkcje witaminy C w naszym organizmie:
podnosi odporność organizmu
pełni funkcję ochronną w przypadku przeziębienia - dzięki swojemu udziałowi w biosyntezie kolagenu (podskórna warstwa ochronna, zabezpieczająca przed przenikaniem wirusów) oraz roli w produkcji limfocytów (niszczących zainfekowane komórki)
uczestniczy w procesach metabolicznych jako substancja przenosząca elektrony
dzięki współdziałaniu w biosyntezie kolagenu przyspiesza proces gojenia się ran i zrastania kości
uczestniczy w metabolizmie tłuszczów, cholesterolu i kwasów żółciowych
uczestniczy w regeneracji witaminy E
ułatwia przyswajanie niehemowego żelaza i uczestniczy w wytwarzaniu krwinek czerwonych
jako silny reduktor przeciwdziała procesowi utleniania wywołanemu przez wolne rodniki
hamuje powstawanie w żołądku rakotwórczych nitrozoamin
ma właściwości bakteriostatyczne, a nawet bakteriobójcze w stosunku do niektórych drobnoustrojów chorobotwórczych
Niedobór kwasu askorbinowego, objawiający się: wolniejszym gojeniem się ran,
bladością skóry i błon śluzowych, zaburzeniami w przemianie kwasów tłuszczowych,
osłabieniem naczyń włosowatych i możliwością powstawania mikrowylewów w różnych
narządach, zmniejszeniem odporności na infekcje oraz występowaniem szkorbutu (obrzęki i
krwawienie z dziąseł oraz wypadanie zębów), występuje dziś niezwykle rzadko. Nadmiar
witaminy C jest usuwany z moczem, jednakże stosowanie wysokich dawek powoduje
zakwaszenie moczu, upośledzając w ten sposób wydalanie stałych kwasów i zasad. Kwaśny
odczyn moczu może powodować wytrącanie się moczanów i cystynianów oraz tworzenie się
kamieni w drogach moczowych.
Dzienna dawka pokrywająca zapotrzebowanie organizmu na kwas askorbinowy u dorosłych osób wynosi : 90mg dla mężczyzn i 75mg dla kobiet.
Najbogatszymi źródłami tej witaminy są owoce i warzywa, takie jak: czarna porzeczka, głóg, cytryny, pomarańcze, papryka, nać pietruszki, chrzan, kapusta, bujawa.
Metody chemiczne - metoda Tillmansa i jej modyfikacje
Metoda Tillmansa oparta jest na redukcji 2,6-dichlorofenoloindofenolu przez kwas L-askorbinowy. Metoda ta sprowadza się do miareczkowania roztworu kwasu L-askorbinowego barwnikiem Tillmansa do momentu pojawienia się jasno różowego zabarwienia. Jest to metoda prosta, ale tylko w przypadku roztworów bezbarwnych i nie zawierających innych związków powodujących redukcję odczynnika Tillmansa. W praktyce wiadomo, że większość surowców roślinnych zawiera barwniki antocyjanowe, które nadają ekstraktom witaminy C różowe zabarwienie, a także mają właściwości redukujące. Ponadto w produktach, w których oznaczamy witaminę C, występują inne związki ulegające utlenieniu podczas miareczkowania odczynnikiem Tillmansa. Należą do nich reduktony - związki obdarzone silnymi właściwościami redukującymi, które należy przypisywać obecności ugrupowania endiolowego. W przypadku oznaczania witaminy C w owocach i warzywach oraz ich przetworach mamy do czynienia z reduktonami białkowymi (aminokwasy lub białka zawierające grupy sulfhydrylowe, które są utleniane przez odczynnik Tillmansa do wiązań disulfidowych) oraz cukrowymi (pochodne cukrów, które powstają podczas obróbki termicznej).
W przypadku roztworów silnie zabarwionych stosuje się modyfikację metody Tillmansa, tzn. miareczkowanie 2,6-dichlorofenoloindofenolem w obecności rozpuszczalnika organicznego (chloroform, ksylen). Wykorzystuje się tu fakt zróżnicowanej rozpuszczalności. Barwniki antocyjanowe, w odróżnieniu od barwnika Tillmansa, nie rozpuszczają się w rozpuszczalniku organicznym, natomiast barwnik Tillmansa rozpuszcza się. Nadmiarowa kropla 2,6-dichlorofenoloindofenolu przechodzi do warstwy rozpuszczalnika barwiąc go na różowo.
CZĘŚĆ DOŚWIADCZALNA
Oznaczenie miana odczynnika Tillmansa (OT)
Pobraliśmy 5cm3 roztworu roboczego KA o stężeniu 0,02mg/cm3 i miareczkowaliśmy odczynnikiem Tillmansa do uzyskania różowego zabarwienia trwałego przez 15 sekund. Oznaczenie wykonaliśmy w 3 powtórzeniach.
Ilość OT zużyta do zmiareczkowania 5 cm3 kwasu askorbinowego (KA) wynosiła:
- 2,4 cm![]()
- 2,5 cm![]()
- 2,6 cm![]()
Po uśrednieniu uzyskaliśmy wynik 2,4 cm![]()
odczynnika Tillmansa.
Miano OT wyliczamy zgodnie ze wzorem:
miano OT = 0,1 mg KA / VOT [mg KA/ cm3 OT]
miano OT = 0,1 mg KA / 2,4 cm![]()
OT= 0,045 [mg KA / cm![]()
OT ]
Oznaczanie kwasu askorbinowego w ekstraktach bezbarwnych
Badanym przez naszą grupę surowcem był banan.
Do wykonania oznaczenia pobraliśmy 20g surowca, rozcieraliśmy w moździerzu z piaskiem i dodatkiem 2% roztworu kwasu szczawiowego. Otrzymaną papkę przenieśliśmy ilościowo do kolby miarowej na 200cm3 i uzupełniliśmy kwasem szczawiowym do kreski. Następnie całość wymieszaliśmy, odstawiliśmy na 30 minut i przesączyliśmy przez sączek bibułowy. Po rozcieńczeniu w otrzymanym ekstrakcie oznaczyliśmy zawartość KA metodą tillmansometryczą.
Ilość OT zużyta do zmiareczkowania 5 cm3 kwasu askorbinowego (KA) zawartego w ekstrakcie z banana wynosiła:
Obliczenie stężenia witaminy C (
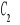
KA) w badanym surowcu po poddaniu go działaniu oksydazy askorbinianowej.Badane przez nas ekstrakty z banana wykazały niewielką zawartość witaminy C, która wynosiła od 7,43 do 7,6 mg KA/ 100g produktu.
Według danych literaturowych wartość ta wynosi 10 mg/100g produktu, a zatem otrzymany przez nas wynik nieznacznie różni się od prawidłowego.
Podczas badania wpływu oksydazy askorbinianowej zawartej w soku z ogórka stwierdziliśmy, że enzym ten znacznie przyspiesza proces utleniania kwasu askorbinowego.
W przypadku naszego surowca ubytek witaminy C z wykorzystaniem 0,5 cm
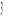
soku z ogórka wynosił od 63,16% do 69,72%.
|
Ilość OT zużyta do zmiareczkowania 5 cm3 kwasu askorbinowego [cm |
Pietrasiak Maciej |
0,85 |
Rembisz Daria |
0,85 |
Zając Karolina |
0,825 |
Obliczenie ilości KA [mg] w 5 cm![]()
ekstraktu z banana:
Przykładowe obliczenie dla 0,85cm![]()
:
KA = 0,85 cm![]()
* 0,045 mg KA/ cm![]()
= 0,038 mg KA
Otrzymana ilość kwasu askorbinowego znajdowała się w 5 cm![]()
ekstraktu, a nasza wyjściowa objętość ekstraktu z banana wynosiła 200 cm![]()
. Zatem dokonujemy odpowiedniego przeliczenia:
0,038 mg KA - 5 cm![]()
x KA - 200 cm![]()
x KA![]()
x KA = 1,52mg KA/ 20 g surowca
Do naszego doświadczenia odważaliśmy 20 g produktu, a zatem otrzymaną powyżej wartość musimy przeliczyć na 100g produktu:
C![]()
KA = 1,52 mg KA* 5 = 7,6 mg KA/ 100g produktu
3. Wpływ oksydazy askorbinianowej na trwałość witaminy C w badanym surowcu
10g produktu rozcieraliśmy w moździerzu z piaskiem i wodą. Przenieśliśmy do kolby o pojemności 250 cm3 .Dodaliśmy zróżnicowaną ilość soku z ogórka (np. w przypadku banana było to 0,5 cm3), będącego źródłem enzymu, dopełniliśmy wodą do kreski i przesączyliśmy. Do 2 cm3 przesączu dodaliśmy 2cm3 2% roztworu kwasu szczawiowego. Zawartość KA w próbie oznaczaliśmy metodą Tillmansa (j.w.)
Ilość odczynnika Tillmansa zuzyta do miareczkowania próby:
|
Ilość OT zużyta do zmiareczkowania 5 cm3 kwasu askorbinowego [cm |
Pietrasiak Maciej |
0,05 |
Rembisz Daria |
0,045 |
Zając Karolina |
0,04 |
Przykładowe obliczenie stężenia KA [mg] w 2 cm![]()
ekstraktu z banana:
![]()
KA = 0,05 cm![]()
* 0,045 mg KA/ cm![]()
![]()
KA = 2,25*10![]()
mg KA
Następnie wykonujemy przeliczenie na wyjściową objętość ekstraktu surowca- 250 cm![]()
:
2,25*10![]()
mg KA - 2 cm![]()
![]()
KA - 250 cm![]()
![]()
KA ![]()
![]()
KA =0,28 mg KA/10g surowca
Przeliczenie na 100 g produktu:
![]()
KA = 0,28 mg KA* 10 = 2,8 mg KA/ 100g produktu
4. Wyliczenie strat kwasu askorbinowego jakie nastąpiły pod wpływem działania oksydazy askorbinianowej
S = ![]()
gdzie:
S - straty kwasu askorbinowego jakie nastąpiły pod wpływem działania oksydazy askorbinianowej [%]
![]()
- wyjściowe stężenie kwasu askorbinowego w badanym surowcu [mg KA/100g]
![]()
- stężenie kwasu askorbinowego w badanym surowcu po zastosowaniu oksydazy askorbinianowej [mg KA/100g]
Przykładowe obliczenie strat kwasu askorbinowego dla:
![]()
= 7,6 mg KA/100g
![]()
= 2,8 mg KA/100g:
S = ![]()
Tabela z wynikami wszystkich osób z grupy:
|
wyjściowe stężenie kwasu askorbinowego w badanym surowcu [mg KA/100g]
|
stężenie kwasu askorbinowego w badanym surowcu po zastosowaniu oksydazy askorbinianowej [mg KA/100g]
|
S straty kwasu askorbinowego [%]
|
Pietrasiak Maciej |
7,6 |
2,8 |
63,16 |
Rembisz Daria |
7,6 |
2,53 |
66,71 |
Zając Karolina |
7,43 |
2,25 |
69,72 |
5. Wnioski:
Wyszukiwarka