Krzysztof Woźniak 12.10.2012r.
L01, grupa IV
Wyznaczenie stosunku cp/cv
Wstęp
Gaz doskonały i równanie Clapeyrona:
Gaz doskonały jest to gaz, który w pełni spełnia równanie Clapeyrona.
pV / t = const.
Podstawowe przemiany gazowe:
Izochoryczna - (objętość gazy jest niezmienna) ciśnienie stałej masy gazu jest wprost proporcjonalne do jego temperatury bezwzględnej:
dU = dQ
i wyliczając ze wzoru na ciepło pobrane przez ciało przy elementarnej zmianie temperatury dQ = cmdT (1.1) otrzymujemy:
dU = cvmdT (1.2)
Izobaryczna - (ciśnienie jest niezmienne) objętość stałej masy gazu jest wprost proporcjonalna do temperatury w skali Kelvina:
Vk = ( V0 / T0 ) Tk
korzystając ze wzorów (1.1), (1.2) i dW = - pdV otrzymujemy:
cvmdT = cpmdT - pdV
c) Adiabatyczna - zachodzi bez wymiany ciepła z otoczeniem (dQ = 0):
CvdT = - pdV
korzystając z równania Clapeyrona możemy doprowadzić do wzoru:
pVχ = const
χ = Cp/Cv
Ciepło właściwe gazów:
Ciepło właściwe gazów doskonałych nie zależy od temperatury. Jeśli więc ogrzewamy 1 kg gazu o 1 °C od temperatury 0 °C do 1 °C, to musimy dostarczyć tyle samo ciepła, co podczas ogrzewania od 100 °C do 101 °C. W przypadku gazów rzeczywistych ciepło właściwe (zarówno cp jak i cv) jest zależne od temperatury. Rośnie ono wraz z temperaturą, a więc ogrzewając gaz od 100 °C do 101 °C musimy dostarczyć więcej ciepła, niż ogrzewając tą samą ilość gazu od 0 °C do 1 °C. Zmiana ta komplikuje nieco obliczenia, ponieważ nie możemy zastosować stałej wartości ciepła właściwego do obliczeń. W takim przypadku musimy wykorzystać tzw. średnie ciepło właściwe (ciepło przemiany od temperatury t1 do temperatury t2).
Co to jest stosunek Cp/Cv i od czego zależy jego wartość:
Cv nazywamy ciepłem molowym przy stałej objętości. Ilość ciepła niezbędna do podwyższenia temperatury jednego mola gazu o 1K ogrzewanego pod stałym ciśnieniem nosi nazwę ciepła molowego przy stałym ciśnieniu Cp.
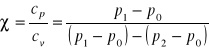
Przykładowa aparatura pomiarowa:
I zasada termodynamiki: Zmiana energii wewnętrznej układu termodynamicznego jest równa sumie ciepła pobranego (lub oddanego) przez układ i pracy wykonanej nad układem przez siły zewnętrzne (lub przez układ nad otoczeniem).
dU = dQ + dW
II zasada termodynamiki:
sformułowanie Plancka: niemożliwe jest zbudowanie maszyny cieplnej działającej cyklicznie, która oziębiałaby zbiornik ciepła i wykonywała prace nie powodując żadnych zmian w przyrodzie.
sformułowanie Clausiusa: żadna pracująca cyklicznie maszyna nie może bez zmian w otoczeniu przenosić w sposób ciągły ciepła z jednego ciała do drugiego o wyższej temperaturze.
Pomiary
Tabela pomiarów:
Lp |
h1 |
p1 |
h2 |
p2 |
χn |
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
Obliczenia
Rachunek błędu
Wnioski
Wyznaczono stosunek ![]()
, który wynosi:
Wyszukiwarka
Podobne podstrony:
fiza sciaga 1, Akademia Morska Szczecin Nawigacja, uczelnia, ore
cw 3 czesc dosw SS, Akademia Morska Szczecin Nawigacja, uczelnia, ore
I strona sprawozdania Naw, Akademia Morska Szczecin Nawigacja, uczelnia, ore
wyznaczanie temperatury curie ferrytu, Akademia Morska Szczecin Nawigacja, uczelnia, ore
PLAN LEKCJI, Akademia Morska Szczecin Nawigacja, uczelnia, ore
wyznaczanie gestosci, Akademia Morska Szczecin Nawigacja, uczelnia, ore
praca wyjscia, Akademia Morska Szczecin Nawigacja, uczelnia, ore
Cpcv, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, fizyka 1 semestr, xzz, Fizyka laborki
sprawdzanie prawa ohma, Akademia Morska Szczecin Nawigacja, uczelnia, ore
Obsługa plików w VBA, Akademia Morska Szczecin Nawigacja, uczelnia, ore
badanie drgan wlasnych, Akademia Morska Szczecin Nawigacja, uczelnia, ore
jos5, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!!!!, Ściśle tajne, Zoo
ratownictwo-poprawione, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!!!!,
Wzmacniacz Operacyjny 2.5, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!!
EURPOEJSKIE PROCESY INTEGRACYJNE, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować
Rezonans szeregowy 1, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!!!!, Ś
Kwity-Łączność-EPECJA, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!!!!,
MF-HF Z PRZYSTAWKĄ DSC- 9+11, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego
więcej podobnych podstron