METODY SORPCYJNE W USUWANIU TOKSYCZNYCH ZANIECZYSZCZEŃ Z WODY
Ćwiczenie A-1
Wyznaczanie izotermy adsorpcji dla układu ciecz- ciało stałe
Celem ćwiczenia jest wyznaczenie izotermy adsorpcji Freundlicha kwasu octowego na węglu aktywnym.
Zadanie to sprowadza się do wyznaczenia doświadczalnego współczynników k i ![]()
w równaniu Freundlicha dla konkretnego węgla aktywnego. Należy ustalić zależność ilości zaadsorbowanego kwasu na jednostkę masy, w zależności od stężenia tego kwasu.
Odczynniki i aparatura
roztwór kwasu octowego (CH3COOH) o stężeniu c=0,540mol/dm3
roztwór wodorotlenku sodowego (NaOH) o stężeniu c=0,1mol/dm3
fenoloftaleina- wskaźnik
węgiel aktywny
zestaw do miareczkowania
wytrząsarka laboratoryjna
szkło laboratoryjne:
- 4kolbek miarowych o pojemności 100 cm3
- 4 kolbek stożkowych ze szlifowanym korkiem
- 4 kolbek stożkowych do sączenia
lejki, pipety, bagietki
- sączki z bibuły o średnie szybkości filtracji
Wykonanie ćwiczenia
W kolbach miarowych o pojemności 100 cm3 należy sporządzono cztery roztwory kwasu octowego o następujących stężeniach: 0,324; 0,216; 0,108; 0,054 mol/dm3 w ilości po 100 cm3 każdego (korzystając z roztworu kwasu octowego o stężeniu 0,54 mol/dm3).
Korzystając z wagi technicznej a następnie analitycznej należy dokładnie odważyono na folii aluminiowej cztery odważki węgla (po około 2 g każda). Następnie odważki węgla wsypano kolejno do czterech kolbek ze szlifem. Później do tych kolbek dodano po 50 cm3 każdego z przygotowanych roztworów kwasu octowego. Kolbki zamknięto szczelnie korkiem i zawartość wytrząsano przez około 10 minut na wytrząsarce. Otrzymane zawiesiny przesączyono, z każdego przesączu pobrano do miareczkowania próbki o objętości 10 cm3, celem oznaczenia stężenia równowagowego kwasu octowego (niezaadsorbowanego). Wszystkie miareczkowania wykonano dwukrotnie.
Wyniki pomiarów
Obliczam wielkość naważek
Tabela 1. Wielkość naważek
Numer roztworu |
Waga techniczna |
Waga analityczna |
||
|
Naczyńko [g] |
Naczyńko + węgiel [g] |
Naczyńko + węgiel [g] |
Węgiel [g] |
1 |
1,8 |
3,8 |
3,6284 |
1,8284 |
2 |
1,8 |
3,8 |
3,7402 |
1,9402 |
3 |
2,3 |
4,3 |
4,4311 |
2,1311 |
4 |
1,6 |
3,6 |
3,7498 |
2,1498 |
Obliczam stężenie kwasu octowego w poszczególnych próbkach przed adsorpcją [mol/dm3]
C1 = 0,54 * 60 / 100 = 0,324 [mol/dm3]
C2 = 0,54 * 40 / 100 = 0,216 [mol/dm3]
C3 = 0,54 * 20 / 100 = 0,108 [mol/dm3]
C4 = 0,54 * 10 / 100 = 0,054 [mol/dm3]
Obliczam stężenie kwasu octowego w poszczególnych próbkach po adsorpcji [mol/dm3]
![]()
= 0,1 mol/dm3
![]()
= odpowiednio: 24,2; 14,1; 6,2; 1,8; cm3
![]()
=10 cm3
![]()
[mol/dm3]
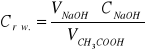
Crów 1 = 24,2 * 0,1 / 10 = 0,242 [mol/dm3]
Crów 2 = 14,1 * 0,1 / 10 = 0,141 [mol/dm3]
Crów 3 = 6,2 * 0,1 / 10 = 0,062 [mol/dm3]
Crów 4 = 1,8 * 0,1 / 10 = 0,018 [mol/dm3]
Obliczam X [mg]
![]()
- objętość kwasu zużyta do adsorpcji (0,05 dm3)
60- masa molowa CH3COOH
![]()
[mg]
X1 = 1000 * 0,05 * (0,324 - 0,242) * 60 = 246
X2 = 1000 * 0,05 * (0,216 - 0,141) * 60 = 225
X3 = 1000 * 0,05 * (0,108 - 0,062) * 60 = 138
X4 = 1000 * 0,05 * (0,054 - 0,018) * 60 = 108
Obliczam log X/m
log X/m1 = log 246/1,8284= 2,1289
log X/m2 = log 225/1,9402= 2,0643
log X/m3 = log 138/2,1311= 1,8113
log X/m4 = log 108/2,1498= 1,7010
Obliczam log Crów
log Crów 1 = log 242 = 2,384
log Crów 2 = log 141 = 2,149
log Crów3 = log 62 = 1,792
log Crów 4 = log 18 = 1,255
Tabela 2. Zestawienie wszystkich wartości
Numer roztworu |
C0 [mol/dm3] |
Crów. [mol/dm3] |
m [g] |
X [mg] |
log |
logCrów. [mmol/dm3] |
1 |
0,324 |
0,242 |
1,8284 |
246 |
2,1289 |
2,384 |
2 |
0,216 |
0,141 |
1,9402 |
225 |
2,0643 |
2,149 |
3 |
0,108 |
062,0 |
2,1311 |
138 |
1,8113 |
1,792 |
4 |
0,054 |
0,018 |
2,1498 |
108 |
1,7010 |
1,255 |
log X/m= 0,4009log C + 1,1667
Parametry izotermy: k= 14,679
n= 2,494
Wnioski
Przeprowadzone doświadczenie pozwoliło na wyznaczenie izotermy adsorpcji Freundlicha kwasu octowego na węglu aktywnym. Równanie izotermy jest następujące: log X/m= 0,4009log C + 1,1667. Wyznaczone parametry izotermy wynoszą k= 14,679, n= 2,494.
Wyszukiwarka