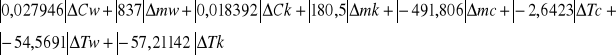Zgodnie z zasadą zachowania energii przy zetknięciu się dwóch lub więcej ciał o różnych temperaturach następuje przepływ ciepła od ciała cieplejszego do ciała zimniejszego. Ciało oddające ciepło obniża swoją temperaturę, a ciało pobierające ciepło - podwyższa. Ciepło jest więc formą energii przekazywanej od jednego ciała do drugiego. Temperatura określa stan cieplny ciała.
Ilość ciepła Q pobranego przy ogrzaniu ciała od temperatury T1 do temperatury T2 (lub oddanego przy jego stygnięciu od T2 doT1 ) zależy od rodzaju ciała i jest proporcjonalna do jego masy m i uzyskanej zmiany temperatury:
Współczynnik proporcjonalności c nazywamy średnim ciepłem właściwym w zakresie temperatur od T1 do T2. Przekształcając w/w zależność otrzymujemy wzór na ciepło właściwe:
Ciepło właściwe jest to ilość ciepła potrzebna do ogrzania jednostki masy ciała o jednostkę temperatury. Jednostka ciepła właściwego jest J/kg·K
Przy pomiarach ciepła właściwego posługujemy się kalorymetrem tak skonstruowanym, aby ciała znajdujące się w jego wnętrzu były odizolowane termicznie od otoczenia. W celu pomiaru ciepła właściwego c ciała, ogrzewamy je do temperatury t1 i umieszczamy w kalorymetrze z wodą o temperaturze początkowej t0. Bliski kontakt ciała z wodą powoduje szybką wymianę ciepła(energii), dzięki czemu ustala się wspólna temperatura t wody, kalorymetru i badanego ciała.
2. Wykonanie i oznaczenie pomiarów mas
mc = 255,20g = 0,25520kg Δmc = 0,01g = 10-5kg
kalorymetr z pokrywką i mieszadełkiem :
mk = 91,96g = 0,09196kg Δmk = 0,01g = 10-5kg
mw = 138,23g = 0,12323kg Δmw = 0,02g = 10-5kg
Zestawienie pomiarów temperatury wody w kalorymetrze
Pomiar prowadzony był bezpośrednio przed włożeniem ciała do układu.
Pomiar temperatury badanego ciała stałego
Zestawienie pomiarów temperatury wody w kalorymetrze po wrzuceniu ciała stałego
Pomiar prowadzony w odstępach 10 sekundowych
Po ustaleniu się temperatury, pomiar prowadzono co 1 min. przez 5 minut
Zestawienie tabelaryczne otrzymanych wyników
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cw [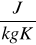
]
|
|
|
8,0 [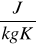
]
|
|
|
Ck [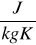
]
|
|
|
0,1 [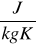
]
|
|
Ciała stałego (wyliczenie)
|
Cx [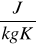
]
|
|
|
6,6 [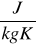
]
|
Wykres temperatury jako funkcji czasu
Wyliczenie ciepła właściwego badanego ciała stałego (ołowiu)
Ciepło właściwe obliczamy ze wzoru :
Cx=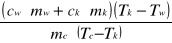
[J/kgK]
Cx=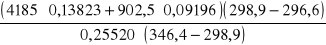
[J/kgK]
Cx= 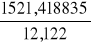
[J/kgK]
Błąd Cx obliczamy na podstawie wzoru metodą różniczki zupełnej :
Δcx=| δcx/δcw|·Δcw+|δcx/δmw|·Δmw+|δcx/δck|·Δck+|δcx/δk|Δmk+|δcx/δmc|·Δmc+
+|δcx/δTc|·ΔTc+|δcx/δTw|+|δcx/δTk|·ΔTk
y = Tk-Tw/mc·(Tc-Tk) y = 0,2
obliczamy pochodne cząstkowe ze wzorów :
δcx/δcw=mw·y; δcx/δmw=cw·y; δcx/δck=mk·y; δcx/δmc=cx/mc;
δcx/δTw= -cx/Tk-Tw; δcx/δmk=ck·y; δcx/δTk= -(δcx/δTk+δcx/δTk)
podstawiamy do wzorów i obliczamy poszczególne składniki sumy :
Δcx= mw·y·Δcw+cw·y·Δmw+mk·y·Δck+ck·y·Δmk+(-cx/mc)Δmc+(-cx/Tc-Tk)·ΔTc+
+(-cx/Tk-Tw)·ΔTw+[-(cx/Tc-Tk)+(-cx/Tk-Tw)] ΔTk
Δcx= 
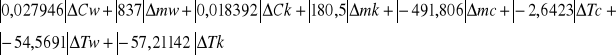
Wartość ciepła właściwego dla ołowiu jaką otrzymaliśmy wyniosła 128,8 J/kg K i jest to wartość bardzo zbliżona do wielkości tablicowej , która wynosi 128 J/kg K.
Wartość błędu bezwzględnego obliczona za pomocą całki zupełnej wyniosła 6,6 J/kg K. Wartość tego błędu jest stosunkowo duża, co z pewnością było spowodowane nieprzestrzeganiem zasad reżimu wykonywania doświadczenia.
Na tak duży błąd mogło wpłynąć niezbyt sprawne przekładanie ołowiu z ultratermostatu do kalorymetru z wodą, a także wlanie małej ilości wody do kalorymetru co mogło mieć wpływ na nieprawidłowe warunki wymiany ciepła i pomiary temperatur. Należy zauważyć że dla poprawnego oszacowania wyniku, należałoby doświadczenie przeprowadzić kilkakrotnie.
![]()
![]()
![]()
![]()
![]()
![]()