![]()
13.05.2005
1. Równowaga reakcji (w sensie kinetycznym) dla reakcji typu: aA + bB cC + dD
![]()
![]()
v - szybkość reakcji (v1 w jedną stronę, v2 w drugą)
k - współczynnik szybkości
(D)nD - stężenie chwilowe
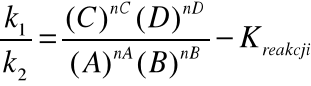
Stała równowagi reakcji przyjmuje wartości od 0 (gdy reakcja nie zachodzi), do ∞ (gdy nie występuje reakcja powrotna).
Stała równowagi reakcji zależy od temperatury i ciśnienia, nie zależy natomiast od stężenia substratów oraz zastosowania katalizatorów
Iloraz stężeń reagentów współczynnikami stechiometrycznymi jest stałą reakcji tylko dla prostych, jednoetapowych reakcji. Gdy reakcje są proste współczynniki kinetyczne są równe współczynnikom stechiometrycznym (ale nie należy zawsze przenosić ich autoamtycznie.
Reakcja biegnie od startu, do momentu równowagi. W równowadze wszystkie składniki (ich stężenia) są w równowadze (stężenia nie ulegają zmianie).
Stała równowagi reakcji nie może być nieskończona, bo gdy produkty (C i D) mają ze sobą styczność, teoretycznie może zachodzić reakcja odwrotna.
Przesunięcie reakcji w prawo duża wartość stałej równowagi.
Na współczynniki szybkości (k1 i k2) katalizatory wpływają jednakowo, stąd stała równowagi (Kr) nie jest zależna od obecności katalizatorów.
Stałe szybkości reakcji oznaczają też prawdopodobieństwo zajścia danej reakcji (duże k duże prawdopodobieństwo zajścia reakcji).
2. Przesuwanie równowagi reakcji
Zmiana stałej równowagi reakcji poprzez zmianę temperatury lub ciśnienia.
Zmiana stężeń reagentów (prawo działania mas Guldberg i Waage)
3. Odwracalność reakcji
Teoretycznie wszystkie reakcje są odwracalne w sensie kinetycznym (0 < Kr < α).
Reakcje nieodwracalne (kinetycznie) to reakcje o dużej wartości stałej równowagi lub takie, które przeprowadzane są w sposób nieodwracalny.
Reakcja jest najbardziej odwracalna gdy k1 = k2 , czyli Kr = 1.
Jeśli Kr ≈ 1, a wciąż zabieramy jeden z produktów reakcji, równowaga nie ustala się, reakcja przesuwa się na prawo. Jeśli zabieramy substrat, przesuwamy reakcje na lewo.
Przykładami przesuwania równowagi reakcji są: wydzielanie się gazów, wytrącanie się osadów, sprzęganie z innymi reakcjami.
4.Teorie kinetyczne (modele)
teoria zderzeniowa (zderzeń efektywnych) dobra dla reakcji w fazach gazowych
teoria kompleksu aktywnego (pośredniego / przejściowego) lepsza dla reakcji w fazach ciekłych.
Obie teorie uzupełniają się wzajemnie.
W fazach stałych reakcje zachodzą bardzo powoli.
5. Podstawy teorii zderzeniowej.
konieczność zderzeń cząsteczek
tylko zderzenia efektywne powodują reakcję (Ekinetyczna > Eaktywacji)
reakcja chemiczne jest sekwencją etapów (aktów) elementarnych (N), przykładowo reakcja 4NH3 + 5O2 4NO + 6H2O jest reakcja wieloetapową
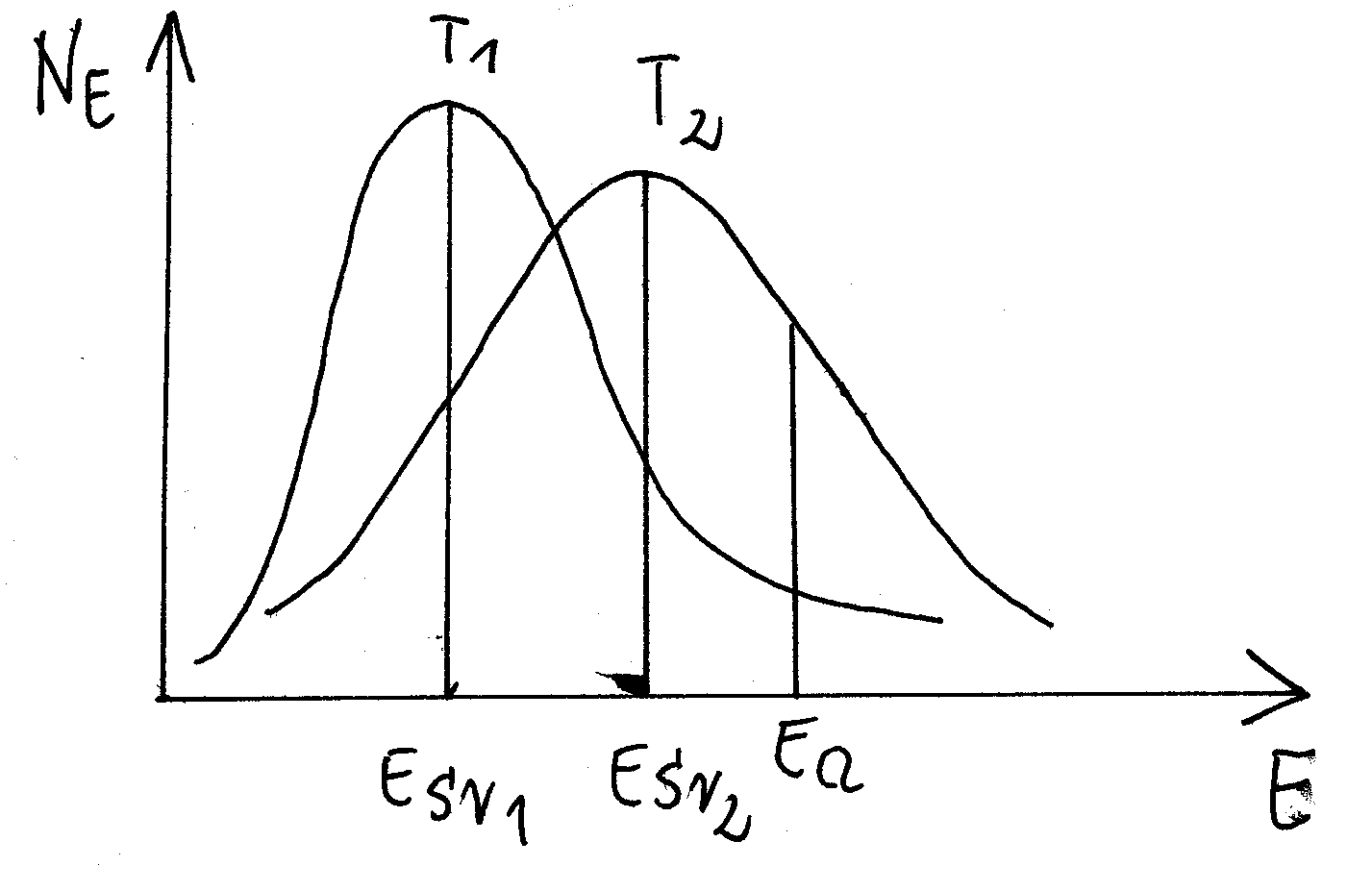
rozkład Boltzmana: ![]()
NE - ilość cząsteczek w zbiorze o danej energii
T - temperatura
Ea - energia aktywacji
Eśr - energia średnia
Aby zaszła reakcja musi nastąpić zderzenie z odpowiednio wysoką energią (zderzenie efektywne - to takie, które przekracza określony próg energii).
W fazie gazowej zderzenia nie są zbyt częste, spośród tych zderzeń tylko niektóre są efektywne.
Im więcej cząsteczek ma zderzyć się jednocześnie, tym mniejsze prawdopodobieństwo zajścia reakcji.
Akt elementarny to przekształcenie cząsteczek po pojedynczy zderzeniu; makroskopowo = etap reakcji.
6. Znajomość sekwencji aktów elementarnych = znajomość mechanizmu reakcji, np.
H2 + I2 2HI - rekcja jednoetapowa (w tej teorii)
H2 + Br2 2HBr - rekcja wieloetapowa:
Br2 2Br
Br + H2 HBr + H
H + Br2 HBr + Br
2Br Br2
Etap najwolnejszy to etap limitujący; decyduje on o szybkości całej przemiany
7. Teoria kompleksu aktywnego jest teorią nowszą, niż poprzednia.
nie wyklucza postulatów teorii zderzeniowej.
Dodatkowo zakłada, że zderzenie prowadzi do powstania nietrwałego kompleksu aktywnego:
A + BC AB + C
A + BC ABC AB + C (według teorii), np:
H2 + I2 2HI
H2 + I2 H2I2 2HI
Szybkość reakcji zależy od:
stężenia kompleksu aktywnego
szybkości rozpadu tego kompleksu na produkty
Teoria włącza energię potencjalną pochodzącą od oddziaływania cząstek reagujących energii aktywacji.
Tworzenie się kompleksu aktywnego towarzyszą napięcia, które oddawane są w momencie rozpadu kompleksu (na produkt lub kolejne kompleksy)
7. Kataliza czyli reakcja z katalizatorem
Katalizator to reagent przyspieszający reakcję i odtwarzany do postaci pierwotnej (w efekcie produkt staje się z powrotem substratem). ZATEM BIERZE UDZIAŁ W REAKCJI !!!
Inhibitor to katalizator ujemny (spowalniacz); w biochemii jest to substancja zatruwająca enzym; przyłącza się do enzymu w miejscu wiążącym substrat.
8. Podział katalizatorów / inhibitorów ze względu na mechanizm działania:
homogeniczne - występujące w tej samej fazie, co reagenty; są specyficzne
heterogeniczne - w innej fazie, niż reagenty - kontakt powierzchniowy (np. nikiel w produkcji margaryny w procesie uwodornienia - nasycenia); są niespecyficzne (katalizują różne reakcje)
Biokataliza - enzymy - mechanizm homogeniczny - kinetyka zgodna z teorią kompleksu aktywnego
9. Mechanizmy katalizy:
adsorpcyjny (kataliza heterogeniczna); np. w pomarszczonych ziarnkach proszku (lub innego stałego katalizatora) stosunek powierzchni do objętości jest bardzo duży; powierzchnia łapie substancje siłami van der Waalsa (adsorpcja, czyli pochłanianie na powierzchni)
tworzenie kompleksu aktywnego z katalizatorem (kataliza homogeniczna)
kataliza kwasowa - jon H+ jest dobrym akceptorem dla wolnych par elektronowych - często związki uprotonowane wchodzą w reakcję o mniejszej energii aktywacji - większa szybkość (kataliza homogenna)
Zatrucie katalizatora to obniżenie lub utrata aktywności katalitycznej inhibicja biokatalizatorów (enzymów).
Zderzenie jest efektywne, gdy ma odpowiednią energię i orientację (cząsteczki muszą być odpowiednio ustawione); adsorpcja dostarcza czynnika orientacyjnego (cząsteczki są adsorbowane w określony sposób) ilość zderzeń efektywnych rośnie.
Energia aktywacji (progowa) zmienia się pod wpływem temperatury lub katalizatora. Katalizowanie powoduje obniżenie energii aktywacji lub jej całkowite ominięcie (w przypadku wielu etapów o niskiej energii aktywacji)
10. Mechanizm katalizy enzymatycznej (według Michaelisa - Menten)
![]()

Szybkość reakcji zależy od stężenia enzymu - równanie kinetyczne nie jest linowe względem substratu.
Reakcja etapowa
E + S ES - v1 = k1 (S)(E) - szybkość tworzenia kompleksu
ES E + S - v2 = k2 (ES) - szybkość rozpadu kompleksu
ES P + E - v3 = k3 (ES) - szybkość zużywania kompleksu i tworzenia produktu
Etapem limitującym (decydującym o szybkości tworzenia produktu) jest etap 3 (równanie powinno zawierać zatem stężenie ES. Przy tym założeniu oraz przy założeniu, że
(E) + (ES) = Ec, Michaelis i Menten wyprowadzili wzór:
![]()
gdzie ![]()
i ![]()
11. Teorie elektrolitów - rozpad substancji umieszczonych w rozpuszczalnikach polarnych
Teoria Arrheniusa (roztwory wodne)
Woda jest słabym elektrolitem.
Elektrolity to substancje zdolne do przewodzenia prądu (przewodniki II-go rzędu) w roztworach wodnych.
Do substancji dysocjujących zaliczamy substancje, których cząsteczki związane są wiązaniem jonowym lub kowalencyjnym spolaryzowanym.
Czynnikiem dysocjującym jest rozpuszczalnik.
AB A+ + B-
Teoria Bronsteada - Lowryego
4
chemia fizyczna wykład z 13.05.2005
![]()
![]()
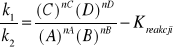
![]()