Nitrowe pochodne benzenu
Przez bezpośrednie nitrowanie benzenu można wprowadzić bez większych kłopotów jedną lub dwie grupy nitrowe. Wprowadzenie grupy trzeciej przebiega z dużym trudem i małą wydajnością. Dlatego też TNB otrzymuje się drogą pośrednią. Znane są również wyżej nitrowe pochodne benzenu - tetra- i heksanitrobenzen, które można otrzymać metodami pośrednimi. Największe znaczenie praktyczne jako materiał wybuchowy ma dinitrobenzen. Stanowi on najpoważniejszą namiastkę TNT.
Nitrobenzen - własności fizyczne
NB jest silnie toksyczną cieczą o żółtawym zabarwieniu i zapachu gorzkich migdałów tk = - 57°C, tw = 210°C. Otrzymany w 1834 przez Mitcherlicha przez nitrowanie benzenu mieszaniną nitrującą. Łatwy do wydzielenia z mieszaniny ponitracyjnej ponieważ w H2SO4 o stężeniu mniejszym od 70% jest praktycznie nierozpuszczalny (< 0,02%). W wodzie rozpuszcza się bardzo słabo. Dobrze rozpuszcza się w eterze dietylowym, etanolu i benzenie. NB jest trucizną dla układu nerwowego i wątroby, tworzy w krwi metahemoglobinę, dopuszczalne stężenie w powietrzu wynosi 5 mg/m3. Dawniej był stosowany jako substancja zapachowa przy produkcji mydła.
Nitrobenzen - właściwości chemiczne
NB jest odporny wobec kwasów. Gotowanie z NaOH w r-rze EtOH prowadzi do częściowej redukcji z utworzeniem azoksybenzenu
Redukcja NB może prowadzić do otrzymania rozmaitych produktów zależnie od warunków reakcji i użytego środka redukującego. Ostatecznym produktem redukcji jest anilina.
Nitrobenzen - otrzymywanie
Otrzymywanie NB polega na nitrowaniu benzenu mieszaniną nitrującą o składzie:
HNO3 - 27-28%
H2SO4 - 56-58%
H2O - 14-17%
Ilość mieszanki oblicza się z niewielkim 1% nadmiarem HNO3. Do nitratora, w którym utrzymywana jest temperatura na poziomie 50÷60oC, w sposób ciągły podaje się benzen i mieszaninę nitrującą ze zbiorników naporowych. Z nitratora mieszanina poreakcyjna ścieka do separatora-odstojnika gdzie oddziela się warstwę nitrozwiązku od kwasów. Następnie nitrobenzen kierowany jest na wymywanie natomiast kwasy odpadkowe są częściowo zawracane do nitratora a częściowo kierowane do denitracji. Otrzymany NB przemywa się H2O, a następnie 2-3,5% roztworem NaOH; na koniec znów H2O i w końcu poddaje się go próżniowemu suszeniu. Wydajność reakcji wielkoskalowej osiąga 98%.
Nowsze sposoby polegają na ciągłym nitrowaniu benzenu czystym kwasem azotowym połączonym z odparowaniem wody wydzielającej się w procesie lub też wykorzystujące rektory rurowe, w których mieszanie strug reagentów realizowane jest podczas ich burzliwego przepływu w takim reaktorze.
Nitrobenzen - zastosowanie
Nitrobenzen szeroko wykorzystuje się w produkcji barwników. Jest substratem do otrzymywania aniliny i benzydyny i innych półproduktów w syntezie barwników i medykamentów.
Dinitrobenzeny DNB
Znane są trzy izomeryczne postacie DNB - meta, orto i para
tt 91°C tt 118°C tt 172°C
tw 303°C tw 318°C tw 299°C
Są to substancje krystaliczne o barwie żółtej i znacznej toksyczności - stężenie dopuszczalne 1mg/m3. Techniczny DNB składa się głównie z m - DNB. Izomery orto i para powstają w ilości ok. 8%. Temperatura tej mieszaniny wynosi 80-82°C. Temperatura topnienia DNB do celów wybuchowych powinna wynosić 88-89°C. DNB był stosowany w okresie I wojny światowej przez Niemców i Rosjan w zastępstwie TNT - później został wycofany z użycia z powodu dużej toksyczności.
m-DNB - właściwości fizyczne i wybuchowe
Rozpuszcza się w acetonie, benzenie i toluenie, słabo w alkoholu. Krzepnie w masę o gęstości 1,5g/cm3, prasowany przy ciśnieniu 60 MPa daje gęstość 1,44 g/cm3. Jest stabilny w podwyższonych temperaturach, mało wrażliwy na bodźce mechaniczne. Parametry detonacyjne m-DNB są niższe niż dla TNT (o ok. 13%). Pobudzenie do detonacji wymaga użycia silnego detonatora.
Wzór sumaryczny C6H4N2O4
Masa molowa 168,1
Qtw 80,58 kJ/kg
ΔHtw 154,3 kJ/kg
BT - 95,18%
ρ 1,5 g/cm3
Qw 3643 kJ/kg
Vo 850 l/kg
wydęcie 242 cm3
D1,47 6100 m/s
Temp. wyfuk. 291°C
Wraż. udar 39 Nm
Wraż. tarcie pow. 360 N
Może być elaborowany jako samodzielny MW zarówno w operacjach prasowania jak i odlewania.
DNB - właściwości chemiczne
Spośród trzech izomerycznych postaci DNB najmniej reaktywny jest m-DNB. Wszystkie trzy DNB są odporne na działanie stężonych kwasów, natomiast są dość wrażliwe na działanie alkalii.
m - DNB pod działaniem 20% r-ru NaOH w temperaturze wrzenia ulega redukcji na jednej z nitro grup dając 3,3-dinitroazoksybenzen:
m-DNB z KCN w MeOH tworzy oksymetylonitrobenzonitryl:
o i p - DNB reagują z siarczynem sodu tworząc odpowiednie kwasy nitrosulfonowe:
m-DNB trudniej reaguje z siarczynem sodu dzięki czemu reakcję tę stosuje się obecnie do usuwania izomerów o i p z DNB technicznego.
DNB - otrzymywanie
DNB początkowo otrzymywano przez gotowanie benzenu w stężonym HNO3 (Deville - 1841r.). Obecnie stosuje się do nitrowania mieszaninę nitrującą wykorzystując metodę dwustopniową o charakterze ciągłym.
Nitrowanie (II et) prowadzi się w temperaturze 80÷90°C w aparaturze analogicznej do stosowania w procesie otrzymywania trotylu. Jeżeli współczynnik aktywności nitrującej Φ mieszaniny nitrującej wynosi 86%, to produkt nitrowania otrzymywany w temperaturze 75-80°C składa się z trzech izomerów:
meta orto para
zaw.[%] 90-91 8-9 1-2
tt 89,7 116,5 172,1
Temperatura topnienia technicznego DNB wynosi ok. 81°C. Izomery o- i p- są niepożądanymi domieszkami. Wydajność izomeru meta- zależy od temperatury nitrowania i wraz z jej wzrostem powoli spada. W celu oddzielenia izomerów o- i p- produkt techniczny poddaje się wymywaniu za pomocą wodnego roztworu siarczynu sodowego. Proces prowadzony jest w temperaturze 65oC (produkt w stanie stałym) ponieważ już w 79oC w reakcję wstępuje interesujący nas izomer meta. Po odsączeniu, m-DNB przemywa się wodą w celu usunięcia siarczynu sodu a następnie, po usunięciu resztek wody przez dekantację, m-DNB poddaje się suszeniu w stanie stopionym w kadzi suszarkowej (16 m3) pod zmniejszonym ciśnieniem w temperaturze 120°C. Gotowy produkt topi się w temperaturze 89,5oC co oznacza, że jest to praktycznie czysty izomer meta
Dużą zaletą DNB jako MW to niezwykle szeroka baza surowcowa. Wadą jest natomiast wysoka toksyczność. W stanie wojny jego produkcja może być znacząca. Możliwe jest prowadzenie procesu nitrowania w instalacjach do produkcji TNT. Postępuje się tak gdy występują braki toluenu.
Czysty o- i p- DNB można otrzymać z odpowiednich nitroamin przez dwuazowanie lub utlenianie
Trinitrobenzeny
Znane są trzy izomery trinitrobenzenu
tt 122,5°C tt 62°C tt 127,5°C
Wszystkie z nich są krystalicznymi silnie toksycznymi substancjami zabarwionymi na żółto. Najbardziej dostępny i najtrwalszy pod względem chemicznym jest sym-trinitrobenzenu. Nie znalazł jednak praktycznego zastosowania jako MW (pomimo korzystniejszych parametrów detonacyjnych od TNT), gdyż otrzymywanie jego jest zbyt kosztowne. Np. nitrowanie, DNB → TNB mieszaniną:
100g HNO3
na 60g DNB
1000g oleum
daje po 9 dniach TNB z 50% wydajnością.
sym-TNB - właściwości fizyczne i wybuchowe:
Substancja krystaliczna o żółtym kolorze. Nierozpuszczalny w wodzie, dobrze rozpuszczalny w acetonie, octanie etylu i chloroformie. Tworzy eutektyki z innymi związkami polinitrowymi, w tym z azotanami. Stabilność s-TNB jest wyższa niż stabilność TNT. Pod względem wrażliwości na uderzenie można go porównać do heksogenu - detonuje od spadku 2kg odważnika z wysokości 46 cm.
Wzór sumaryczny C6H3N3O6
Masa molowa = 213,1
Qtw = 97,1 kJ/kg
ΔHtw = 166,7 kJ/kg
BT = -56,3%
Vo = 678 l/kg
Qv = 4899 kJ/kg
ρ = 1,76 g/cm3
D1,71 = 7300 m/s
VPb = 325 cm3
Wraż. udar = 7,4 Nm
Wraż. tarcie = pow. 360 N
sym-TNB - właściwości chemiczne
Podobnie jak inne polinitrozwiązki aromatyczne jest odporny na działanie kwasów. Łatwo reaguje z zasadami, np z alkoholowymi roztworami wodorotlenku sodu lub potasu daje zabarwione na czerwono związki metaloorganiczne, uznawane za anionowe kompleksy σ (kompleksy Meisenheimera) i charakteryzujące się niską terperaturą wyfuknięcia oraz wysoką wrażliwością na bodźce mechaniczne.
Gotowanie z wodnym rozcieńczonym roztworem NaOH daje dinitrofenolan z niewielką ilością tetranitroazoksybenzenu.
Redukcja prowadzi do różnych produktów zależnie od użytego reduktora i warunków reakcji:
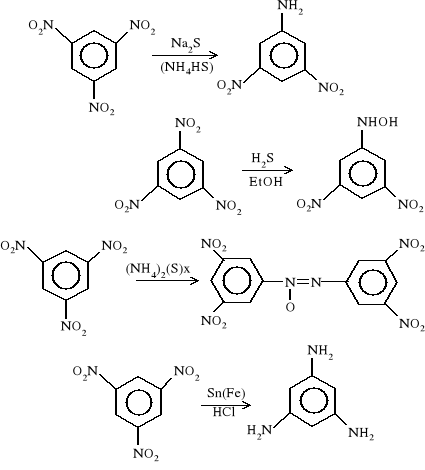
sym TNB - otrzymywanie
Otrzymywanie sym-TNB realizuje się metodami pośrednimi wykorzystując reaktywniejsze związki nitrowe np. trotyl (lub trinitrometaksylen) albo chlorotinitrobenzen.
Niesymetryczne izomery TNB można otrzymać przez dwuazowanie odpowiednich di nitrowych pochodnych aniliny
Tetranitrobenzeny
Znane są dwa izomery tetranitrobenzenu a mianowicie 1,2,3,5- i 1,2,4,5-
Obydwa są mało stabilne i ulegają rozkładowi pod wpływem wilgoci. Izomer 1,2,3,5- hydrolizuje z wydzieleniem kwasu pikrynowego. Woda amoniakalna powoduje jego ilościowe przejście w pikramid. Metanolan sodu w metanolu przekształca go w trinitroanizol.
Tetranitrobenzen jest wysokoenergetycznym MW jego zdolność do wykonania pracy jest o 60% wyższa niż dla TNT. Przy gęstości 0,7 g/cm3 detonuje z prędkością 5380 m/s. Dla TNB D0,7≅ 4000 m/s. Jest bardzo wrażliwy na bodźce mechaniczne.
Tetranitrobromobenzeny otrzymuje się metodami pośrednimi. Izomer 1,2,3,5- powstaje z pikramidu przez etap diazowania albo z trinitroamizolu przez etap reakcji z hydroksyloaminą.
Tetranitrobenzeny nie znalazły zastosowania jako MW.
Heksanitrobenzen (HNB)
Właściwości fizykochemiczne i wybuchowe. Heksanitrobenzen (HNB) jest białą, krystaliczną substancją z lekkim żółtym lub zielonkawym odcieniem, topiącą się w temperaturze 246÷265°C. Gęstość jego kryształów wynosi 2,0 g/cm3. Zerowy bilans tlenowy i duża gęstość sprawiają, że HNB charakteryzuje się bardzo wysokimi parametrami detonacyjnymi. Przy gęstości 1,97 g/cm3 detonuje z prędkością 9340 m/s. Ciśnienie jego detonacji jest równe 42GPa i jest to najwyższa zarejestrowana wartość ciśnienia detonacji wśród wszystkich znanych materiałów wybuchowych. Kalorymetrycznie wyznaczone ciepło detonacji HNB ma wartość 6920±70 kJ/kg. W produktach detonacji występują głównie dwutlenek węgla (5,88 mola/mol HNB) i azot (2,96 mola N2/mol HNB).
Poważną wadą HNB jako materiału wybuchowego jest jego niska trwałość. Pod wpływem światła słonecznego, w kontakcie z czynnikami atmosferycznymi (parą wodną), ulega przekształceniu do 1,3,5-trihydroksy-2,4,6-trinitrobenzenu (THTNB). Proces ten jeszcze szybciej przebiega pod wpływem wodnych roztworów wodorotlenku sodowego lub potasowego (w 75 °C w ciągu 25 min.).
Ogólnie można powiedzieć, że HNB charakteryzuje się dużą reaktywnością w stosunku do czynników nukleofilowych. Z wodnym roztworem NaOH daje z 99% wydajnością trinitrofluoroglucynę. W roztworze benzenowym w reakcji z amoniakiem przekształca się z 95% wydajnością w TATB. Z halogenowodorami reaguje z utworzeniem pentanitrohalogeno-benzenów (za wyjątkiem HF). Umożliwia to syntezę unikalnych związków polinitro-aromatycznych, szczególnie że dihalogenowe pochodne nie powstają. Reakcja zachodzi podczas przepuszczania halogenowodorów przez benzenowy roztwór HNB. Wydajność wynosi 100% dla HCl i HBr i ok. 72% dla HJ już po 30 min (w temp. 25°C). Jon azydkowy również podstawia jedną grupa nitrową w HNB. Benzenowy roztwór HNB mieszaniny z wodnym roztworem NaN3 daje pentanitroazydobenzen z 95% wydajnością.
Otrzymywanie HNB. Związek ten otrzymuje się przez utlenienie pentanitroaniliny (PNA). Reakcja zachodzi pod wpływem stężonego nadtlenku wodoru (H2O2) w środowisku 20 % oleum lub w środowisku kwasu trifluorometanosulfonowego (CF3-SO3H). W pierwszym przypadku do roztworu PNA w oleum, ogrzanego do 25÷30 °C wprowadza się 98 % H2O2, natomiast w drugim zalecane jest stosowanie 90 % H2O2 i prowadzenie reakcji w temperaturze 45÷55 °C. Wydajność reakcji wynosi odpowiednio 58 % i 90 %.
Produkt (HNB) ekstrahuje się z mieszaniny poreakcyjnej za pomocą dichlorometanu.
Wyjściową pentanitroanilinę otrzymuje się z trinitrobenzenu w wyniku następującego łańcucha reakcyjnego:
Benzotrifuroksan (BTF)
Właściwości fizykochemiczne i wybuchowe. Benzotrifuroksan (BTF) jest stabilną, niehigroskopijną substancją o gęstości 1,901 g/cm3, topiącą się w temperaturze 197°C. Jego wrażliwość na bodźce mechaniczne jest zbliżona do wrażliwości pentrytu, ale jednocześnie charakteryzuje się większą odpornością termiczną i w związku z tym proponuje się go jako zastępczy materiał wybuchowy w stosunku do tego ostatniego. BTF jest wysokoenergetycznym materiałem wybuchowym o parametrach detonacyjnych porównywalnych z parametrami materiałów wybuchowych na bazie oktogenu. Eksperymentalne ciepło detonacji BTF (ładunek o masie 22 g i gęstości 1,84 g/cm3) wynosi 5904 kJ/kg. W produktach detonacji 1 mola tego materiału wybuchowego występuje 2,93 mola N2; 1,56 mola CO2; 2,87 mola CO i 1,57 mola węgla. Duże ciepło detonacji i brak wodoru w cząsteczce sprawiają, że materiał ten charakteryzuje się wyjątkowo wysoką temperaturą detonacji. Obliczona wartość tego parametru wynosi około 4700 K. BTF zaprasowany do gęstości 1,859 g/cm3 detonuje z prędkością 8480 m/s. Ciśnienie jego detonacji wynosi 36 GPa.
Interesujące i rzadko spotykane właściwości BTF jako materiału wybuchowego (brak wodoru w cząsteczce, wysokie parametry detonacyjne) powodują, że proces jego detonacji jest częstym obiektem badań. Proponuje się między innymi wykorzystanie go do detonacyjnej syntezy ultradyspersyjnego diamentu. Występowaniu tej odmiany węgla w produktach detonacji BTF sprzyja wysoka temperatura jego detonacji.
Otrzymywanie BTF. Benzotrifuroksan został otrzymany w 1931 roku na drodze ogrzewania 1,3,5-triazydo-2,4,6-trinitrobenzenu (TATNB). Do chwili obecnej ogrzewanie orto-azydonitroarenów jest ogólną metodą syntezy związków benzofuroksanowych.
Wyjściowym związkiem do syntezy BTF jest 1,3,5-trichlorobenzen (TCB), który najpierw poddaje się nitrowaniu do 1,3,5-trichloro-2,4,6-trinitrobenzenu (TCTNB).
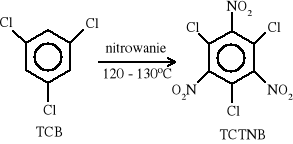
Nitrowanie prowadzi się za pomocą dymiącego kwasu azotowego lub przy wykorzystaniu mieszanin nitrujących zawierających stężony kwas azotowy i siarkowy albo azotan sodu i 20% oleum. Reakcja zachodzi w temperaturze 120÷130°C.
W drugim etapie TCTNB, wprowadzany małymi porcjami w temperaturze pokojowej do roztworu azydku sodu w 95% etanolu, daje 1,3,5-triazydo-2,4,6-trinitrobenzen (TATNB).
Strącony TATNB, wprowadza się do dużego nadmiaru kwasu propionowego (CH3CH2COOH) i całość ogrzewa do temperatury 140°C. Po zakończeniu wydzielania się azotu mieszanina poreakcyjna jest chłodzona i powoli mieszana z dużą ilością wody.
Surowy produkt jest oczyszczany przez krystalizację z benzenu. Tworzący się przy tym kompleks BTF-benzen ulega dekompozycji podczas ogrzewania go w temperaturze 80°C pod obniżonym ciśnieniem, uwalniając BTF o wysokiej czystości.
1
- reakcji tej nie ulega m-DNB, co kiedyś wykorzystywano do usuwania izomerów o i p z technicznego DNB
W drugim etapie stosuje się większy nadmiar HNO3 (do 10%) oraz wyższe są stężenia kwasów np. stosowana jest mieszanina o składzie: HNO3 - 30%, H2SO4 - 67%, H2O - 3%
peroksydisiarczan
Wyszukiwarka