Ćwiczenie nr 21
BADANIE SZYBKOŚCI REAKCJI
JODOWANIA ACETONU
Celem ćwiczenia jest określenie wartości stałej szybkości reakcji jodowania acetonu.
Aparatura i szkło: Odczynniki:
Mieszadło magnetyczne skrobia (wskaźnik)
Kolby miarowe o poj. 500 i 250 cm3 0,1 M J2 w 4% KJ
Erlenmajerki o poj. 250 cm3 - 3 szt. 1 M HCl
Biureta o poj. 50 cm3 0,1 M NaHCO3
0,01 N Na2S2O3
1 M r-r acetonu
WYKONANIE ĆWICZENIA:
Do kolby miarowej o poj. 250 cm3 wlać 25 cm3 0,1M J2 w 4% KJ, dodać 25 cm3 1M HCl i dopełnić wodą destylowaną do objętości ok. 200 cm3. Następnie wprowadzić 25 cm3 1M r-ru acetonu - włączyć stoper - uzupełnić (możliwie szybko) zawartość kolby wodą destylowaną do kreski i wymieszać.
Z tak przygotowanej mieszaniny reakcyjnej pobrać próbkę o obj. 25 cm3 i wlać do erlenmajerki zawierającej 25 cm 0,1M NaHCO3. Moment pobrania próbki zanotować! Roztwór w kolbce stożkowej miareczkować 0,01N Na2S2O3 w obecności wskaźnika skrobiowego ( 2 - 3 krople). Kolejne próbki do miareczkowania należy pobierać po upływie: 10, 30, 45, 60, 80, 100, 120 i 140 minut od chwili dodania acetonu.
W czasie miareczkowania próbek mieszaniny reakcyjnej mianowanym roztworem 0,01 M Na2S2O3 , roztwór skrobi dodajemy pod koniec miareczkowania.
OPRACOWANIE WYNIKÓW:
Reakcja jodowania acetonu przebiega zgodnie z równaniem:
CH3COCH3 + J2 → CH3COCH2J + H+ + J-
i jest zaliczana do reakcji autokatalitycznych (katalizator : jony H+). Zachodzi w dwóch etapach:
CH3─C─CH3 ↔ CH3─C═CH2 + J2 → CH3─C─CH2J + H+ + J-
║ │ ║
O OH O
Etap powstawania formy enolowej jest powolny. Szybkość tworzenia się jodoacetonu jest proporcjonalna do stężenia jonów H+ oraz początkowego stężenia acetonu i nie zależy od stężenia jodu. Dla tego konkretnego przypadku szybkość reakcji autokatalitycznej określa równanie:
![]()
,
a po scałkowaniu otrzymuje się ostatecznie wyrażenie:
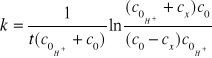
,
gdzie: ![]()
- początkowe stężenie acetonu,
![]()
- początkowe stężenie jonów H+ ,
cx - stężenie przereagowanego acetonu.
Temperatura doświadczenia...................
Ilość 1M HCl..................
Wyniki zanotować w tabeli:
nr |
Czas reakcji
[min.] |
Ilość 0,01N Na2S2O3
[cm3] |
C0 CH3COCH3
[val dm-3] |
Początkowe stężenie jonów H3O- [val cm-3] |
Cx
[val cm-3] |
k |
|
|
|
|
|
|
|
Stężenie przereagowanego acetonu cx obliczamy z równania:
![]()
,
gdzie: nt - ilość 0,01N Na2S2O3 zużyta do miareczkowania,
no - ilość 0,01N Na2S2O3 zużyta do miareczkowania na początku reakcji,
![]()
- stężenia normalne roztworu tiosiarczanu sodu.
Wartość no wyznaczyć graficznie, wykreślając zależność n = f(t) i ekstrapolując prostą do t = 0. Po obliczeniu wartości co , ![]()
, cx , wyliczyć stałą szybkości reakcji k.
Wyszukiwarka