1. Zaprojektować izotermiczny reaktor okresowy oraz izotermiczny reaktor zbiornikowy przepływowy dla reakcji I- rzędowej:
C2H4O+H2o→HO-CH2-CH2-OH
Wydajność produkcyjna reaktora ma wynosić Lp=900[kg] glikolu etylenowego na godzinę (dla reaktora okresowego nie uwzględniać okresów załadunku i rozładunku). Stopień przemiany αA=0,6 (A - tlenek etylenu, B - woda, C - glikol etylenowy). Gęstość mieszaniny należy przyjąć jako stałą, wynoszącą 1000[kg/m3]. Woda doprowadzana jest z trzykrotnym nadmiarem. Stała szybkości reakcji k=9,81∙10-4[s-1].
a) reaktor okresowy
woda doprowadzana z trzykrotnym nadmiarem

b) reaktor zbiornikowy przepływowy
Reaktor zbiornikowy z idealnym mieszaniem:
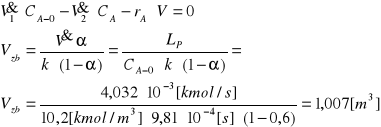
2. Proces otrzymywania glikolu etylenowego, opisany w poprzednim zadaniu, prowadzono w identycznych warunkach, z tym że zamiast pojedynczego reaktora zbiornikowego zastosowano kaskadę 3 reaktorów o tej samej sumarycznej objętości. Porównać stopnie przemiany i wydajność dla przypadku, gdyby zastosowano aparaty o objętościach 0,2 0,3 0,507[m3] oraz dla przypadku, w którym stopnie kaskady miały by równe pojemności.
3. Należy wyprodukować 50000[kg/dobę] octanu etylu z alkoholu etylowego i kwasu octowego, przy czym reakcję opisuje następujące równanie:
C2H5OH+CH3COOH=CH3COOC2H5+H2O
Szybkość reakcji w fazie ciekłej określona jest równaniem:
RB=k[CACB-CpCQ/KC]
Gdzie A - C2H5OH, B - CH3COOH, P - CH3COOC2H5, Q - H2O.
Znaleziono eksperymentalnie k=7,93∙10-6[m3/kmol∙s], a stała równowagi KC=2,93.
Skład surowca jest następujący:
x0A=0,46[kgA/kg miesz] ; x0B=0,23[kgB/kg miesz] ; x0Q=0,31[kgQ/kg miesz].
Reakcję należy prowadzić do αB=0,35. przyjąć stałą gęstość wynoszącą ρ=1020[kg/m3]. Obliczyć wielkość reaktora zbiornikowego przepływowego, który jest niezbędny do zapewnienia żądanej produkcji.
4. Do reaktora z idealnym mieszaniem dopływa 10-4[m3/s] surówki zawierającej składnik A.Stężenie składnika A w surówce wynosi 1,44[kmol/m3]. W reaktorze zachodzi reakcja według równania stechiometrycznego: A→B+C. Z przeprowadzonych doświadczeń wynika, że równanie kinetyczne tej reakcji należy zapisać następującym wzorem r=k∙c0,5. Stała szybkości reakcji wynosi 1,28∙10-4[s-1kmol0,5m-1,5]. Znaleźć objętość reaktora zapewniającą uzyskanie konwersji równej 0,64.
5. Reakcję odwracalną A+B=R+S, zachodzącą w fazie ciekłej, należy przeprowadzić w ciągłym reaktorze zbiornikowym o pojemności 120[dm3]. Stałe szybkości reakcji wynoszą k1=7[dm3/mol∙min] k2=3[dm3/mol∙min]. Reaktor jest zasilany dwoma strumieniami o koncentracjach: C0A=2,8[mol/dm3] i C0B=1,6[mol/dm3], przy czym objętościowe natężenia przepływu obu strumieni są identyczne. Jakie powinny być natężenia przepływu, jeśli żądana jest 75%konwersja składnika B? Gęstość mieszaniny reagującej może być uważana za niezmienną.
6. Zaprojektować okresowy reaktor izotermiczny, w którym przebiega r-cja I-rzędowa: A→B, do wyprodukowania 100[kgB/h], gdzie MB=80[kg/kmol], stała szybkość reakcji k=0,1[s-1], stopień przereagowania składnika A wynosi 0,99, stężenie początkowe składnika A CA0=0,2[kmol/m3]. Założyć stała gęstość. Znaleźć objętość reakcyjną.
7. Dla pewnej reakcji I-rzędu można dobrać reaktor zbiornikowy z idealnym wymieszaniem lub rurowy z przepływem tłokowym. Jaki będzie stosunek objętości reaktora zbiornikowego do rurowego , jeżeli reakcja jest nieodwracalna, a stopień przemiany wynosi 0,8? Założyć stałą gęstość i takie same objętościowe natężenia przepływu w obu reaktorach.
8. Reakcję estryfikacji ftalanu ortylowego alkoholem ortylowym prowadzi się w izotermicznym reaktorze zbiornikowym przepływowym w temp. 170°C w obecności tytanianu butylowego jako katalizatora homogenicznego. Reakcja zachodzi w fazie ciekłej według równania :
F + A → FO + W
Ftalan jednooktylowy alkohol oktylowy ftalan oktylowy woda
Reakcja jest praktyczne nieodwracalna ze względu na natychmiastowe wyprowadzenie wody ze środowiska reakcji. Jest to reakcja II-rzędu, rF = k cF cA. Stała szybkość k=0,02[m3/kmol min]przy stosowanym stężeniu katalizatora CK=0,0096[mol/dm3]. Przyjąć , że gęstość mieszaniny reakcyjnej jest stała i wynosi Qm=0,849[kg/m3].alkochol ortylowy jest użyty w nadmiarze przy czym:
![]()
1). Określić zastępczy czas przebywania (średni czas przebywania) niezbędny dla osiągnięcia stopnia przemiany ftalany jednooktylowego αF=0,99.
2). Wyznaczyć objętość przestrzeni reakcyjnej przy założonej zdolności produkcyjnej Lp=7500∙103[kg/rok] ftalany ortylowego i dla stopnia przemiany αF=0,99.

Wyszukiwarka