Pomiar entalpii parowania wysoko wrzącej cieczy
Parowanie cieczy jest procesem polegającym na przechodzeniu cząstek cieczy z jej swobodnej powierzchni w stan gazowy. Jeżeli proces ten odbywa się w naczyniu zamkniętym, częściowo wypełnionym tylko cieczą, to w każdej temperaturze ustala się stan równowagi , w którym liczba cząsteczek przechodzących w stan pary staje się równa liczbie cząsteczek skraplających się ponownie . Para w tych warunkach jest parą nasyconą, a jej ciśnienie nosi nazwę prężności pary nasyconej. Prężność pary nasyconej jest w danej temperaturze różna dla różnych cieczy których charakteryzuje ich lotność. Woda jest cieczą nielotną i posiada małą prężność pary nasyconej.
Ze wzrostem temperatury prężność pary nasyconej rośnie, ze względu, że w tych warunkach zwiększa się liczba cząsteczek zdolnych do opuszczenia powierzchni cieczy oraz równoczesne zwiększa się energia kinetyczna cząsteczek będących już w stanie pary. Zwiększenie to ma charakter krzywoliniowy i przebiega podobnie dla wszystkich cieczy, tzn. w niskich temperaturach jest niewielkie, a w wyższych znaczne.
Celem ćwiczenia jest wyznaczenie entalpii parowania wody i polega na pomiarze energii elektrycznej potrzebnej do odparowania n moli wody w kontrolowanych warunkach. Do obliczenia entalpii parowania posłuży nam równanie :
![]()
gdzie: Δ Hpar - entalpia parowania
![]()
- stała określająca straty cieplne w aparaturze
![]()
- energia elektryczna dostarczona do grzejnika w ciągu 1s
![]()
- liczba moli odparowanej cieczy
Powyższe równanie wyrażają:
![]()
[ J/s ]
Q =0,239U I t [ J ] - wyraża wielkość energii źródła prądu zamienionego na energię cieplną podczas przepływu o natężeniu I w czasie t przez urządzenie, na którego końcach różnica potencjałów wynosi U
![]()
[ mol/s ]
n - liczba moli odparowanej cieczy,
t - czas potrzebny do odparowania n moli cieczy.
Po przekształceniu otrzymujemy następujący wzór na entalpię parowania:
![]()
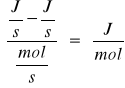
Pomiary i obliczenia
Dokonujemy pomiarów ilości odparowanej wody w miarę zwiększania natężenia płynącego prądu. Woda zbierana jest do (wcześniej zważonych) zlewek w czasie 600 sekund .
Masa wody [g] |
n/t [mol/s] |
Napięcie U [V] |
Natężenie I [A] |
Q/t [J/s] |
9,430 |
0,872·10-3 |
50 |
1 |
53 |
12,250 |
1,134·10-3 |
60 |
1,2 |
64 |
22,305 |
2,064·10-3 |
70 |
1,4 |
102 |
31,425 |
2,907·10-3 |
80 |
1,65 |
137 |
39,840 |
3,686·10-3 |
90 |
1,92 |
168 |
Na podstawie powyższych obliczeń sporządzono wykres zależności energii elektrycznej dostarczonej do grzejnika w funkcji liczby moli odparowanej wody.
Z wykresu odczytujemy wartość entalpii parowania wody (współczynnik kierunkowy), która wynosi ΔH = 40865 J.
Dzięki wykorzystanej w programie komputerowym procedurze do aproksymacji otrzymanej funkcji, wartość ciepła parowania została obliczona z dużą dokładnością. Informuje nas o niej wartość maksymalnego względnego błędu aproksymacji = 0,1093.
Nieszczelność naczynia Dewara, w którym przeprowadzane było doświadczenie i związane z nią straty ciepła zostały skompensowane przez stałą k, która wynosi 17,822.
Obliczamy błąd wyznaczonej entalpii parowania wody
Wartość tablicowa [J/mol] |
Wartość obliczona [J/mol] |
Błąd bezwzględny |
Błąd względny |
40670 |
40865 |
-195 |
0,48 % |
Wpływ na zawyżenie wartości entalpii miał:
niedokładny odczyt parametrów prądu z mierników,
niewielkie straty wywołane parowaniem wody w temperaturze pokojowej przed pomiarem masy kolbki
Na podstawie wyznaczonego błędu względnego możemy wywnioskować, że nasze pomiary zostały wykonane z dużą dokładnością.
2
Wyszukiwarka