1. Jaka jest hybrydyzacja poszczególnych atomów w:
b. allenie CH2=C=CH2 (1)
c. aldehydzie o wzorze CH3C≡CCHO (1)
d. karbokationie allilowym CH2=CH-CH2+ (1).
2. W poniższych strukturach dorysuj wolne pary elektronowe i sprecyzuj na jakich orbitalach się one znajdują. (3)
3. Jaka jest hybrydyzacja i kąty wokół zaznaczonych atomów? (3)
4. Kwas maleinowy posiada moment dipolowy, ale dla związku o zbliżonej strukturze - kwasu fumarowego - moment dipolowy jest równy zeru. Wyjaśnij. (2)
6. Który ze związków w poniższych parach ma wyższą temperaturę wrzenia? Wyjaśnij. (3)
a. CH3CH2OCH3 czy CH3CH(OH)CH3
b. heksan czy 2,3-dimetylobutan
c. CH3I czy CH3OH
7. Do podanych poniżej związków dorysuj wolne pary elektronowe i określ na jakich orbitalach się one znajdują. (3)
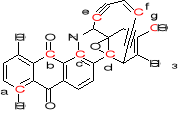
8. Jaka jest hybrydyzacja zaznaczonych atomów węgla w dynamicynie A. (2)
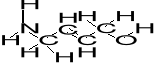
9. Dorysuj do poniższej struktury brakujące pary elektronowe (1). Określ hybrydyzację poszczególnych atomów węgla i azotu oraz rodzaje wiązań pomiędzy atomami cząsteczki (1). Wskaż parę elektronową (podaj krótkie wyjaśnienie):
a. o najwyższej energii; (1)
b. trzecią pod względem energii. (1)
10. Narysuj strukturę orbitalową i podaj hybrydyzację oraz kąty dla grupy funkcyjnej w acetonitrylu (CH3CN). (2)
11. Narysuj diagram poziomów energetycznych dla obojętnej cząsteczki HeH. (2) Wyjaśnij czy ta cząsteczka jest trwała. (1)
12. Dlaczego fluorometan ( = 1.81 D) ma mniejszy moment dipolowy od chlorometanu ( = 1.87 D) mimo, że fluor jest bardziej elektroujemny od chloru? (2)
13. Które z poniższych związków tworzą wiązania wodorowe między swoimi cząsteczkami, a które mogą tworzyć takie wiązania z wodą? (4)
a. (CH3CH2)2NH b. CH2=CH-CH2CH3 c. CH3CH2COOH d. CH3CH2CHO
14. Spośród poniższych form rezonansowych jedna jest nieprawidłowa. Znajdź ją i wyjaśnij na czym polega nieprawidłowość. (3)
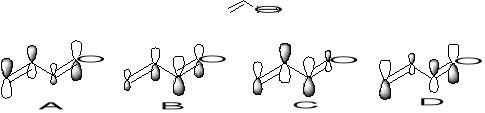
15. Ułóż w kolejności od najniższej do najwyższej energii orbitale molekularne propenalu przedstawione w postaci rysunkowej poniżej. Które z nich są wiążące, a które antywiążące? Wskaż orbital HOMO i LUMO. (4)
16. Wyjaśnij dlaczego cykloheksyn jest bardzo nietrwałym związkiem. (2)
17. Jaki rodzaj wiązań może się tworzyć przez nakładanie się orbitali s i p? Które z nakładań orbitali będzie bardziej efektywne: 1s + 2p czy 1s + 3p? Podaj wyjaśnienie. Dlaczego siła wiązania maleje w szeregu HF > OH > NH > CH? (3)
91
Wyszukiwarka
Podobne podstrony:
semquiz 09 3 196, Science ^^, Farmacja, 1 rok, Chemia, Organ, ZBIÓR TESTÓW ORGANA
semquiz 09 3 196, Science ^^, Farmacja, 1 rok, Chemia, Organ, ZBIÓR TESTÓW ORGANA
semquiz 2, Science ^^, Farmacja, 1 rok, Chemia, Organ, ZBIÓR TESTÓW ORGANA
semquiz 7b, Science ^^, Farmacja, 1 rok, Chemia, Organ, ZBIÓR TESTÓW ORGANA
semquiz 2, Science ^^, Farmacja, 1 rok, Chemia, Organ, ZBIÓR TESTÓW ORGANA
zal ten rok sem, Science ^^, Farmacja, 1 rok, Chemia, Organ, ZBIÓR TESTÓW ORGANA
pyt z organy - zeszły rok, Science ^^, Farmacja, 1 rok, Chemia, Organ, Zaliczenie
zal pon organa, Science ^^, Farmacja, 1 rok, Chemia, Organ, Zaliczenie
Podział mieszanin chemicznych, Science ^^, Farmacja, 1 rok, Chemia, ćwiczenia, Semestr II
Zadanie liczone, Science ^^, Farmacja, 1 rok, Chemia, Ogólna i nieorgan, egzamin, chemia nieorganicz
Chemia - zagadnienia na egzamin, Science ^^, Farmacja, 1 rok, Chemia, Ogólna i nieorgan, egzamin
więcej podobnych podstron