GRUPA NR: 22 ZESPÓŁ: 3 |
ĆWICZENIE NR: 8
Równowaga I2+KI=KI3 |
DATA WYKONANIA ĆWICZENIA: 28.04.2008 r.
|
ZESPÓŁ: 1. Katarzyna Góral 2. Joanna Grzywacz 3. Karolina Paśko 4. Kinga Poźniak
|
|
OCENA
|
1. Wstęp teoretyczny
W układzie składającym się z dwóch niemieszających się cieczy A i B oraz z trzeciej substancji C rozpuszczalnej zarówno w jednej jak i w drugiej cieczy zachodzi ustalenie stanu równowagi ilościowo opisanego równaniem Nernsta:
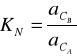
gdzie:
![]()
, ![]()
- aktywność składnika C w fazie A i B.
W stałej temperaturze lewa strona wyrażenia jest wielkością stałą. Wielkość ta oznacza zazwyczaj KN, nazywana jest współczynnikiem podziału.
Równanie może być stosowane jako przybliżone jedynie w przypadku roztworów bardzo rozcieńczonych, szczególnie ostrożnie w odniesieniu do roztworów elektrolitów, których współczynniki aktywności różnią się wyraźnie od jedności już dla stężeń rzędu 10-2. Poważne odchylenia od prawa podziału wystąpią także w przypadku substancji asocjujących. Dodanie trzeciej substancji B do dwóch praktycznie nie mieszających się rozpuszczalników spowoduje wzrost ich wzajemnej rozpuszczalności, a więc współistniejące fazy są roztworami trójskładnikowymi o zmieniających się zawartościach A i C .
Prawo podziału nie będzie również zachowane, gdy w jednej z faz stężenie substancji rozpuszczonej określane jest dodatkowo reakcjami równowagowymi przebiegającymi w tej fazie. Odchylenia te mogą być podstawą do wyznaczenia stałej równowagi takiej reakcji. Reakcja:
![]()
przebiega jedynie w roztworze wodnym, nie zachodzi natomiast w fazie organicznej. Stałe równowagi powyższej reakcji wyraża się wzorem:

W przypadku gdy roztwór jest rozcieńczony, można przyjąć że współczynnik aktywności fi≅1
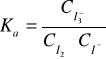
, zatem Ka≅Kc.
Jeżeli faza wodna, w której ustala się powyższa równowaga znajduje się w kontakcie z fazą organiczną np. CCl4, wówczas stężenie równowagowe I2 określone jest również współczynnikiem podziału:

Jeżeli znana jest wartość współczynnika podziału KN wówczas stężenie równowagowe jodu w roztworze wodnym możemy obliczyć na podstawie wartości stężenia jodu w fazie organicznej, wyznaczonej przez miareczkowanie fazy organicznej roztworem Na2S2O3. Jednocześnie całkowite stężenie jodu w fazie wodnej (w postaci I2 oraz I-) może być wyznaczone analogicznie poprzez miareczkowanie warstwy wodnej. Wówczas:

![]()
2. Cel ćwiczenia
Ćwiczenie ma na celu umożliwić nam wyznaczenie stałej KC dla dwóch różnych temperatur dla reakcji: ![]()
.
3. Zadane parametry i sposób wykonania ćwiczenia.
Roztwór pierwszy: Do kolby stożkowej o poj. 250 cm3 wprowadza się 80 cm3 0.01 molowego roztworu KI oraz 20 cm3 roztworu I2 w CCl4. Zawartość wytrząsa się w temperaturze otoczenia przez ok. 15 min. Następnie pobiera się po dwie próbki z każdej fazy i oznacza się miareczkowo 0.01 molowym roztworem Na2S2O3 stężenie I2.
Roztwór drugi: Do kolby stożkowej o poj. 250 cm3 wprowadza się 80 cm3 0.01 molowego roztworu KI, 5 cm3 roztworu I2 w CCl4 oraz 15 cm3 czystego CCl4. Zawartość wstrząsa się przez 10 min. Następnie umieszcza Kolbe w termostacie i ogrzewa zawartość do temp. 40°C i wstrząsa przez ok. 10 min. Następnie pobiera się po dwie próbki z każdej fazy i oznacza się miareczkowo 0.01 molowym roztworem Na2S2O3 stężenie I2.
4. Wyniki pomiarów
Warunki pomiaru:
T1 = 22.0 oC
T2 =40.0 oC
|
|
H2O |
H2O |
CCl4 |
|
Vfazy [cm3] |
10 |
10 |
2 |
22oC |
VNa2S2O3 [cm3] |
25,2 |
34 |
32 |
|
CI2 w fazie |
0,0378 |
0,051 |
0,08 |
|
Vfazy [cm3] |
10 |
10 |
2 |
40oC |
VNa2S2O3 [cm3] |
4,2 |
5,4 |
10 |
|
CI2 w fazie |
0,0063 |
0,0081 |
0,025 |

CI2 w fazie wodnej średnie = 0,0444 (t=22°C)
CI2 w fazie wodnej średnie = 0,0072 (t=40°C)
KN =1/95=0,0105 w temp 20-30°C
KN=1/110=0,0091 w temp 40°C

Kc=917 w temp 22°C
Kc=329,46 w temp 40°C
W tablicach Kc= 960
Zatem nasz błąd to 4,5% bo (960-917)*100%/960=4,5%
5. Wnioski
Wynik dla temperatury 40 stopni jest znacznie odbiegający od takiego jak powinien wyjść. Jest to spowodowane nieświeżym roztworem skrobi stosowanym do miareczkowania co wpłynęło na szybkość uchwycenia punktu miareczkowego. Roztwór mógł również wystygnąć co również wpłynęło na wynik.
Wyszukiwarka
Podobne podstrony:
Nernst, II rok, chemia fizyczna
sprawozdanie nr 2 (2), II rok, chemia fizyczna
Ćw7.2 treść raportu, z góry, II rok, CHEMIA FIZYCZNA, CHEMIA FIZYCZNA
Wymagania egz.Chemia Fizyczna, biotechnologia 2 sem rok2, pobrane z góry DS 7, II rok, CHEMIA FIZYCZ
Kolo z seminarek, Płyta farmacja Poznań, II rok, chemia fizyczna
tr+gibbsa, II rok, chemia fizyczna
sprawozdanie nr 1, II rok, chemia fizyczna
napięcie nasze, II rok, chemia fizyczna
SPRAWOZDANIE Z CHEMII FIZYCZNEJ, II rok, chemia fizyczna
Nernst, II rok, chemia fizyczna
chemia fizyczna - zestawy pytan, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, r
Zagadnienia - ogólnie, I ROK, II SEMESTR, Chemia Fizyczna
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
zagadnienia chemia wody, Politechnika Wrocławska, Inżynieria Środowiska, II rok, Chemia wody
Chemia fizyczna - wykad 5, OŚ, sem II 1 SOWiG, Chemia Fizyczna
test II, TiR UAM II ROK, Geografia fizyczna Polski
test I, TiR UAM II ROK, Geografia fizyczna Polski
więcej podobnych podstron