8.12.2010 |
Mateusz Kaniewski Marcin Górski |
Gr.V
|
Ćwiczenie 20 |
Jonity |
|
Celem ćwiczenia jest wyznaczenie zdolności wymiennej kationu w stosunku do jonów sodu.
Wykonanie ćwiczenia:
Zregenerowaliśmy jonit przemywając go po kolei:
- 100 cm3 HCl w stosunku 1:4 z szybkością przepływu 8 cm3/min,
- 150 cm3 wody destylowanej,
- 100 cm3 w stosunku 1:4 z szybkością przepływu 8 cm3/min,
- kolumnę przemywaliśmy wodą destylowaną do całkowitego usunięcia niezwiązanego kwasu, badając kwasowość wycieku papierkiem uniwersalnym.
2. Oznaczaliśmy zdolność wymienną kationity w następujący sposób:
- Przez kolumnę przepuściliśmy 150 cm3 1M NaCl z szybkościa przepływu równą ok. 2,5 cm3/min,
- Kiedy z krople roztworu wypływające z kolumny dawały z papierkiem wskaźnikowym odczyn kwasowy, zaczęliśmy zbieranie eulatu, do momentu gdy spadające krople dawały odczyn obojętny.
- Oznaczaliśmy stężenie kwasu w eulacie za pomocą miareczkowania potencjometrycznego, przy użyciu titranta 2 M NaOH.
Wyniki pomiarów i obliczeń:
Obliczanie ΔpH, ΔV i
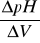
:Obliczanie zdolności wymiennej kationity
Część graficzna:
lp. |
pH |
V[cm3] |
ΔpH |
ΔV [cm3] |
[cm-3] |
1 |
0,67 |
0 |
0 |
0 |
0,000 |
2 |
0,67 |
5 |
0 |
5 |
0,000 |
3 |
0,66 |
10 |
0,01 |
5 |
0,002 |
4 |
0,66 |
15 |
0 |
5 |
0,000 |
5 |
0,66 |
20,2 |
0 |
5,2 |
0,000 |
6 |
0,66 |
21 |
0 |
0,8 |
0,000 |
7 |
0,66 |
22 |
0 |
1 |
0,000 |
8 |
0,66 |
23 |
0 |
1 |
0,000 |
9 |
0,66 |
24 |
0 |
1 |
0,000 |
10 |
0,66 |
25 |
0 |
1 |
0,000 |
11 |
0,66 |
26 |
0 |
1 |
0,000 |
12 |
0,66 |
27,3 |
0 |
1,3 |
0,000 |
13 |
0,66 |
28 |
0 |
0,7 |
0,000 |
14 |
0,66 |
29 |
0 |
1 |
0,000 |
15 |
0,66 |
30 |
0 |
1 |
0,000 |
16 |
0,66 |
31 |
0 |
1 |
0,000 |
17 |
0,66 |
32 |
0 |
1 |
0,000 |
18 |
0,66 |
33 |
0 |
1 |
0,000 |
19 |
0,66 |
34 |
0 |
1 |
0,000 |
20 |
0,67 |
35 |
0,01 |
1 |
0,010 |
21 |
0,67 |
36,1 |
0 |
1,1 |
0,000 |
22 |
0,67 |
37,1 |
0 |
1 |
0,000 |
23 |
0,63 |
38 |
0,04 |
0,9 |
0,044 |
24 |
0,62 |
39 |
0,01 |
1 |
0,010 |
25 |
0,61 |
40 |
0,01 |
1 |
0,010 |
26 |
0,61 |
41 |
0 |
1 |
0,000 |
27 |
0,6 |
42 |
0,01 |
1 |
0,010 |
28 |
0,6 |
43 |
0 |
1 |
0,000 |
29 |
0,61 |
44 |
0,01 |
1 |
0,010 |
30 |
0,61 |
45 |
0 |
1 |
0,000 |
31 |
0,61 |
46 |
0 |
1 |
0,000 |
32 |
0,61 |
47 |
0 |
1 |
0,000 |
33 |
0,62 |
48,2 |
0,01 |
1,2 |
0,008 |
34 |
0,62 |
49 |
0 |
0,8 |
0,000 |
35 |
0,62 |
50 |
0 |
1 |
0,000 |
36 |
0,63 |
51 |
0,01 |
1 |
0,010 |
37 |
0,64 |
52 |
0,01 |
1 |
0,010 |
38 |
0,65 |
53 |
0,01 |
1 |
0,010 |
39 |
0,66 |
54 |
0,01 |
1 |
0,010 |
40 |
0,67 |
55 |
0,01 |
1 |
0,010 |
41 |
0,68 |
56,2 |
0,01 |
1,2 |
0,008 |
42 |
0,7 |
57 |
0,02 |
0,8 |
0,025 |
43 |
0,71 |
58 |
0,01 |
1 |
0,010 |
44 |
0,73 |
59 |
0,02 |
1 |
0,020 |
45 |
0,75 |
60 |
0,02 |
1 |
0,020 |
46 |
0,78 |
61,2 |
0,03 |
1,2 |
0,025 |
47 |
0,8 |
62 |
0,02 |
0,8 |
0,025 |
48 |
0,84 |
63,1 |
0,04 |
1,1 |
0,036 |
49 |
0,88 |
64 |
0,04 |
0,9 |
0,044 |
50 |
0,93 |
65,2 |
0,05 |
1,2 |
0,042 |
51 |
0,99 |
66,2 |
0,06 |
1 |
0,060 |
52 |
1,05 |
67 |
0,06 |
0,8 |
0,075 |
53 |
1,16 |
68 |
0,11 |
1 |
0,110 |
54 |
1,3 |
69 |
0,14 |
1 |
0,140 |
55 |
1,48 |
70 |
0,18 |
1 |
0,180 |
56 |
1,93 |
71 |
0,45 |
1 |
0,450 |
57 |
8,45 |
72 |
6,52 |
1 |
6,520 |
58 |
11,09 |
73 |
2,64 |
1 |
2,640 |
59 |
11,44 |
74 |
0,35 |
1 |
0,350 |
60 |
11,62 |
75 |
0,18 |
1 |
0,180 |
61 |
11,74 |
76 |
0,12 |
1 |
0,120 |
62 |
11,85 |
77,2 |
0,11 |
1,2 |
0,092 |
63 |
11,9 |
78 |
0,05 |
0,8 |
0,063 |
64 |
11,96 |
79 |
0,06 |
1 |
0,060 |
65 |
12,01 |
80 |
0,05 |
1 |
0,050 |
66 |
12,04 |
81 |
0,03 |
1 |
0,030 |
67 |
12,08 |
82 |
0,04 |
1 |
0,040 |
68 |
12,12 |
83,2 |
0,04 |
1,2 |
0,033 |
Tabela 1.
III. Opracowanie wyników:
- Δ pH i Δ V obliczaliśmy w taki sam sposób, mianowicie:
Δn = n - (n - 1)
gdzie:
Δn - różnica danej wartości, danego pomiaru,
n - numer pomiaru.
- ![]()
obliczaliśmy dzieląc ΔpH przez ΔV z tego samego wiersza w tabeli 1.
Wyniki tych pomiarów zamieściliśmy w tabeli 1. oraz na wykresach nr. 1 i 2
- pierw określamy na podstawie wykresu 2. punkt końcowy. U nas wyniósł on dla objętości
72 cm3 = 0,072 dm3 titranta 2M NaOH. Na podstawie reakcji zobojętniania możemy obliczyć ilość gramorównoważników kwasu zawartego w zebranym przez nas eulacie:
![]()
Na podstawie tej reakcji wiemy, że ![]()
n obliczamy na podstawie objętości odpowiadającej punktowi końcowemu:
![]()
Na podstawie![]()
stwierdzamy, że ilość gramorównoważników odpowiada liczbowo ilości n. Zmienia się tylko jednostka z [mol] na [val].
Na podstawie wzoru
Z = ![]()
,
gdzie:
Z - zdolność wymienna kationity,
a - ilość gramorównowazników kwasu w wycieku,
q - masa jonitu w kolumnie (q = 50 g)
Możemy obliczyć wartość Z.
Z = 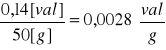
Wykres 1.
Wykres 2.
V. Wnioski:
Wyznaczyliśmy zdolność wymienną kationitu w stosunku do Na+. Stwierdzamy też ze kationit wymienia jony dobrze, ponieważ na wlane do kolumny ok 0,15 mol Na+ wypłynęło 0,14 mol H+.
pH
VNaOH [cm3]
100
80
60
40
20
0
14
12
10
8
6
4
2
0
pH = f(VNaOH)
![]()
= f(V)
-1
0
1
2
3
4
5
6
7
0
20
40
60
80
100
VNaOH [cm3]
ΔpH/ΔV [cm-3]
Wyszukiwarka