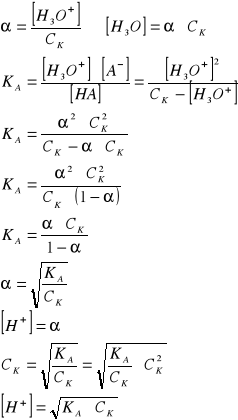
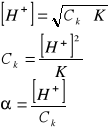
Do 30 cm3 0,2 molowego wodnego roztworu amoniaku wlano 720 cm3 roztrworu kwasu solnego o pH=2. Oblicz pH tak sporządzonego roztworu. Stała dysocjacji NH3 Kb=1,75*10-5
nz=cz*vz=0,24mol/dm3*30cm3=7,2mM NH3 HCl= alfa=1
HCl pH=2 [H+]=Ck=10-2=0,01 mol/dm3
nk=ck*vk=0,01 mol/dm3*720 cm3 =7,2mM HCl
cs=ns/vr=0,0072mol/0,75 dm3=0,0096 mol/dm3
Kb=[NH4+]*[OH-]/[NH3]
Kb=Cs* Kw/[H+]2
[H+]=(Cs* Kw/ Kb)pierwiastek
[H+]=0,0096*10-14/1,75*10-5 =2,34*10-6
pH=-log(2,34*10-6)=5,63
NH3+HCl= NH4Cl
NH4++ Cl-+HOH>< NH3*H2O+Cl-+H+
Do 500 cm3 0,124 molowego wodnego roztrworu kw octowego wsypano 1 g krystalicznego NaOH. Zakładając że objętość nie uległa zmianie oblicz jego pH. Stała dysocjacji CH3COOH Ka=1,8*10-5
nk=ck*vk=0,124 mol/dm3*500 cm3 =62mM CH3COOH
40g NaOH- 1000mM
1g NaOH- 25mM
CH3COOH+NaOH=CH3COONa+H2O
62mM 25mM Produkty reakcji
25mM 25mM Przereagowało
Powstało 25mM
37mM Pozostało
Ck=n/v=0,037mol/0,5 dm3=0,074 mol/dm3
Cs=n/v=0,025mol/0,5 dm3=0,05 mol/dm3
CH3COOH+H2O<>CH3COO-+H3O+
Ka=[CH3COO-]*[H+]/[CH3COOH]
[H+]= (Ck/ Cs)* Ka
[H+]=(0,074 mol/dm3 /0,05 mol/dm3)* 1,8*10-5
[H+]=2,664*10-5
pH=-log(2,664*10-5)=4,57
Przedstaw wg protonowej teorii kw równania reakcji które zachodzą podczas
A)przygotowania roztworu buforu amonowego
NH3aq +NH4Cl NH3+H2O<>NH4++Cl-
NH4Cl> NH4++Cl-
NH4 protonodawca NH3 protonobiorca
B)Po dodaniu do niego mocnego kwasu
(MK)H3O++ NH3-><NH4++ H2O(SK)
C)Po dodaniu do niego mocnej zasady
(MZ)OH-+ NH4+> H2O+NH30(SZ)
20 cm3 roztrworu kw octowego o pH 2,85 miareczkowano 0,050 molowy roztworem NaOH.Oblicz objętość użytej w tym miareczkowaniu zasady. Stała dysocjacji CH3COOH Ka=1,8*10-5
nk=ck*vk=0,124 mol/dm3*500 cm3 =62mM CH3COOH
CH3COOH+NaOH=CH3COONa+H2O
pH=2,85
[H+]=10-pH=0,001413mol/dm3
CK=[H+]2/ Ka=(0,001413mol/dm3)2/1,8*10-5=0,111 mol/dm3
Vz=ck*vk/ck=0,111 mol/dm3*20 cm3/0,05mol/dm3=44,4 cm3 NaOH
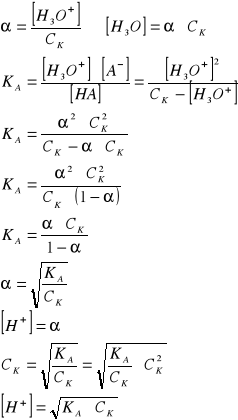
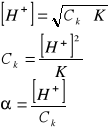
Dla słabego kwasu HA
HA + H2O = H3O+ + A−
[H3O+] =[A−] = C cz zdys.
CK=[H3O+] + [HA]
[HA] = CK − [H3O+]