UNIWERSYTET ŚLĄSKI W KATOWICACH
ZAKŁAD CHEMII FIZYCZNEJ
SPRAWOZDANIE
„ PRZEWODNICTWO RÓWNOWAŻNIKOWE ELEKTROLITÓW ”
Sławomir Maślanka
IV rok chemii
1999 / 2000 r.
Wstęp teoretyczny :
Przewodnictwo jest miarą zdolności roztworu elektrolitu do przenoszenia prądu elektrycznego. Według prawa Ohma, opór R elektrolitu znajdującego się pomiędzy elektrodami o powierzchni A i w odległości L wy-nosi
R = ρ * (L/A) , wyrażone w [Ω] [ 1 ]
gdzie ρ jest opornością właściwą r-ru elektrolitu wyrażoną w [Ω*m].
W elektrochemii roztworów elektrolitów stosuje się następujące pojęcia:
- przewodnictwo właściwe (odwrotność oporności właściwej)
σ = 1/ρ, wyrażone w [Ω-1*m-1] lub [Ω-1*cm-1] [ 2 ]
czyli σ = 1/ρ = 1/R*(L/A)
przewodnictwo równoważnikowe które definiujemy wzorem
Λ = σ *Vr-r, wyrażone w [Ω-1*m2*mol-1] lub [Ω-1*cm2*mol-1]
gdzie :
Vr-r oznacza objętość roztworu, w jakiej zawarta jest taka ilość elektrolitu, by po całkowitej dysocjacji 1 mola ładunek kationów (anionów) wynosił 1 F.
σ przedstawia przewodnictwo, jakie wykazywałby roztwór znajdujący się wewnątrz kostki o
boku 1 cm na której przeciwległych ściankach umieszczone są elektrody.
Λ można interpretować podobnie jako przewodnictwo mierzone między elektrodami odległymi o
1 cm o takiej powierzchni A, by mieściła się między nimi objętość roztworu Vr-r w której zawarty
jest 1 gramorównoważnik (val ) elektrolitu.
Stosunek (L/A) naszący nazwę stałej naczyńka i oznaczany jako k wyznacza się mierząc w tym naczyńku opór r-ru wzorcowego, dla którego znana jest w danej temperaturze dokładna wartość σ. Przewodnictwo r-ru badanego na podstawie ( 2 ) oraz k=(L/A) można przedstawić wzorem:
σx =k*1/Rx
Korzystając z przekształcenia wzoru ( 1 ) : (L/A) = R* 1/ρ można stwierdzić, że:
/badany r-r/ σx * Rx = σ * R
/wzorcowy r-r/ σx = (σ * R)/Rx = k * 1/Rx
Wartości :1/R oraz 1/Rx mierzy się bezpośrednio konduktometrem i wyraża w simensach
(1 S = 1 Ω-1).
Przewodnictwo równoważnikowe dzięki przyjętemu odniesieniu do gramorównoważnika można wyrazić stężeniem równoważnikowym cr :
Λ = σ *Vr-r = σ/cr , wyrażone w [Ω-1*m2*mol-1]
-graniczne przewodnictwo równoważnikowe oblicza się ze wzoru:
Λ 0 = l0+ + l0-
gdzie wartości l0i to graniczne przewodnictwa równoważnikowe jonu i (wartości l i ekstrapolowane do nieskonczenie wielkiego rozcieńczenia).
-równanie Debey'a-Huckela-Onsagera podaje zależność przewodnictwa równoważnikowego od stężenia.
Λ = Λ0 -a*![]()
W postaci uproszczonej :
Λ = Λ0 - (A + B*Λ0)* ![]()
gdzie stałe A, B są określone przez właściwości rozpuszczalnika i typ elek-trolitu (w tym przypadku elektrolit 1,1-wartościowy).
Dla wody w 25o C A= 60.20 ; B= 0.229
Obliczenia :
Stała naczyńka -
Przewodnictwo właściwe 0.1m KCl w 21oC : 1,284*10-3 [S/m]
0.01m KCl w 210C : 0,1407 *10-3 [S/m]
Korzystając z σx =k*1/Rx ⇒ k = σx * Rx , oraz Rx = 1/Λ
Przewodnictwo równoważnikowe wynosi :
0.1m KCl = 1,284*10-3 /0.0115 = 0,111 [m-1]
0.01m KCl = 0,1407 *10-3 /0.0018 = 0,08 [m-1]
Wartość średnia k = 0.096 [m-1]
Wyznaczenie zależności - Λ = f(c), Λ = f(
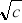
).
Obliczone przewodnictwa równoważnikowe.
Zależność Λ = f(c)
Stężenie elektrolitu |
1/Rx x =KCl |
1/Rx x =NaCl |
1/Rx x= KNO3 |
1/Rx x= H2SO4 |
σx x =KCl |
σx x =NaCl |
σx x= KNO3 |
σx x= H2SO4 |
|
0,000005m |
1,05E-05 |
1,20E-05 |
1,70E-05 |
4,60E-05 |
1,01E-06 |
1,15E-06 |
1,63E-06 |
4,42E-06 |
|
0,00001m |
1,72E-05 |
1,75E-05 |
2,00E-05 |
7,50E-05 |
1,65E-06 |
1,68E-06 |
1,92E-06 |
7,20E-06 |
|
0,000015m |
2,50E-05 |
2,30E-05 |
2,50E-05 |
1,10E-04 |
2,40E-06 |
2,21E-06 |
2,40E-06 |
1,06E-05 |
|
0,000025m |
4,00E-05 |
3,80E-05 |
3,90E-05 |
1,80E-04 |
3,84E-06 |
3,65E-06 |
3,74E-06 |
1,73E-05 |
|
0,00004m |
6,00E-05 |
5,50E-05 |
6,00E-05 |
3,00E-04 |
5,76E-06 |
5,28E-06 |
5,76E-06 |
2,88E-05 |
|
0,00006m |
8,50E-05 |
8,50E-05 |
9,00E-05 |
4,00E-04 |
8,16E-06 |
8,16E-06 |
8,64E-06 |
3,84E-05 |
|
0,00008m |
1,20E-04 |
1,30E-04 |
1,25E-04 |
5,00E-04 |
1,15E-05 |
1,25E-05 |
1,20E-05 |
4,80E-05 |
|
Jednostka: |
|
[Ω-1] = [S] |
|
|
|
[Ω * m] |
|
|
|
Stężenie elektrolitu |
Pierwiastek ze [c] elektrolitu |
ΛKCl |
ΛNaCl |
ΛKNO3 |
ΛH2SO4 |
0,000005m |
0,002236 |
2,02E-01 |
2,30E-01 |
3,26E-01 |
8,83E-01 |
0,00001m |
0,003162 |
1,65E-01 |
1,68E-01 |
1,92E-01 |
7,20E-01 |
0,000015m |
0,003873 |
1,60E-01 |
1,47E-01 |
1,60E-01 |
7,04E-01 |
0,000025m |
0,005000 |
1,54E-01 |
1,46E-01 |
1,50E-01 |
6,91E-01 |
0,00004m |
0,006325 |
1,44E-01 |
1,32E-01 |
1,44E-01 |
7,20E-01 |
0,00006m |
0,007746 |
1,36E-01 |
1,36E-01 |
1,44E-01 |
6,40E-01 |
0,00008m |
0,008944 |
1,44E-01 |
1,56E-01 |
1,50E-01 |
6,00E-01 |
Jednostka |
|
|
[S* m.2*mol-1] |
|
|
Wyznaczam współczynniki zależności: Λ = a![]()
+ b ⇔ Λ = Λ0 -a*![]()
Elekrolit |
|
|
KCl |
NaCl |
KNO3 |
H2SO4 |
Wyraz wolny ( b ) będący przewodnictwem granicznym Λ0 [S* m.2*mol-1] |
|
|
0.1972 |
0.1989 |
0.2098 |
0.8693 |
Współczynnik kierunkowy ( a ) |
|
|
-7,4047 |
-7,6945 |
-8,5539 |
-30,209 |
Wyznaczenie stopnia dysocjacji : α = Λ/Λ0 .
Stężenie elektrolitu |
α KCl |
α NaCl |
α KNO3 |
α H2SO4 |
0,000005m |
1,00E+00 |
1,16E+00 ( błąd gruby) |
1,00E+00 |
1,00E+00 |
0,00001m |
8,37E-01 |
8,45E-01 |
9,15E-01 |
8,28E-01 |
0,000015m |
8,11E-01 |
7,40E-01 |
7,63E-01 |
8,10E-01 |
0,000025m |
7,79E-01 |
7,34E-01 |
7,14E-01 |
7,95E-01 |
0,00004m |
7,30E-01 |
6,64E-01 |
6,86E-01 |
8,28E-01 |
0,00006m |
6,90E-01 |
6,84E-01 |
6,86E-01 |
7,36E-01 |
0,00008m |
7,30E-01 |
7,84E-01 |
7,15E-01 |
6,90E-01 |
Sprawdzenie prawa Kolrausha Λ 0 = l0+ + l0-
Elek-trolit |
przewodnictwo graniczne Λ0 [S*m2*val-1]
|
Wartość tablicowa granicznego przewodnictwa równoważnikowego dla kationu l0+ w 210C |
Wartość obliczona granicznego przewodnictwa równoważnikowego dla anionu |
Wartość tablicowa granicznego przewodnictwa równoważnikowego dla anionu l0- w 210C |
KCl |
0.1972 |
0.073 |
0.124 |
0.076 |
NaCl |
0.1989 |
0.050 |
0.149 |
0.076 |
KNO3 |
0.2098 |
0.073 |
0.136 |
0.071 |
H2SO4 |
0.8693 |
0.698 |
0.171 |
0.158 |
Wnioski :
Wartości błędów obliczonej wartości granicznego przewodnictwa równoważnikowego dla anionu dla soli są podobne i średnio wynoszą B% = 59% a dla kwasu wynosi B% = 8% . Z wyznaczonej wartości stopnia dysocjacji wynika że dla roztworów o największym rozcieńczeniu dysocjacji uległa cała zawartość soli i kwasu w roztworze . Jak wiadomo duży wpływ na wartość wyznaczanego przewodnictwa równoważnikowe jonów (kationów i anionów) ma temperatura pomiaru której podczas ćwiczenia nie dało się utrzymać w stałej wartości . Również ważnym czynnikiem przy pomiarach i sporządzaniu roztworów o dużym rozcieńczeniu jest dokładności odmierzania roztworów roboczych które należało by odmierzać mikropipetą .
Wyszukiwarka
Podobne podstrony:
Przewodnrównow, studia, chemia, chemia fizyczna, sprawozdania
PRZEWODNICTWO RÓWNOWAŻNIKWE ELEKTROLITÓW, studia, chemia, chemia fizyczna, sprawozdania
Przewodnictwo równoważnikowe, studia, chemia, chemia fizyczna, sprawozdania
Iloczyn rozpuszczalności soli trodno rozpuszczalnych, studia, chemia, chemia fizyczna, sprawozdania,
HCOOH, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Diagram fazowy Gibbsa, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Entropia mieszania, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Sprawozdanie 12 do druku, Studia, Chemia fizyczna, Laborki, 12 - Równowaga fazowa ciecz-para
Badanie lepkości cieczy metodą Hopplera, studia, chemia, chemia fizyczna, sprawozdania, sprawka
izoterma adsorbcji, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Stała szybkości reakcji jodowania acetonu, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Energia aktywacji przepływu lepkiego, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Krytycznemicele, studia, chemia, chemia fizyczna, sprawozdania
Ciepło rozpuszczania soli jonowej, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Kinetyka reakcji elektroutlenienia 1-propanolu, studia, chemia, chemia fizyczna, sprawozdania, spraw
Elektronowe widma absorpcyjne, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Dyspersja współczynnika załamania światła, studia, chemia, chemia fizyczna, sprawozdania, sprawka
HCl i HJ, studia, chemia, chemia fizyczna, sprawozdania, sprawka
więcej podobnych podstron