Wykład 2
Istnieje ścisła zależność między składem chemicznym, strukturą fizyczną i właściwościami substancji chemicznej. O składzie chemicznym decyduje zawartość pierwiastków i związków chemicznych. O strukturze fizycznej decyduje stopień uporządkowania substancji w przestrzeni.
Podstawa zrozumienia przemian zachodzących w materiałach budowlanych, procesach ich wytwarzania i destrukcji - niszczenia, jest znajomość budowy atomu.
Budowa atomu - najmniejszą cząstką substancją niepodzielną metodami chemicznymi. Atom danego pierwiastka charakteryzowany jest liczbą atomową Z i liczbą masową A
A
X
Z
Średnicy atomu różnych pierwiastków są rzędu 10-10m. Atomy są elektrycznie obojętne zbudowane z 2 podstawowych elementów:
- jądra dodatniego zawierającego Z protonów o łącznym ładunku Z+ ,o średnicy ok.10-15m.
Łączna ilość protonów i neutronów daje liczbę A.
- powłoka elektronowa, która posiada średnicę zbliżoną do średnicy atomu. Na powłoce rozmieszczonych jest Z elektronów o łącznym ładunku Z-.
Suma Z+ i Z- = 0
Zakłada się , że atomy pozostają niezmienione podczas przebiegu reakcji chemicznych. W reakcjach chemicznych biorą udział elektrony walencyjne znajdujące się na ostatnim(górnej) poziomie energetycznym powłoki elektronowej.
Po oderwaniu elektronu otrzymujemy kation, średnica i promienie jonów dodatnich czyli kationów są zawsze mniejsze od promienia atomów macierzystych.
Jeżeli przyłączymy elektron otrzymany anion, średnica i promienie jonów ujemnych są większe niż średnice i promienie atomów macierzystych.
Elektrony znajdujące się w atomie znajdują się na określonych poziomach elektrycznych (tzw powłokach i pod powłokach) . Pod powłoki noszą nazwę orbitali i są przestrzeniami najwiekszenia prawdopodobieństwa występowanie elektronów względem jądra.
Stan energetyczny opisany jest 4 liczbami kwantowymi.
Elektron znajdujący się na danym orbitalu w atomie nie wypromieniowuje ani nie pochłania energii, zmieniając orital elektron wymienia energię z otoczeniem.
Stan elektrony Liczby kwantowe:
- n główna liczba kwantowa opisuje powłokę. Przyjmuje wartość liczbową od 1do n, lub literowe KLMNOPQ…
- l poboczna liczba kwantowa opisuje pod powłokę (rodzaj orbitalu) przyjmuje wartość liczbowe od 0 do n-1, literowe PDF
- ml magnetyczna liczba kwantowa, opisuje orientację konkretnego orbitalu w przestrzeni, przyjmuje wartość liczbową -l … O … +l
- ms spinowa liczba kwantowa opisuje stan spinowy (kierunek spinu) elektorn przyjmuje wartość +i- ½
Liczba orbitali równa jest wartości liczby kwantowej ml:
- dla orbitali s (l=0) istnieje jedna wartość ml (0) dlatego jest on 1
- dla orbitali p (l=1) istnieją trzy wartości ml (-1,0,+1) dlatego są trzy orbitalne p
- dla orbitali d i f (l=2i3) występuje odpowiednio 5 i 7 wartość ml, dlatego orbitali d jest 5 a orbitali f = 7.
Reguły zapełniania orbitali przez elektrony w atomie.
W atomie nie może być dwóch elektronów opisanych 4 identycznej liczbie kwantowej. Max liczba elektronów na powłoce n wynosi 2n2, na pod powłoce l (ornitalu) wynosi 2(2l+1).
Zapełnianie orbitali elektorami odbywa się zgodnie z regułą maksymalnej różnorodności (max liczba ) niespinowych elektornów czyli o jednakowej orientacji spinu - np.: 6C
6C = 1s22s22p2
![]()
2p2
W pierwszej kolejności elektronami zapełniane są orbitalne które posiadają minimalną wartość sumy n+l, gdy ta suma dla dwóch orbitali jest jednakowa wcześniej obsadzony zastanie orbita o mniejszej wartości n (diagramu)
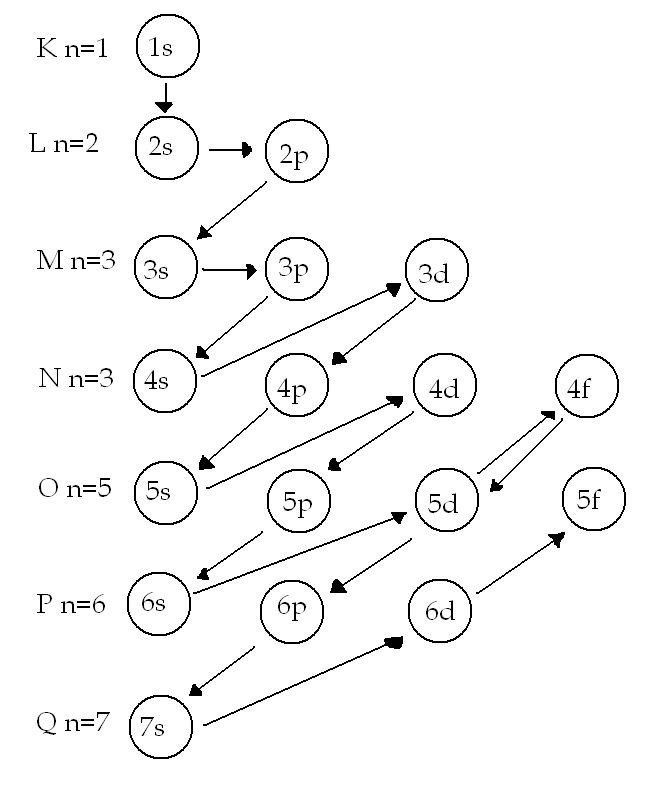
Szczególnie stabilne są powłoki elektronowe w pełni osadzone elektronami, dla pierwszej powłoki 2e, dla następnych 8e.
Cechy chemiczne i fizyczne pierwiastków zależą od elektronów położonych na zewnętrznej powłoce elektronów walencyjnych.
Struktura elektronowa atomu
Podawana jest przez zapisanie jego konfiguracji elektronowej
Konfiguracja elektronowa powinna uwzględnić wszystkie osadzone orbitale atomy i liczby elektronów w następnym orbitalu.
Dla atomów danego pierwiastka o liczbie atomowej z rozpisywana jest konfiguracja dla Z elektronów.
Kolejne elektrony przyporządkowuje się kolejnym obritalom 1s,2s,3p … zgodnie z diagramami np.: dla pierwiastka o Z=10: 1s22s22p6
Przy rozpisywaniu konfiguracji elektronowej można posługiwać się kwadracikami oznaczającymi orbitalne. Kwadracik może zawierać max 2 elektrony
10Z 1s2 2s2 2p6
![]()
Określenie położenia pierwiastków w układzie okresowym według konfiguracji
Poprawnie wykonany zapis konfiguracji elektronów pozwala ustalić miejsce położenia pierwiastka w układzie okresowym. Pierwiastek o Z=10 znajduje się w 2 okresie w 18 grupie.
Grupa okresu - max wartość liczby n
Numer grupy:
- suma elektronów walencyjnych na orbitach s (grupy 1 i 2)
- suma elektronów na orbitach s i d (grupa 3-12)
- suma elektronów na orbitach s i p +10 ( grupy 13-18)
1X 1s2 1 okres, 1 grupa
7X 1s2 2s2 2p3 2 okres, 15 grupa
21X 1s2 2s2 2p6 3s 23p64s23d1 4 okres, 3 grupa
Elektrony walencyjne znajdują się na ostatniej powłoce. Świadczą o właściwościach chemicznych pierwiastka. Poprawnie wykonywany zapis konfiguracji elektronowej pierwiastka pozwala ustalić właściwości chemiczne pierwiastka.
Konfiguracja s1 - pierwiastki grupy 1, tworzą łatwo jony X+ i związki z tlenem X2 O
Konfiguracja s2 - pierwiastki grupy 2, tworzą łatwo jony X+ i związki z tlenem XO (wyjątki He, całkowicie zapełnienie powłoki n=1 - gaz szlachetny)
Konfiguracja s2d1 - s2d10 pierwiastki metaliczne grupy 3 - 12 tworzą najczęściej jony X2+ i X3+ i z tlenem tworzą związki XO, X2O3. Pierwiastki te pojawiają się dopiero w 4 okresie, ponieważ orbitl 4s jest częściej obsadzony elektronami niż orbitl 3d.
Konfiguracja s2p1 pierwiastki 13 grupy tworzą łatwo jony x3+ i związki z tlenem X2O3.
Konfiguracja s2p2 pierwiastki 14 grupy tworzą łatwo jony X2+, X4+, X4-, związki z tlenem XO, XO2 i wodorem XH4.
Konfiguracja s2p3 pierwiastki 15 grupy, tworzą łatwo jony X3+, X5+, X3- i związki z tlenem X2O3 i z wodorem XH3.
Konfiguracja s2p4 pierwiastki 16 grupy tworzą łatwo jony X4+, X 6+, X2-, związki z tlenem XO2, XO3, i związki z wodorem H2X
Konfiguracja s2p5 pierwiastki 17 grupy łatwo tworzą jony X+, X3+, X 5+, X 7+, X-, związki z tlenem X2H…X2O7 i związki z wodorem HX
Konfiguracja s2p6 pierwiastki 18 grupy, całkowicie zmieniona powłoka, bardzo łatwa konfiguracja - bierna chemiczne - gazy szlachetne.
Pierwiastek o Z =10, leży w 18 grupie, jest więc gazem szlachetnych, obojętnie chemicznie pierwiastkiem.
1X 1s2 1 okres, 1 grupa X+ , X2 O
7X 1s2 2s2 2p3 2 okres, 15 grupa X3+, X5+, X3- X2O3 , XH3
21X 1s2 2s2 2p6 3s 23p64s23d1 4 okres, 3 grupa XO X+
Okresowość zmian właściwości pierwiastków w układzie okresowym :
Okresowo tzn. w grupie i w okresach zmieniają się następujące właściwości pierwiastków
Promienie atomów
Promienie kationów i anionów jednoatomowych
Potencjał jonizujący (Ej - energia jonizująca niezbędna do oderwania elektronu)
Powinowactwo elektronowe (Ep - energia wydalona podczas przyłączenia elektronu)
Elektroujemność Eu (Eu bezwzględne = Ej + Ep, Eu paulinga = Eu/Eu litu)
Właściwości kwasowe i zasadowe tlenków
Moc kwasów i zasad
Wyszukiwarka