WPŁYW TEMPERATURY I KATALIZATORA NA SZYBKOŚĆ REAKCJI CHEMICZNEJ |
ĆW.14. |
Cel ćwiczenia
Celem eksperymentu jest zbadanie wpływu wzrostu temperatury i dodatku katalizatora na szybkość rozpadu związku kompleksowego [Fe(S2O3)6]9-. Kompleks o wzorze [Fe(S2O3)6]9- tworzy się w bardzo szybkiej reakcji chemicznej roztworów chlorku żelaza(III) i tiosiarczanu(VI) sodu. Po zmieszaniu roztworów natychmiast pojawia się intensywne czerwono-fioletowe zabarwienie, które po pewnym czasie zanika. Powodem zaniku barwy jest powolna reakcja redukcji jonów żelaza(III), Fe3+ przez jony tiosiarczanowe(VI), S2O32-, co prowadzi do rozpadu kompleksu:
1) Fe3+ + 6 S2O32- ↔ [Fe(S2O3)6]9- czerwono - fioletowe zabarwienie
2) 2Fe3+ + 2S2O32- ↔ 2Fe2+ + S4O62- roztwór bezbarwny
Szybkość reakcji rozpadu barwnego kompleksu można wyrazić jako V=1/t (t - czas reakcji).
.
Odczynniki:
► 1,0 M tiosiarczan(VI) sodu, Na2S2O3 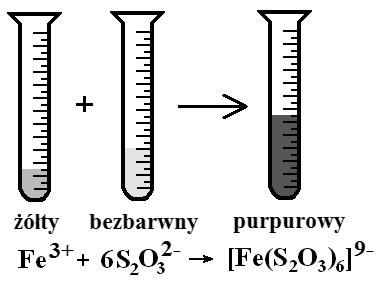
► 1,0 M chlorek żelaza(III), FeCl3
► 1,0 M siarczan(VI) miedzi(II), CuSO4
Sprzęt laboratoryjny:
► probówki z podziałką
► zlewka o pojemności 250 cm3
► termometr
► stoper
Wykonanie ćwiczenia:
Ćwiczenie obejmuje cztery pomiary szybkości reakcji rozpadu [Fe(S2O3)6]9- w różnych warunkach, przy zachowaniu tych samych stężeń substratów.
Pomiar pierwszy należy wykonać w temperaturze pokojowej. W tym celu do jednej probówki dodaj 3 cm3 1 M tiosiarczanu(VI) sodu, Na2S2O3, a do drugiej 2 cm3 1 M chlorku żelaza(III), FeCl3. Następnie zmieszaj ze sobą roztwory, wlewając szybkim ruchem zawartość pierwszej probówki do roztworu chlorku żelaza(III) i mieszaj przez wstrząsanie. Zmierz czas od chwili zmieszania roztworów do chwili zaniku czerwono-fioletowej barwy.
Drugi pomiar należy wykonać w temperaturze pokojowej, ale z dodatkiem katalizatora. W tym celu należy napełnić probówki roztworami tiosiarczanu(VI) sodu oraz chlorku żelaza(III), jak w pierwszym doświadczeniu i dodać do probówki zawierającej chlorek żelaza(III) 1-2 kropli roztworu siarczanu(VI) miedzi(II), CuSO4. Zmieszaj roztwory i zmierz czas do chwili zaniku barwy.
Pomiar trzeci i czwarty wykonaj analogicznie, jak pomiar pierwszy, lecz temperatura pomiaru trzeciego musi być wyższa o 10˚C, a czwartego - o 20˚C od temperatury otoczenia. W zlewce o pojemności 250 cm³ należy przygotować łaźnię wodną. Dodaj 3 cm3 1,0 M roztworu tiosiarczanu(VI) sodu do pierwszej probówki, a do drugiej - 2 cm3 1 M roztworu chlorku żelaza(III). Probówki z roztworami umieść w łaźni wodnej o odpowiedniej temperaturze, odczekaj 15 minut, aby roztwory uzyskały temperaturę kąpieli wodnej. Następnie zmieszaj roztwory i zmierz czas do chwili zaniku barwy.
W każdym doświadczeniu zanotuj temperaturę i czas reakcji.
Obliczenia:
Za miarę szybkości reakcji przyjmujemy odwrotność czasu jej całkowitego przebiegu V~1/t. Wzór van΄t Hoffa określa wpływ temperatury na szybkość reakcji: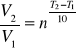
gdzie: V1- szybkość reakcji w temp. T1
V2- szybkość reakcji w temp. T2
n - współczynnik temperaturowy reakcji.
Najczęściej wzrost temperatury o 10˚C podwaja szybkość reakcji, o ile nie ma odstępstwa od reguły van't Hoffa. Z danych doświadczalnych wylicz współczynnik temperaturowy reakcji biorąc pod uwagę pomiar 1 i 3 oraz 1 i 4. Wylicz wartość średnią współczynnika temperaturowego.
Wyniki:
Próbka |
Temp. doświadczenia [˚C] |
czas reakcji t [s] |
szybkość reakcji V (1/t) |
współczynnik temp. reakcji n |
wartość średnia n |
1
|
|
|
|
- |
- |
2 (katalizator) |
|
|
|
- |
- |
3
|
|
|
|
|
|
4
|
|
|
|
|
|
Dyskusja:
1. Wyjaśnij wpływ obecność katalizatora na szybkość reakcji chemicznej?
2. Zdefiniuj pojęcie energii aktywacji. Stała szybkości k pewnej reakcji pierwszego rzędu w temperaturze 18°C wynosi 3,00 s-1, natomiast w temperaturze 30°C wynosi 4,35 s-1. Korzystając z równania Arrheniusa oblicz energię aktywacji Ea tej reakcji,
Wyszukiwarka