REAKCJE HOMOGENICZNE I HETEROGENICZNE
|
ĆW. 3. |
Cel ćwiczenia
Termin reakcje homogeniczne stosuje się do reakcji, w których reagujące substancje (substraty) są w tym samym stanie skupienia, najczęściej ciekłym lub gazowym. W reakcjach heterogenicznych substraty są w różnych stanach skupienia. W ćwiczeniu opiszemy trzy przykłady reakcji; niektóre z nich są homogeniczne, inne heterogeniczne.
Odczynniki:
► 0,1 M wodorotlenek sodu, NaOH
► 0,1 M kwas solny, HCl
► 0,25 M chlorek baru, BaCl2
► 0,25 M siarczan(VI) sodu, Na2SO4
► stały tlenek wapnia, CaO
► roztwór fenoloftaleiny
Sprzęt laboratoryjny:
► statyw na probówki
► 3 probówki
► łopatka szklana
► bagietka szklana
► cylinder miarowy o pojemności 10 cm3
Wykonanie ćwiczenia:
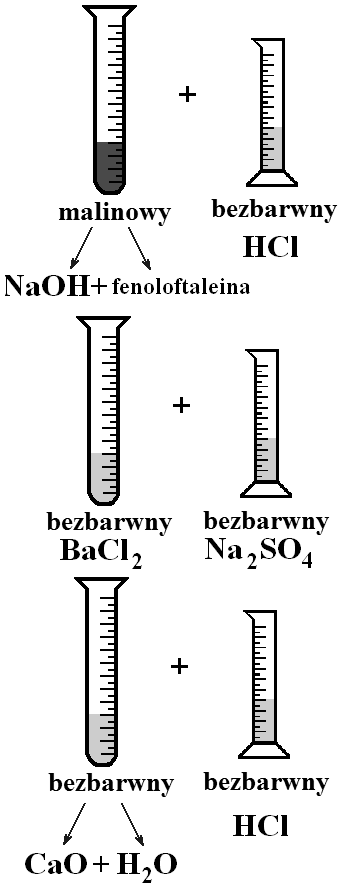
Do pierwszej probówki wlej około 2 cm3 roztworu wodorotlenku sodu, NaOH, 2 krople roztworu fenoloftaleiny oraz około 3 cm3 kwasu solnego, HCl. Obserwuj objawy reakcji.
Aby przeprowadzić następną reakcję wlej do drugiej probówki około 2 cm3 roztworu chlorku baru, BaCl2 oraz około 2 cm3 roztworu siarczanu(VI) sodu, Na2SO4. Zaobserwuj, jakie są objawy reakcji.
Do trzeciej probówki wsyp pół łopatki szklanej tlenku wapnia, CaO i dodaj około 2 cm3 wody destylowanej. Wymieszaj zawartość probówki. Następnie dodaj 3 cm3 kwasu solnego, HCl. Obserwuj zachodzące zmiany.
⇒ Obserwacje przebiegu wykonywanych reakcji chemicznych umieść w tabeli.
Wyniki:
Obserwacje |
1* |
2* |
3* |
Wydziela się gaz |
|
|
|
Zanika faza stała |
|
|
|
Zmiana zabarwienia roztworu |
|
|
|
Wytrącenie osadu |
|
|
|
Zauważalny efekt energetyczny |
|
|
|
Wstaw „+” lub „-”
Dyskusja:
1. Napisz równania przeprowadzonych reakcji chemicznych w postaci cząsteczkowej i
jonowej.
2. Uzupełnij poniższą tabelę stosując oznaczenia „+”, jeżeli uważasz, że przeprowadzona
przemiana należy do danego typu reakcji chemicznych lub „-”, jeżeli jesteś przeciwnego
zdania.
3. W każdym przypadku zaznaczenia znaku „+” uzasadnij swój wybór.
Wybrane typy reakcji chemicznych ze względu na: |
1* |
2* |
3* |
||
Rodzaj przemiany |
synteza |
|
|
|
|
|
analiza |
|
|
|
|
|
wymiana |
pojedyncza |
|
|
|
|
|
podwójna |
|
|
|
Liczba faz |
homogeniczna |
|
|
|
|
|
heterogeniczna |
|
|
|
|
Stopień utlenienia |
nieredoks |
|
|
|
|
|
redoks |
|
|
|
|
Efekt energetyczny |
endoenergetyczna |
|
|
|
|
|
egzoenergetyczna |
|
|
|
|
1* - próbówka: NaOH + HCl; 2* - próbówka: BaCl2 + Na2SO4;
3* - próbówka: CaO + H2O + HCl (napisz dwuetapowy przebieg reakcji)
Wyszukiwarka