Wodorosole:
Całkowite zobojętnienie 2KOH + H2SO4 K2SO4 + 2H2O
Niecałkowite KOH + H2SO4 KHSO4 + H2O wodorosiarczan (VI) potasu
Wodorosole pochodzą tylko od kwasów wodoroprotonowych, jeżeli zobojętnia się je zbyt małą ilością wodorotlenku.
Ca3(PO4)2 |
CaHPO4 wodorofosforan (V) wapnia | rośnie rozpuszcz.
Ca(H2PO4)2 diwodorofosforan (V) wapnia ↓
Wodorosole są zawsze lepiej rozp. niż sole obojętne.
Mg(OH)2 + 2H2S Mg(HS)2 + 2H2O wodorosiarczek magnezu
Ca(OH)2 + 2CO2 Ca(HCO3)2 wodorowęglan wapnia (twardość H2O)
KHSO4 + KOH K2SO4 + H2O wodorosól -> sól obojętną zasada
Ca3(PO4)2 + 4H3PO4 3Ca(H2PO4)2 sól obojętna -> wodorosól kwas
Hydroksosole
Całkowite zobojętnienie Ca(OH)2 + 2HBr CaBr2 + 2H2O
Niecałkowite Ca(OH)2 + HBr Ca(OH)Br + H2O bromek hydroksowapnia
Hydroksosole są produktami niecałkowitego zobojętniania wodorotl. O co najmniej dwóch grupach OH, jeżeli zobojętnia się je zbyt małą ilością kwasu
Al(OH)3 + H2SO4 Al(OH)SO4 + 2H2O siarczan (VI) hydroksoglinu
Al(OH)3 + HClO4 Al(OH)2ClO4 + H2O chloran (VII) dihydroksoglinu
Cr(OH)3 + H2SO4 Cr(OH)2SO4 + 2H2O siarczan (VI) hydroksochromu (III)
2Cr(OH)3 + H2SO4 [Cr(OH)2]2SO4 + 2H2O siarczan (VI) dihydroksochromu (III)
2Cu(OH)2 + CO2 * H2O [Cu(OH)2]2CO3 + 2H2O węglan hydroksomiedzi (II) (patyna)
Hydraty - sole uwodnione:
CaSO4 * } 2H2O } woda krystalizacyjna, występuje w kryształach; jest „uwięziona” dwuwodny siarczan (VI) wapnia
CuSO4 * 5H2O t CuSO4 + 5H2O ↑
Niebieskie kryształy; Białe kryształy;
sól uwodniona sól bezwodna
Wodę krystalizacyjną można usunąć przez ogrzewanie soli do ok. 120oC - powstaje wtedy sól bezwodna.
W czasie ogrzewania soli uwodnionej zmniejsza się masa próbki soli.
Hydroliza soli:
Odczyn roztworu soli zależy od mocy kwasu i zasady, od której pochodzi dana sól.
Odczyn soli pochodzącej od mocnej zasady i słabego kwasu:
Odczyn soli jest zasadowy, ponieważ jony soli reagują z wodą - hydroliza i jest to reakcja odwrotna do reakcji zobojętniania
Na2SO3 + 2H2O == 2NaOH + H2SO3
2Na+ + SO32- + 2H2O == 2Na+ + 2OH- + H2SO3
SO32- + 2H2O == 2OH- + H2SO3
Anion soli reaguje z wodą odczyn zasadowy
Hydroliza anionowa
Odczyn soli pochodzącej od słabej zasady i mocnego kwasu:
Odczyn soli jest kwasowy
Al(NO3)3 + 3H2O == Al(OH)3 + 3HNO3
Al3+ + 3NO3- + 3H2O == Al(OH)3 + 3H+ + 3NO3-
Al3+ + 3H2O == Al(OH)3 + 3H+
Kation soli reaguje z wodą odczyn kwasowy
Hydroliza kationowa
Odczyn soli pochodzącej od słabej zasady i słabego kwasu:
Odczyn soli jest bliski obojętnego
NH4NO2 + H2O == NH3*H2O + HNO2
NH4+ + NO2- + H2O == NH3*H2O + HNO2
Kation i anion soli
reagują z wodą
Hydrolizie nie ulegają sole pochodzące od mocnej zasady i mocnego kwasu oraz te, źle rozpuszczalne w wodzie.
Masy atomowe i cząsteczkowe podaje się w jednostce mas atomowych unitach [u].
1u = masa

masy 1 atomu węgla izotopu 12C - jednostka węglowaMasa atomowa - masa jednego atomu wyrażona w u.
Masa cząsteczkowa - masa jednej cząsteczki wyrażona w u; jest sumą mas wszystkich atomów wchodzących w skład cząsteczki.
Aby przeliczyć masę atomową lub cząsteczkową na gramy lub odwrotnie korzystamy z przelicznika: 1g = 6,02 * 1023u
Mol jest jednostką liczności materii w układzie SI. Mol każdej subst. zawiera 6,02*1023 cząstek (atomów, jonów, cząsteczek…)
Liczba 6,02*1023 nosi nazwę liczby Avogadra (NA) i wrażona jest w
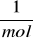
Wzorcem jednego mola jest ilość atomów zawartych w 12g węgla izotopu 12C.
Definicja 1 mola:
Mol danej substancji to taka ilość tej substancji, która zawiera tyle samo cząstek, ile atomów węgla zawartych jest w 12g węgla izotopu 12C.
Znając liczbę moli subst. n można zawsze obliczyć, ile to stanowi cząstek:
N = n * NA N - liczba cząstek
n - liczba moli
NA - liczba Avogadra
Masa molowa (M) - masa jednego mola substancji, wyrażana w
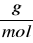
. Jest ona zawsze liczbowo równa masie cząsteczkowej lub masie atomowej wyrażonej w u.
m = n * M m - masa substancji [g]
n - liczba moli
M - masa molowa
Objętość molowa - objętość 1 mola substancji. Można ją obliczyć w danych warunkach, jeżeli znana jest w nich gęstość.
![]()
![]()
d H2O = 1 g/cm3
Gęstość gazów zależy nie tylko od temp., ale również od ciśnienia. Najczęściej podaje się ją dla warunków normalnych (temp. = 0oC, ciśnienie = 1013hPa).
Objętość molowa gazów nie zależy od rodzaju gazu, a tylko od warunków ciśnienia i temp., a dla warunków normalnych wynosi Vmol = 22,4 dm3/mol
Jeżeli dla warunków normalnych znana jest liczba moli gazu, to można obliczyć, jaką to stanowi objętość.
V= n * Vo V - objętość
n - liczba moli
Vo - objętość molowa w warunkach norm.
Gaz doskonały, to taki, w którym cząsteczki traktuje się jako punkty materialne. Przy niewielkich ciśnieniach, gazy rzeczywiste można traktować jak gaz doskonały.
p V = n R T p - ciśnienie [hPa]
V - objętość [dm3]
n - liczba moli
R - stała gazowa ![]()
T - temperatura [K]
![]()
jeśli n = const.
![]()
![]()
Gęstość gazu w warunkach normalnych można obliczyć znając wzór gazu:
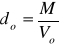
do - gęstość gazu
M - masa molowa
Vo - objętość gazu
Średnią masę molową mieszaniny gazów oblicza się jako średnią ważoną.
![]()
![]()
Gęstość względna dwóch gazów w danych warunkach:
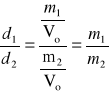
Wyszukiwarka