TLEN
Najbardziej rozpowszechniony pierwiastek w naszym otoczeniu.
Litosfera ~ 46 % wagowo (skały)
Hydrosfera ~ 85 % wagowo (woda)
Atmosfera ~ 23 % wagowo (tlen O2 i ślady O3).
„Odkrycie” tlenu C. W. Scheele i J. Priestley (1773-1774).
Lavoisier - wykazanie pierwiastkowego charakteru tlenu, odrzucenie teorii „flogistonu”.
Tlen wolny O2, atmosfera ziemska.
Skład atmosfery (% objętościowy)
N2 78.08 %, O2 20.95 %, Ar 0.95 %, CO2 0.03 %, ślady Ne, He, Kr, Xe, O3 i ślady innych gazów (związki chemiczne).
Pochodzenie tlenu atmosferycznego (od 3 miliardów lat), asymilacja.
![]()
H2O + CO2 = O2 + {CH2O} ΔH = + 469 kJ. (chlorofil, hν)
Niewielki udział fotolizy wody 2H2O 2H2 + O2
Produkcja tlenu.
Adiabatyczne rozprężanie sprężonego powietrza, chłodzenie dzięki efektowi Joule'a - Thomsona, destylacja skroplonego powietrza.
Ulepszeniem jest metoda Georgesa Claude - chłodzenie dzięki adiabatycznemu rozprężaniu sprężonego powietrza, w którym wykonuje ono pracę.
Otrzymywanie tlenu w laboratorium.
Rozkład termiczny niektórych tlenków:
2Ag2O → 4Ag + O2 (reakcja redoks - około 160 oC)
2HgO → 2Hg + O2 (reakcja redoks - około 370 oC)
Rozkład termiczny niektórych soli:
2KMnO4 → K2MnO4 + MnO2 + O2 (reakcja redoks - około 240 oC)
K2MnO4 - manganian (VI) potasu, zielony związek, w roztworach wodnych przy pH = 7 nietrwały.
2KClO3 → 2KCl + 3O2 (redoks, w obecności MnO2 150-300 oC)
katalizator - substancja która formalnie nie bierze udziału w reakcji ale ją przyśpiesza. Katalizator nie zmienia położenia równowagi reakcji, lecz przyśpiesza dojście do niego.
Inhibitor - substancja która formalnie nie bierze udziału w reakcji, ale ją spowalnia.
Bez katalizatora - reakcja z udziałem KClO4.
2KClO3 → KCl + KClO4 + O2 (reakcja redoks, około 400 oC)
4KClO3 → KCl + 3KClO4 (reakcja dysproporcjonowania, około 350 oC)
ostatni etap KClO4 → KCl + 2O2
Rozkład katalityczny H2O2 2 H2O2 → 2 H2O + O2
Reakcja Na2O2 z wodą. Rozkład H2O2 w środowisku alkalicznym.
2Na2O2 + 2H2O → 2 H2O2 + 2 NaOH 2 H2O2 → 2 H2O +O2
Reakcja KMnO4 z H2O2 w środowisku kwaśnym
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2 + 8H2O
redukcyjne właściwości H2O2.
Zapisz podaną reakcję w postaci jonowej.
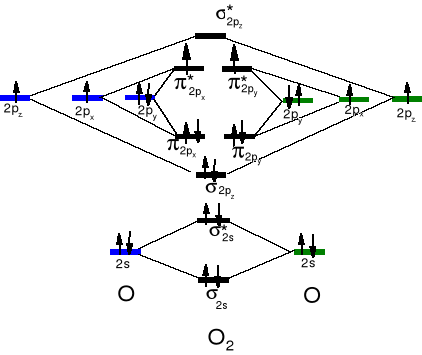
Właściwości tlenu.
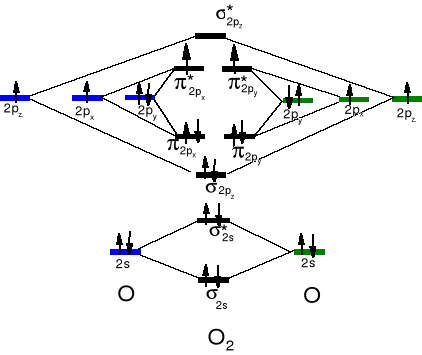
Pierwiastek silnie elektroujemny (3,4), duże powinowactwo elektronowe (+141 kJ . mol- i -844 kJ . mol-) , silny utleniacz, stopnie utlenienia w związkach -2, -1 (H2O2), -½ (KO2), +2 (F2O). Tendencja do tworzenia wiązań podwójnych. T. w. - 183 ºC, daje się skroplić przy użyciu ciekłego azotu. Paramagnetyczny gaz.
Spalanie niektórych substancji w tlenie.
Metale
3Fe + 2O2 → Fe3O4 (tlenek zasadowy)
2Mg + O2 → 2 MgO (tlenek zasadowy)
MgO + H2O → Mg(OH)22Na + O2 → Na2O2 (nadtlenek sodu, zasadowy)
Na2O2 + H2SO4 = 2Na2SO4 + H2O2
H2O2 + 2KI + H2SO4 = K2SO4 + I2 + 2 H2OK + O2 → KO2 (ponadtlenek potasu, zasadowy)
Niemetale
P4 + 5O2 → P4O10 (tlenek kwasowy)
P4O10 + 6 H2O → 4 H3PO4S + O2 → SO2 (tlenek kwasowy)
SO2 + H2O = H2SO3C + O2 → CO2 (tlenek kwasowy)
CO2 + H2O = H2CO3 (słaby kwas węglowy)
Metale (litowce i berylowce), tlenki jonowe O2-, konfiguracja elektron. neonu. O2- bardzo silna zasada, nie istnieje w roztworze wodnym,
O2- + H2O → 2OH- zupełnie podobnie O2- + NH3 → OH- + NH2-
Jon O2- mały i ładunek 2e - entalpia sieci krystalicznej duża.
Ciała stałe, stopione przewodzą prąd elektryczny, kryształy jonowe. Wysoka temperatura topnienia.
Niemetale, wiązania kowalencyjne, gazy, ciecze lub ciała stałe. Bezwodniki kwasowe. Kryształy kowalencyjne, np. (SiO2)n lub w większości przypadków molekularne, np. P4O10, SO3, stały CO2.
SiO2 + 2NaOH → Na2SiO3 + H2O SiO2 + Na2O → Na2SiO3
Stopień utlenienia a właściwości kwasowo zasadowe tlenków.
Im wyższy stopień utlenienia tym właściwości kwasowe silniejsze.
CrO + 2 HCl → CrCl2 + H2O ( tylko właściwości zasadowe)
Cr2O3 + 6 HCl → 2 CrCl3 + 3 H2O (właściwości zasadowe)
Cr2O3 + 6 KOH + 3 H2O → 2 K3[Cr(OH)6] (właściwości kwasowe)
Zatem wykazuje właściwości amfoteryczne.
CrO3 + 2 KOH = K2CrO4 + H2O (właściwości kwasowe)
Ciekły tlen. Niebieskawa ciecz, przyciągana do biegunów magnesu. Silny utleniacz → materiały wybuchowe.
Właściwości elektronowe tlenu.
W stanie podstawowym ma
dwa niesparowane elektrony.
Jest paramagnetycznym gazem,
Skroplony jest niebieski. Stan
podstawowy elektronowy tlenu
jest stanem trypletowym.
Multipletowość spinowa = 2S +1 S - suma wartości bezwzględnych spinowych liczb kwantowych dla danej cząsteczki czy też atomu.
Dla dwóch niesparowanych elektronów 2 x ½ = 1 lub 2 x (-½) = 1
Zatem jest to stan trypletowy.
Znaczenie stanu trypletowego tlenu dla życia. Stan trypletowy łatwo
reaguje także z trypletami, jednak większość cząsteczek jest singletami
Reaktywność tlenu zatem w normalnych warunkach nie jest bardzo wysoka. Tlen sigletowy jest znacznie bardziej reaktywny.
Stany elektronowe odpowiadające konfiguracji elektronowej (π*)2 dla cząsteczkowego tlenu.
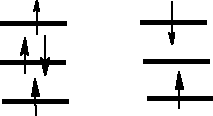
1O2* 155 kJ . mol-1
1O2 92 kJ . mol-1
3O2 0 kJ . mol-1
(π*2px) (π*2py)
Otrzymywanie singletowego tlenu
Cl2 rozpuszczamy w CCl4
Cl2 + 2OH- → Cl- + ClO- + H2O
ClO- + H2O2 → Cl- + 1O2 + H2O
1O2 → 3O2 + hν (emisja czerwonego światła)
Zastosowanie tlenu.
Olbrzymie, wagowo trzeci produkowany odczynnik przemysłowy.
Podniesienie temperatury spalania, przemysł stalowy - (proces Bessemera), piece do wytopu żelaza, innych metali oraz szkła.
Kwas siarkowy (VI) H2SO4 - krew przemysłu chemicznego
Produkcja TiO2 TiCl4 + O2 = TiO2 + 2 Cl2 (1000 - 1400 oC)
Produkcja tlenku etylenu 2 H2C=CH2 + O2 = 2 H2C CH2
produkcja tlenku propylenu
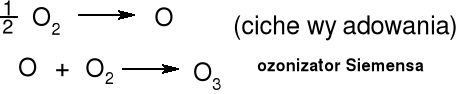
Produkcja ozonu i jego zastosowanie jako utleniacza
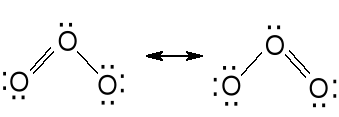
Ozon
Technicznie otrzymuje się przez ciche wyładowania elektryczne w tlenie (stężenie do 10 %). Niebieski diamagnetyczny gaz. Podgrzany ulega rozkładowi O3 = 1,5 O2 - 142 kJ . mol-1. Skroplony jest ciemnoniebieską cieczą o wybuchowych właściwościach. Zastosowanie - uzdatnianie wody pitnej, uzdatnianie wody w basenach pływackich, bielenie. Chemia organiczna - procesy ozonolizy podwójnego wiązania.
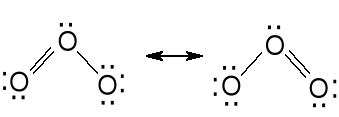
Odległość O-O (poj.) w HOOH 149 pm
Odległość O-O w O3 128 pm.
Odległość O-O w O2 121 pm.
Zatem wiązanie O-O w ozonie ma w 50 % charakter wiązania podwójnego.
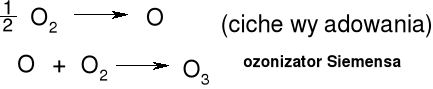
Otrzymywanie ozonu.
Powolne utlenianie białego fosforu
P4 + 6 O2 → P4O10 + O2* (2O) O2* + 2O2 → 2O3 (O + O2 → O3)
Bardzo silne właściwości utleniające, szczególnie w środowisku kwaśnym.
O3(g) + 2H+(aq) + 2e = O2(g) + H2O(l) E0 = + 2.075 V
2KI + O3 + H2SO4 → I2 + K2SO4 + H2O + O2 (papierek jodoskrobiowy)
PbS + 4O3 → PbSO4 + 4O2
Roztwór wodny bardziej trwały przy bardzo wysokim pH.
Rola ozonu w przyrodzie.
Wyładowania elektryczne w troposferze (do 16 km, tropopauza - 56 ºC) zanieczyszczenie, (powietrze po burzy) 3O2 = 2O3
Szkodliwy, trujący składnik atmosfery.
Stratosfera (do 50 km, temp. wzrost do -2 ºC) - niezbędny składnik
![]()
![]()
O2(g) 2 O(g) i O(g) + O2(g) → O3(g) + Δ H < 0
Rola ochronna O3(g) O2(g) + O(g)
Rośliny lądowe - pojawiły się dopiero, gdy było dość tlenu do wytworzenia warstwy O3 w stratosferze.
ALOTROPIA, POLIMORFIZM, IZOMORFIZM.
Alotropia - odnosi się do pierwiastków chemicznych. Ten sam pierwiastek istnieje w różnych odmianach. Odmiany alotropowe pierwiastka chemicznego, z reguły różny sposób powiązania atomów w cząsteczkach pierwiastka, (grafit - diament), (tlen - ozon) lub odmiany krystalograficzne (siarka jednoskośna - siarka rombowa)
Polimorfizm - odnosi się do związku chemicznego. Ten sam związek chemiczny zależnie od warunków istnieje w różnych odmianach. Odmiany polimorficzne z reguły różnią się strukturą krystaliczną. ZnS - wurcyt (układ heksagonalny) i ZnS - blenda cynkowa (układ regular.)
Izomorfizm - różne substancje posiadają ten sam typ wzoru chemicznego i podobny rozmiar komórki elementarnej. Są to substancje izomorficzne i tworzą kryształy mieszane (roztwór stały o dowolnym stężeniu).
Np. K2SO4 . Al2(SO4)3 . 24H2O i K2SO4 . Cr2(SO4)3 . 24H2O
KClO4 i KMnO4
KCl i KBr (Cl- 181 pm) i (Br- 196 pm)
promienie jonów zbliżone
Ale nie KCl (K+ 152 pm) i NaCl (Na+ 116 pm)
za duża różnica promieni jonów.
7
![]()
![]()
![]()
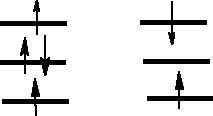
Wyszukiwarka