Magdalena Lisiecka
Katarzyna Krysiuk
Grupa V, zespół VI
Wydział Medycyny Weterynaryjnej
„Pomiar wilgotności powietrza za pomocą psychrometru.
Wyznaczanie stosunku ciepła właściwego gazu przy stałym ciśnieniu do molowego ciepła właściwego przy stałej objętości (c= cp/cv)”
Zjawisko parowania- przejście substancji z fazy ciekłej do fazy gazowej. Zachodzi na powierzchni cieczy i dotyczy drobin posiadających największą energię, mogącą przeciwstawić się siłom przyciąganie międzycząsteczkowego. Szybkość parowania zależy od wielkości powierzchni parującej, rodzaju cieczy, temperatury i ciśnienia.
Zjawisko wrzenia- parowanie cieczy całą objętością - gwałtowny skok tempa parowania.
Gaz - substancja będąca w stanie lotnym w temperaturze wyższej od temperatury krytycznej.
Para - substancja znajdującą się w stanie lotnym w temperaturze niższej od temperatury krytycznej.
Aby ją skroplić należy ją sprężyć bez obniżania temperatury.
Izotermą pary to krzywa obrazującą proces przemiany par przy stałej temperaturze.
Para nasycona to przykład pary, która jest w równowadze dynamicznej z cieczą, z której powstała.
Jeżeli rośnie temperatura to rośnie gęstość i ciśnienie pary nasyconej. Własnościami opisującymi parę
nasyconą są: ciśnienie, temperatura nasycenia, objętość właściwa i gęstość.
Masę pary wodnej zawartej w 1m3 powietrza można określić liczbowo jako wilgotność bezwzględną.
(m - masa pary wodnej, V - objętość powietrza)
Wilgotność względną to stosunek aktualnej wilgotności bezwzględnej do wilgotności
bezwzględnej odpowiadającej stanowi nasycenia powietrza parą wodną w tej samej temperaturze.
Psychrometr jest to przyrząd służący do określenia względnej wilgotności powietrza, składający się z
dwóch termometrów, z których jeden posiada zbiorniczek rtęciowy owinięty cienką warstwą tkaniny zwilżoną wodą. Do wskazywania aktualnej temperatury powietrza służy termometr suchy, zaś termometr wilgotny wskazuje niższą od aktualnej temperatury powietrza. Różnica pomiędzy wskazaniami tych termometrów określa względną wilgotność powietrza. Im różnica jest większa tym wilgotność jest mniejsza. Określona ilość pary wodnej w powietrzu pełni niezwykle istotną rolę w życiu człowieka, zwierząt i roślin. Wilgotność otoczenia wpływa między innymi na termoregulację ustroju, jak również na transpirację roślin.
Pierwsza zasada termodynamiki (zasada zachowania energii)
Jeżeli przyjmiemy, że masa reagującego układu praktycznie nie ulega zmianie w czasie zachodzących w nim procesów fizycznych i chemicznych to pierwsza zasada termodynamiki mówi nam, że:
zmiana energii wewnętrznej układu U będzie wynikiem wymiany energii przez układ na sposób ciepła Q oraz przekazania energii przez układ otoczeniu, bądź dostarczeniu energii do układu z otoczenia na sposób pracy W.
Wiąże to następująca zależność: ΔU = Q + W
ΔU - zmiana energii wewnętrznej układu, tj. zmiana całkowitej zawartości energii wszystkich atomów i cząsteczek układu,
Q - energia wymieniona przez układ z otoczeniem na sposób ciepła,
W - energia przekazana przez układ otoczeniu bądź dostarczona do układu z otoczenia na sposób pracy.
Z energii układu można wydzielić energię kinetyczną i potencjalną całości układu lub jego makroskopowych części. Pozostała cześć energii układu nazywa się energią wewnętrzną:
Eu=Ek+Ep+U
Ek - makroskopowa energia kinetyczna układu,
Ep - makroskopowa energia potencjalna układu,
U - energia wewnętrzna.
Głównymi składnikami energii wewnętrznej są:
I. energia kinetyczna ruchu postępowego i obrotowego cząsteczek.
2. energia ruchu drgającego atomów w cząsteczce,
3. energia potencjalna w polu wzajemnego przyciągania się cząstek,
4. energia chemiczna związana z możliwością przebudowy cząstek.
5. energia stanów elektronowych,
6. energia jądrowa.
Ciepło, które układ wymienia z otoczeniem. odgrywa szczególną rolę w reakcjach chemicznych i zależy od tego, czy reakcja przebiega izobarycznie czy izochorycznie. Ciepłem reakcji chemicznej nazywamy energię wymienioną na sposób ciepła między układem, w którym zachodzi reakcja chemiczna. a otoczeniem, gdy przereaguje taka liczba substratów, jaka jest podana w równaniu stechiometrycznym. Wartość ciepła reakcji zależy m.in. od warunków, w jakich reakcja przebiega. Rozróżniamy ciepło reakcji pod stałym ciśnieniem (zmiana entalpii) oraz ciepło reakcji w stałej objętości (zmiana energii wewnętrznej). Reakcja jest egzotermiczna, gdy ΔU<O lub ΔH<O; układ oddaje wtedy ciepło do otoczenia. Reakcja jest endotermiczna. Gdy ΔU>O lub ΔH>O; układ pobiera ciepło z otoczenia.
Temperatura to wielkość fizyczna określająca zdolność układu makroskopowego do przekazywania ciepła; układ o temperaturze wyższej przekazuje ciepło będącemu z nim w kontakcie układowi o temperaturze niższej, aż do wyrównania temperatur. Jednostką temperatury w układzie SI jest kelwin (K).
W termodynamice temperatura jest jednym z parametrów określających stan układu makroskopowego - jest jednakowa dla wszystkich części układu izolowanego od otoczenia, znajdującego się w stanie równowagi termodynamicznej
Gazem doskonałym nazywamy hipotetyczny gaz, którego cząsteczki nie przyciągają się wzajemnie,
są nieskończenie małe i sztywne (wewnątrz drobin nie występują drgania) oraz znajdują się w ciągłym ruchu, a ich zderzenia są doskonale sprężyste. Opisane jest równaniem Clapeyrona:
pV=nRT=kbTN
p - ciśnienie,
V - objętość,
n - ilość moli gazu,
R - stała gazowa,
T - temperatura,
kb - stała Boltzmanna,
N - liczba cząsteczek gazu.
Gaz, który nie spełnia praw ustalonych dla gazu doskonałego nazywamy gazem rzeczywistym.
W pewnych warunkach gaz rzeczywisty można opisać za pomocą równania van der Waalsa:
a - stała charakterystyczna dla danego gazu, uwzględniająca oddziaływanie między cząsteczkami gazu
b - stała charakterystyczna dla danego gazu, uwzględniająca skończone rozmiary cząsteczek
p - ciśnienie,
Vm = V/n - objętość molowa, gdzie:
V - objętość
n - ilość gazu w molach
T - Temperatura bezwzględna,
R - uniwersalna stała gazowa
Podstawowe równanie kinetyczno - molekularnej teorii gazów wiąże parametry makroskopowe: ciśnienie, objętość, temperaturę z parametrami mikroskopowymi: masą cząsteczki i prędkością średnią ich ruchu.
Ek - energia kinetyczna,
k - stała Boltzmanna.
i - liczba stopni swobody cząsteczki
Izoprzemiana to proces, w trakcie którego, jeden z trzech parametrów gazu, ciśnienie, temperatura lub objętość, nie zmienia się. Wyróżnia się przemiany: izochoryczne - stała objętość, izobaryczne - stałe
ciśnienie i izotermiczne - stała temperatura.
Przemiana adiabatyczna jest to proces termodynamiczny, w trakcie którego układ nie wymienia ciepła
z otoczeniem, a całość energii jest dostarczana lub odbierana z niego jako praca.
Współczynnik Poissona jest to wielkość równa stosunkowi ciepła właściwego w przemianie izobarycznej do ciepła właściwego w przemianie izochorycznej. Występuje jako parametr w prawie Poissona opisującym przemianę adiabatyczną gazu doskonałego. Współczynnik Poissona często nazywany jest kappą, od nazwy greckiej litery, którą w Polsce jest najczęściej oznaczany.
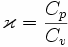
χ -współczynnik Poissona
Cp - ciepło molowe w przemianie izobarycznej
Cv - ciepło molowe w przemianie izochoryczne
χ to wykładnik adiabaty definiowany jako stosunek ciepła molowego przy stałym ciśnieniu do ciepła molowego przy stałej objętości. Ponieważ Cp > Cv , więc χ > 1. Wartość tego parametru χ zależy od rodzaju gazu, a dokładnie od ilości atomów tworzących cząsteczkę tego gazu. Oznacza to, że parametr χ zależy od liczby stopni swobody.
Ponieważ zarówno molowe ciepło właściwe przy stałym ciśnieniu, jak i molowe ciepło właściwe przy stałej objętości zależą od liczby stopni swobody, przenosząc to na parametr χ otrzymamy: CV = (i/2)R , Cp = [(i+2)/2]R
χ = Cp/Cv =(i+2)/i i - liczba stopni swobody cząsteczki gazu
|
|
Wyszukiwarka