Wydział: Inżynierii środowiska |
Nazwisko i imię: Tomasik Aleksander Świderek Piotr Szymański Tomasz Świerk Samanta Trzósło Agnieszka |
Zespół: - |
Ocena ostateczna:
|
Grupa: 8 |
Tytuł ćwiczenia: Chlor i jego oznaczenie na krzywej kalibracji |
Numer ćwiczenia: 5 |
|
Chlor reaguje z KJ w roztworze kwaśnym, wydzielając wolny jod:
Cl2 + 2I- → 2Cl- + I2
HOCl + 2I- + H+ → Cl- + I2 + H2O
OCl- + 2I- + 2H+ → Cl- + I2 + H2O
NH4Cl + 2I- + 2H+ → NH4+ + Cl- + I2
Ustalenie postaci pozostałego chloru jest bardzo ważne przy procesie dezynfekcji jak i również przy właściwościach smakowych wody. Chlor dodany do wody nie tylko się w niej rozpuszcza, ale ulega także reakcji hydrolizy chloru:
Cl2 + H2O → H+ + Cl- + HOCl
Chlor wprowadzony do wody pitnej tworzy produkty niemające własności bakteriobójczych lub produkty o takich własnościach. W praktyce zapotrzebowaniem chloru nazywa się najmniejszą ilość wolnego chloru w mgCl2/dm3 dodanego do 1dm3 wody w temperaturze pokojowej, która po upływie 30 minut daje tylko 0,1mg/dm3 pozostałego chloru użytecznego. Ilość chloru do celów przemysłowych reguluje się indywidualnie w każdej gałęzi przemysłu.
BADANIE:
Do kolby ze szlifem wlewamy 40ml wody destylowanej oraz po 10ml badanej wody czyli podchlorynu, 10% jodku potasu oraz stężonego kwasu siarkowego H2SO4 (o stężeniu 1+49). Energicznie mieszamy powstała ciecz i odstawiamy na 5 minut. Po upływie wyznaczonego wcześniej czasu miareczkujemy 0,025n Na2S2O3 do otrzymania jasno żółtej barwy (barwy słomkowej) i dodajemy skrobię, aby roztwór zabarwił się na kolor ciemno granatowy po czym znowu miareczkujemy triosiarczanem sodu (Na2S2O3). Odczytujemy zużycie triosiarczanu i podstawiamy do wzoru (w którym a jest średnią ilością zużytego Na2S2O3):
a= (12+12)/2= 12 [mlNa2S2O3]
X= 0,886*a*1000/V [mgCl2/dm3]
X= 0,886*12*1000/10 [mgCl2/dm3]
X= 1063 [mgCl2/dm3]
METODA KOLORYMETRYCZNA:
Obliczenia:
* Metoda miareczkowa
1063 [mgCl2/dm3] - 1000 cm3
10 [mgCl2/dm3] - x
x= 9,4 cm3
Ponieważ potrzebujemy chloru na 100cm3 -0,94 cm3
* Metoda kolorymetryczna
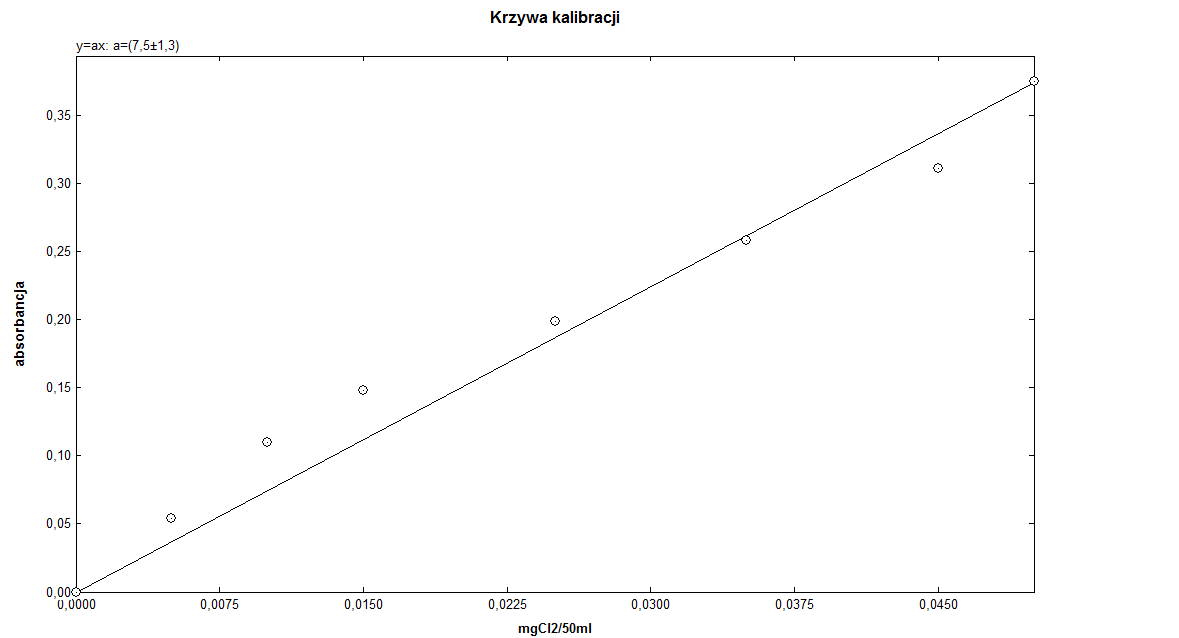
Roztwór roboczy [cm³] |
0,0 |
0,5 |
1,0 |
1,5 |
2,5 |
3,5 |
4,5 |
5,0 |
Stężenie roztworu [mg/ cm³] |
0,0 |
0,005 |
0,01 |
0,015 |
0,025 |
0,035 |
0,045 |
0,05 |
Absorpcja |
0,0 |
0,054 |
0,110 |
0,148 |
0,199 |
0,258 |
0,311 |
0,375 |
Roztwory wzorcowe:
Absorpcja
1 - 0,077
2 - 0,151
Abs= tgα*c
c= (1/tgα)*Abs*1000/V [mgCl2/dm3]
V=50[dm3]
Tgα= 7,5
c= 0,090/7,5*1000/50= 0,24 [mgCl2/dm3]
c=0,188/7,5*1000/50= 0,4 [mgCl2/dm3]
Do cylindrów Nesslera odmierzamy podane w części „y” (tabeli umieszczonej powyżej) objętości roztworu wzorcowego czyli podchlorynu i uzupełniamy woda destylowana do kreski widocznej na cylindrze (do 50ml, na początku do każdego cylindra wlaliśmy wodę- tak do ¾ wysokości każdego cylindra). Następnie dodajemy 2,5ml ortotolidyny. Po dodaniu odczynnika próbki domykamy dłonią i mieszamy delikatnie, aby substancja stała się jednorodna. Później próbkę z każdego cylindra po kolei umieszczamy w spektrofotometrze (w kuwecie 4 centymetrowej oraz o długości fali 490nm), odczytany wynik zapisujemy w ostatniej części tabeli i wykreślamy wykres zależności stężenia chloru w próbce od długości fali absorpcyjnej. W spektrofotometrze na miejscu 1 znajduję się próbka zerowa (wykonana tak samo jak pozostałe próbki z pominięciem dodania do niej podchlorynu), natomiast badana próbka znajduje się na miejscu 4.
KOMENTARZ:
Dzięki pierwszemu badaniu dowiedzieliśmy się, że badany przez nas podchloryn zawiera 806mg chloru w 1 decymetrze sześciennym. Możemy stwierdzić, że żeby otrzymać pożądane przez nas stężenie podchlorynu w 1ml musimy odmierzyć 0,94 ml podchlorynu (w myśl proporcji: 1063 [mgCl2] - 1000 ml
1,0 [mgCl2] - x ml czyli x= 1*1000/1063= 0,94 ml)
