juCYKL PENTOZOWY (pentozofosforanowy) - zachodzi w cytoplazmie, w której są niezbędne do niego enzymy. Dostarcza zredukowane NADP, potrzebnego do różnych syntez kwasów tłuszczowych i steroidów. Jest głównym dostarczycielem pentoz a zwłaszcza rybozy.
W cyklu tym droga utleniania glukozy jest krótka. W początkowej reakcji bierze udział glukozo-6-fosforan. Działa na niego, w formie piranozowej dehydrogenaza glukozo-6-fosforanowa z NADP+ jako akceptorem wodoru. Powodując utlenienie przy C1 i wytworzenie 6-fosfoglukono-δ-laktonu. 6-fosfoglukono-δ-lakton może ulec hydrolizie do kwasu 6-fosfoglukonowego. Dzieje się to pod wpływem enzymu glukonolaktonazy, której aktywatorami są jony magnezowe, manganowe i kobaltowe. Kwas 6-fosfoglukonowy ulega następnie oksydacyjnej dekarboksylacji po wpływem dehydrogenazy fosfoglukanianowej dekarboksylującej. Enzym ten współdziała z NADP. Powstaje metabolit pośredni - kwas 3-okso-6-fosfoglukonowy oraz rybulozo-5-fosforan. Rybulozo-5-fosforan pod wpływem izomerazy rybozofosforanowej ulega przekształceniu w rybozo-5-fosforan, który może być wykorzystywany do syntez nukleotydów. Inną drogą przekształcenia rybulozo-5-fosforanu jest jego epimeryzacja do ksylulozo-5-fosforanu pod wpływem 3-epimerazy rybulozofosforanowej. Cząsteczka rybozo-5-fosforanu pod wpływem transketolazy może przyjąć dwuwęglowy fragment pochodzący z ksylulozo-5-fosforanu pod postacią aldehydu glikolowego. Powstaje sedoheptulozo-7-fosforan oraz gliceraldehydo-3-fosforan. W reakcji tej uczestniczy difosfotiamina i jony Mg2+. W dalszym ciągu reakcji cząsteczka sedoheptulozo-7-fosforanu może oddać trójwęglowy fragment pod postacią dihydroksyacetonu, który z gliceraldehydo-3-fosforanem wytworzy cząsteczkę fruktozo-6-fosforanu. Reakcję tę katalizuje transaldolaza.
Cykl ten może być związany z procesem glikolizy. W procesie utleniania glukozy powstają 2 cząsteczki zredukowanego NADP oraz wydziela się cząsteczka CO2. Wytwarzane pentozy mogą być zużywane do biosyntezy nukleotydów i kwasów nukleinowych. Jeśli cukry nie zostaną wykorzystane to między sobą tworzą związki dwu-, siedmiowęglowe.
Bilans energetyczny - w wyniku tego cyklu powstaje 6 cząsteczek glukozy i 6 cząsteczek CO2. poza tym powstaje 6 cząsteczek pentoz, z których morze być utworzonych 5 cząsteczek heksoz.
1. dehydrogenaza glukozo-6-fosforanowa
2. glukonolaktaza
3. dehydrogenaza fosfoglukonionowa dekarboksylująca
4. izomeraza rybozofosforanowa
5. 3-epimeraza rybulozofosforanowa
6. transketolaza
7. transaldolaza
METABOLIZM GALAKTOZY - ulega ona fosforylacji przekształcając się w galaktozo-1-fosforan przy udziale specyficznej galaktokinazy wyodrębnionej z erytrocytów wątroby oraz innych narządów. Galaktozo-1-fosforan w obecności UTP może zostać przeprowadzony w postać UDP-galaktozy. Jest to proces enzymatyczne, w którym wydziela się pirofosforan. Pod wpływem epimerazy UDP-glukozowej, UDP-galaktoza może być przekształcona w UDP-glukozę.
METABOLIZM FRUKTOZY - fruktozo-6-fosforan powstający w cyklu pentozofosforanowym może być przekształcony w glukozo-6-foaforan, przy udziale izomerazy glukozofosforanowej. Cząsteczki wolnej fruktozy za pomocą specyficznej fruktokinazy wątrobowej i kosztem energii ATP mogą być zamieniane w fruktozo-1-fosforan. Związek ten pod wpływem aldolazy może zostać rozszczepiony na dihydroksyacetonofosforan oraz gliceraldehyd. Dihydroksyacetonofosforan jest zwykle włączany w cykl glikolizy, natomiast aldehyd zostaje utleniony do kwasu glicerynowego. Po ufrosforylowaniu przy C2 kwas ten może zostać włączony do procesu glikolizy
METABOLIZM KWASU GLUKURUNOWEGO - kwas glukuronowy przechodzi w postać aktywną jako kwas UDP-glukuronowy przez utlenianie UDP-glukozy przy udziale dehydrogenazy UDPG, 2 cząsteczek NAD+ oraz cząsteczki wody. Powstały kwas UDP-glukuronowy pod wpływem epimerazy UDP-galakturonianowej może ulec przekształceniu w kwas UDP-galakturonowy. Kwas pod wpływek reduktazy glukuronianowej oraz NADPH z kwasu glukurunowego powstaje kwas L-gulonowy. U wielu gatunków zwierząt kwas ten jest przekształcany w L-gulonolakton, a po odłączeniu 2 atomów wodoru w kwas L-askorbinowy. W tej ostatniej reakcji bierze udział oksydaza L-gulonolaktonowa. Kwas L-gulonowy może zostać przekształcony w pentozę, która zostaje włączona w przemiany cyklu pentozowego. Tego rodzaju przekształcenie kwasu L-gulonowego rozpoczyna się od jego utleniania za pośrednictwem dehydrogenazy L-gulonianowej współdziałającej z NAD+. Powstały kwas 3-oksogulonowy pod wpływem dekarboksylazy ulega przemianie w L-ksylulozę. Ostatnim etapem jest przejście L-ksylulozy w D-ksylulozę przy udziale racemazy.
SYTEZA GLIKOGENU - czynnikiem zaczynającym syntezę glikogenu jest starter. Jego funkcję pełni białko glikogenina. Potem włącza się syntaza glikogenowa. Białko to jest uwalniane przez specjalną hydrolazę po zakończeniu cząstseczki glikogenu. Zadaniem syntazy glikogenowej jest tworzenie wiązań między C4 końcowej reszty glukozowej syntezowanej cząsteczki glikogenu, a C1 aktywnej glukozy. Syntaza glikogenowa to glikozylotransferaza UDP-glukoza-glikogen. Enzym ten występuje w mięśniach. Jedna z postaci syntazy glikogenowej to syntaza D, której aktywność jest mała. Druga postać to syntaza I, niezależna od obecności glukozo-6-fosforanu, której aktywność jest duża. Syntaza D ulega przekształceniu w syntazę I przy udziale fosfatazy syntazy D. Syntaza glikogenowa nie wytwarza wiązań w miejscach rozgałęzień. Rolę tę spełnia enzym rozgałęziający amylo(1,41,6)trans-glukozydaza. Enzym ten przenosi końcowy fragment łańcucha poliglukozowego złożonego z 6 lub 7 reszt glikozylowych na grupę OH przy C6 tego samego bądź innego łańcucha. W ten sposób powstają rozgałęzienia glikogenu.
TRAWIENIE I WCHŁANIANIE LIPIDÓW - lipidy mogą być strawione gdy powierzchnia kontaktu z enzymami będzie dostatecznie duża. Muszą one zostać przeprowadzone w postać emulsji. Powoduje to żółć i kwasy żółciowe. Kwasy żółciowe wykazują właściwości detergentów obniżających napięcie powierzchniowe wody. Tłuszcze są rozkładane w przewodzie pok przy udziale odpowiednich esteraz. Tłuszcze obojętne są trawione przez lipazę trzustkową, której optymalne warunki działania podobnie jak innych enzymów rozkładających tłuszcze znajdują się w granicach pH 7-8,5. lipaza uwalnia kwasy tłuszczowe wyzwalając glicerol, mono lub diacyloglicerol. Wolne kwasy tłuszczowe mogą przyłączać kationy i przechodzić w mydła, które również wpływają na utrzymanie tłuszczu w stanie emulsji. Enzymami trawiącymi tłuszcze są liczne fosfolipazy np. fosfolipaza A i B atakują wiązania estrowe kwasów tłuszczowych w cząsteczkach fosfolipidów, lub np. fosfolipaza C i D rozszczepiają wiązania estrowe kwasu fosforowego tychże związków. Kwasy tłuszczowe o dłuższym łańcuchu ulegają związaniu z kwasami żółciowymi tworząc dobrze rozpuszczalne kwasy choleinowe. W tej postaci są wchłaniane do układu limfatycznego. Uwolnione kw żółciowe wracają przez żyłę wrotną do wątroby a natępnie ponownie przedostają się do żółci. Pewna ilość kwasów tłuszczowych przed wchłonięciem wiąże się z cholesterolem. Oprócz kw tłuszczowych do limfy mogą być wchłaniane mono i diacyloglicerole w postaci drobnych kuleczek zwanych chylomikronami. Odbywa się to drogą pinocytozy.
Β-OKSYDACJA (spirala spalania kw tłuszczowych) - jest procesem katabolitycznym, w skutek czego dochodzi do wydzielania energii. Zachodzi w mitochondriach. Proces ten jest wieloetapowy i wymaga 4 enzymów
Na aktywny kw tłuszczowy działa najpierw dehydrogenaza acylo-CoA współdziałająca z FAD, która po odszczepieniu 2 atomów H przy węglu C2 C3 powoduje wytworzeniu aktywnego kwasu tłuszczowego nienasyconego. Powstający w tej reakcji zredukowany FAD oddaje atomy wodoru do łańcucha oddechowego, natomiast kwas tłuszczowy nienasycony zostaje uwodniony przez hydratazę enoilo-CoA. Aktywny 3-hydroksykwas ulega z kolei następnemu w tym procesie odwodorowaniu przez dehydrogenazę 3-hydroksyacylo-CoA. Ostatnią reakcją B-oksydacji kwasów tłuszczowych jest tiolityczne rozszczepienie 3-oksoacylo-CoA przy udziale nowej cząsteczki CoA-SH. Reakcja ta jest katalizowana przez acylotransferazę acetylo-CoA. W wyniku rozszczepienia powstaje wolny acetylo-CoA oraz acylo-CoA krótszy o 2 atomy węgla.
Cały proces może powtarzać się cykliczne z odszczepieniem w ciągu każdego obrotu fragmentu dwuwęglowego w postaci aktywnego kwasu octowego. Kwasy tłuszczowe o parzystej liczbie atomów węgla rozpadają się w procesie B-oksydacji na cząsteczki acetylo-CoA, które mogą ulec dalszemu utlenieniu w cyklu Krebsa bądź też wykorzystane do syntez kwasów tłuszczowych i steroidów oraz reakcji acetylacji. Kwasy tłuszczowe o nieparzystej liczbie atomów węgla w cząsteczce po odłączeniu dwuwęglowych fragmentów wytwarzają ostateczny produkt w postaci propionylo-CoA, zawierającej jako koenzym biotynę.
Bilans energetyczny B-oksydacji - podczas B-osydacji nasyconych kwasów tłuszczowych mają miejsce 2 procesy odwodorowania. Pierwszy z udziałem FAD, drugi z udziałem NAD. Zredukowany FAD w łańcuchu oddechowym podczas fosforylacji oksydacyjnej dostarcza dwie cząsteczki ATP, natomiast zredukowany NAD 3 cząsteczki ATP. Zatem podczas jednego obrotu utlenienia kwasu tłuszczowego z uwolnieniem acetylo-CoA powstaje 5 cząsteczek ATP
Aktywny kwas octowy przechodząc do cyklu Krebsa po ostatecznym utlenieniu do CO2 i H2O może być dostarczycielem 12 cząsteczek ATP.
Zatem powstaje razem 17 ATP.
Ale od tego trzeba odjąć 2 wiązania wysokoenergetyczne zużytkowane na aktywację kwasu tłuszczowego aby przeprowadzić go w postać acylo-CoA. Ponadto w ostatnim obrocie spirali w przypadku kwasu o parzystej liczbie atomów węgla powstają 2 cząsteczki kwasu octowego. Skutkiem czego jedna z tych cząsteczek nie dostarczy energii równoważnej 5 cząsteczką ATP.
A zatem od całkowitej liczby cząsteczek ATP należy odjąć 7.
1. syntetaza acylo-CoA
2. acylotransferaza karnitynowa
3. O-acylotransferaza acylo-CoA: karnityna
4. dahydrogenaza acylo-CoA
5. hydrataza eniolo-CoA
6. dehydrogenaza 3-hadroksyacylo-CoA
7. acylotransferaza acetylo-CoA
GLICEROLOFOSFOLIPIDY (fosfolipidy glicerolowe) - biorą udział w mechanizmach aktywnego przenoszenia przez błony. W przewodzie pokarmowym biorą udział jako substancje towarzyszące w procesie wchłaniania kwasów tłuszczowych oraz steroli. W osoczu połączone z białkami transportują wyższe kwasy tłuszczowe. Wszystkie glicerofosfolipidy są pochodnymi kwasu glicerolofosforowego.
EIKOZANIODY - są to połączenia powstające z kwasu arachidonowego, a także z innych C20 wielonienasyconych kwasów tłuszczowych. Do tych połączeń należą substancje o silnym działaniu biologicznym: prostaglandyny, tromboksany i leukotrieny. Prostaglandyny i tromboksany należą do tzw prostanoidów. Prostanoidy są syntezowane w ciągu metabolicznym z udziałem cyklooksygenazy. Tromboksany są syntezowane w płytkach krwi. Powodują skurcz naczyń oraz agregację płytek. Przeciwnie do nich działają prostacykliny, które hamują agregację płytek. Leukotrieny powstają w leukocytach i płytkach krwi i makrofagach. Regulują one wiele procesów chorobowych z towarzyszącym im stanem zapalnym.
Powstawanie: za przekształcenie kwasu arachinydowego w formę nadtlenkową prostaglandyn PGG2 odpowiada cyklooksygenaza. W reakcji tej są zużywane 2 cząsteczki tlenu. PGG2 jest związkiem prekursorowym w biosyntezie prostanoidów. Podobnie jak powstała z niego forma z grupą OH przy C15. w przekształceniu PGG2 w powyższą formę uczestniczy peroksydaza. Przekształcenia tej formy polegające na izomeryzacji redukcji prowadzą do syntezy wielu innych prostaglandyn.
Z uwagi na różnorodność budowy prostaglandyn wyróżniono w nich wiele serii: A, B, D, E, F, G, H.
Prostaglandyny są syntezowane w błonach różnych narządów, zwłaszcza gruczołu krokowego. Różnią się one między sobą liczbą i położeniem wiązań podwójnych, grup hydroksylowych i ketonowych.
Syntetaza tromboksanowa katalizuje przekształcenia prowadzące do wytworzenia tromboksanów. Przemiana kwasu arachinowego w leukotrieny zachodzi z udziałem lipoksygenazy. Proces ten jest wieloetapowy z udziałem wielu enzymów. Prowadzi on do powstania leukotrienu C4, który zawiera przy C6 dołączoną wiązanie tioeterowym cząsteczkę glutadionu. W dalszym ciągu reakcji następuje degradacja glutationu przez odszczepianie kolejnych aminokwasów. Najpierw pod wpływem γ-glutamylotransferazy zostaje odszczepiony kwas glutaminowy. Powstaje leukotrien D4 z dołączoną cysteinyloglicyną. Następną reakcję odszczepienia glicyny katalizuje dipeptydaza cysteinyloglicynowa prowadząca do wytworzenia lukotrienu E4 zawierającego już tylko cysteinę. Na syntezie leukotrienu E4 ciąg przemian zostaje zakończony.
BIOSYNTEZA KWASÓW TŁUSZCOWYCH NASYCONYCH (WYDŁUŻANIE ŁAŃCUCHÓW) - kwasy tłuszczowe zawierające do 18 atomów C są syntezowane w cytoplazmie, natomiast ich wydłużanie odbywa się w mitochondriach. Synteza kw tłuszczowych w cytoplazmie odbywa się z udziałem układu syntetazy kwasów tłuszczowych oraz NADH jako źródła wodoru. Wytwarzanie łańcucha kwasowego rozpoczyna starter w którym jest acetylo-CoA. Do jego końca są dołączane układy dwuwęglowe pochodzące z malonylo-CoA z odszczepieniem CO2. syntetyzowany łańcuch ulega redukcji, dehydratajci i ponownej redukcji. Proces ten powtarza się wielokrotnie, aż do wytworzenia potrzebnej długości łańcucha nie przekraczającej jednak C18.
Układ syntetazy kw tłuszczowych stanowi kompleks siedmiu czynników enzymatycznych w tym 3 koenzymów. Biorą w nim udział karboksylaza acetylo-CoA, transacetylaza, enzym kondensujący, NADPH, FMN, dehydrataza aktywnych 3-hydroksykwasów oraz CoA-SH.
Podstawowymi substratami do biosyntezy kwasów tłuszczowych jest acetylo-CoA oraz CO2. acetylo-CoA jest wytwarzany w mitochondriach w procesie B-oksydacji kwasów tłuszczowych bądź na skutek dekarboksylacji oksydacyjnej i pirogronianu.
Źródłem CO2 do syntezy kw tłuszczowych może być HCO3-. Z acetylo-CoA oraz CO2 zostaje syntetyzowany malonylo-CoA, który jest dawcą fragmentu dwuwęglowego. W wytwarzaniu malonylo-CoA bierze udział karboksylaza acetylo-CoA, której koenzymem jest biotyna. Źródłem energii jest ATP. Następnym etapem jest przyłączenie dwuwęglowego fragmentu pochodzącego z malonylo-CoA do acetylo-CoA. Zanim to nastąpi obydwa rodniki muszą zostać przeniesiono z CoA na białka przenoszące acyle (ACP). ACP jest polipeptydem zbudowanym z 82 aminokwasów oraz tietanoloamidu kwasu fosfopantotenowego. Grupą czynną tego białka jest SH. Grupy acetylowe są przenoszone z acetylo-CoA na ACP-SH przez acylotransferaze acetylo-ACP. Pod wpływem enzymu kondensującego obydwa acyle połączone z ACP ulegają kondensacji. Następuje wydzielenie CO2 i odszczepienie ACP-SH. Powstaje acetoacetylo-ACP. W dalszym ciągu reakcji następuje proces redukcji acetoacetylo-ACP, katalizowanej przez reduktazę acetoaceylo-ACP współdziałającą z NADPH. Wytworzony 3-hydroksybutyrylo-ACP pod wpływem hydratazy traci cząsteczkę wody i powstaje nienasycony acylo-ACP zwany krotonylo-ACP, który ulega redukcji pod wpływem reduktazy związanej z FMN z udziałem NADPH. Powstaje butyrylo-ACP czyli kwas masłowy. Aktywny kwas masłowy, który reaguje z cząsteczką malonylo-ACP tworząc kwas oksokapronowy, który po redukcji dehydratacji i ponownej redukcji przechodzi w kwas kapronowy o 6 atomach węgla. Przez powtarzanie tego procesu w cytoplazmie komórek zwierzęcych są wytwarzane 16-węglowy kwas palmitynowy i 18-węglowy kwas sterynowy.
BIOSYNTEZA KWASÓW NIENASYCONYCH - kwasy tłuszczowe o jednym wiązaniu podwójnym są wytwarzane w wątrobie i tkance tłuszczowej. Reakcje zachodzą RE. A enzymy katalizujące ten proces stanowią prawdopodobnie zespół monooksygenazy z udziałem cytochromu b5 oraz NADH. Podwujne wiązanie powstaje zawsze w pozycji Δ9 a cały kompleks enzymatyczny odpowiedzialny za jego wytworzenie nosi nazwę 9-desaturaza. Następnym etapem jest przeprowadzenie nowo powstałego kwasu mononienasyconego w postać aktywną przy udziale transferazy acylowej, ATP i CoA-SH.
Kwasy tłuszczowe wielonienasycone - są pochodzenia egzogennego, jedynie kwas arahidonowy przy dostatecznej podaży kwasu linolowego może być syntezowany drogą desaturacji i elongacji. Elongacja przebiega w sposób charakterystyczny dla układu mikrosomalnego przy udziale malonylo-CoA oraz NADPH. Saturacja i elongacja następują po sobie w kolejności umożliwiającej wytworzenie podwójnego wiązania w odpowiednim miejscu. Wiązania nienasycone muszą być u zwierząt przedzielone grupą metylenową.
BIOSYNTEZA CHOLESTEROLU - wytwarzany jest w błonach gładkich RE. Podstawowym substratem służącym do jego wytwarzania są cząsteczki acetylo-CoA.
Biosynteza cholesterolu rozpoczyna się od łączenia dwóch cząsteczek acetylo-CoA przy udziale acetylotransferazy acetylo-CoA z uwolnieniem CoA-SH. Następnie pod wpływem syntetazy hydroksymetyloglutarylo-CoA acetoacetylo-CoA dołącza nową cząsteczkę acetylo-CoA oraz cząsteczkę wody. Powstaje 3-hydroksy-3-metyloglutarylo-CoA. Kolejny enzym ( reduktaza HMG-CoA ) powoduje redukcję 3-hydroksy-3-metyloglutarylo-CoA przy C1. W ten sposób powstaje kwas 3,5-dihydroksy-3-metylowalerianowy (kwas mewalonowy). Kwas ten zostaje następnie uaktywniony kosztem 2 cząsteczek ATP przy udziale kinazy mewalonianowej. W następnym etapie dekarboksylaza pirofosfomewalonianowa katalizuje reakcję dekarboksylacji, której towarzyszy odwodnienie. Aktywny mewalonian przechodzi w aktywny izopren. Pewna ilość izoprenu pod wpływem izomerazy izopentenylopirofosforanowej ulega przekształceniu izomerycznemu w dimetyloallilopirofosforan. Powstałe dwa izomeryczne związki izopentenylopirofosforan i dimetyloallilopirofosforan przy udziale dimetyloallilotransferazy łączą się tworząc cząsteczkę genarylopirofosforanu. Uwalnia się pirofosforan. Następna reakcją dołączenia do genarylopirofosforanu nowej cząsteczki aktywnego izoprenu katalizuje syntetaza farnezylopirofosforanowa. W wyniku tej reakcji powstaje 15-węglowy darnezylopirofosforan z wydzieleniem pirofosforanu (PP). w obecności swoistej syntetazy skwalenowej 2 cząsteczki farnezylopirofosforanu łączą się w cząsteczkę 30-węglowego skwalenu. Zostają uwolnione 2 cząsteczki pirofosforanu. W warunkach tlenowych pod wpływem hydroksenazy skwalenowej skwalen ulega cyklizacji do lanosterolu. W reakcji tej na skutek przesunięć elektronowych, a także przesunięcia grupy metylowej dochodzi do zamknięcia grupy czterech pierścieni. Lanosterol drogą różnego typu reakcji enzymatycznych zostaje ostatecznie przekształcony w cholesterol. Reakcje te polegają na odłączeniu 3 grup metylowych. Skwalen jest związkiem o 30 atomach węgla, cholesterol ma ich 27.
Głównym miejscem syntezy cholesterolu w organizmie jest wątroba. Cholesterol egzogeniczny wpływa ograniczająco na wytwarzanie tego związku.
Katalizatory (regulacja) - białko przenośnikowe skwalenu i sterolu - białko to wiążąc się ze sterolami umożliwia ich udział w reakcjach przebiegających w środowisku wodnym komórki. Dzięki połączeniu z białkiem cholesterol może zostać przekształcony w związki czynne biologicznie, kwasy żółciowe oraz brać udział w tworzeniu połączeń wchodzących w skład błon.
W syntezie cholesterolu istotne znaczenie jako element jego struktury ma aktywny izopren. Związek ten zajmuje centralne miejsce jako metabolit, z którego powstają liczne, czynne biologicznie substancje świata roślinnego i zwierzęcego.
KWASY ŻÓŁCIOWE - boczny łańcuch przy C17 jest krótszy niż w cholesterolu: kończy się grupą karboksylową. Kwasy żółciowe biorą udział w emulgacji tłuszczów zmieniając napięcie powierzchniowe substancji. Podstawowe kwasy żółciowe to: kwas cholowy i deoksycholowy, a pochodnymi kwasu cholowego są: hydroksylowe i ketonowe i są to kwasy: litocholowy, deoksycholowy, chemodeoksycholowy, chyodeoksycholowy, taurocholowy, glikocholowy, deoksytaurocholowy,
PROCES WYTWARZANIA KWASÓW ŻÓŁCIOWYCH
1. wprowadzenie grupy -OH przy C7 cholesterolu
2. epimeryzacja gr. -OH przy C3
3. redukcja pierścienia B
4. skrócenie łańcucha bocznego przy C17
5. utlenienie C25 - powstaje gr. karboksylowa
SKŁAD LIPOPROTEIN OSOCZA - Poszczególne lipoproteiny osocza różnią się zawartością białek w stosunku do tłuszczów. Proporcja ta decyduje o ich gęstości
1. lipoproteiny o bardzo małej gęstości (VLDL) - duże cząsteczki, 65% lipidów, wytwarzane w wątrobie, powodują zmętnienie surowicy
2. lipoproteiny o pośredniej gęstości (IDL) - powstają w osoczu z VLDL na skutek utraty części lipidu, stosunek nigliceroli do cholesterolu = 1:1
3. lipoproteiny o małej gęstości (LDL) - powstają z IDL w osoczu, bardzo dużo cholesterolu a mało trigliceroli, główny nośnik cholesterolu
4. lipoproteiny o dużej gęstości (HDL) - powstają w wątrobie, w jelicie cienkim i osoczu z VLDL; zawierają prawie 50% protein.
5. chylomikrony - są obecne w osoczu tylko przez kilka godzin po spożyciu tłuszczu; prawie cała zawartość to triglicerole z tłuszczu pokarmowego.
METABOLIZM (LIPOPROTEIN) VLDL, IDL I LDL -
Zadaniem lipoprotein osocza jest: transport lipidów i cholesterolu.
VLDL IDL LDL
Dzięki temu osocze dostarcza kwasy tłuszczowe do komórek i utrzymuje się odpowiednie stężenie cholesterolu w osoczu. Przekształcenia w obrębie frakcji VLDL umożliwiają dostarczanie cholesterolu z tkanek do wątroby. W przemianach lipoprotein istotną rolę odgrywają procesy lipolizy, estryfikacji cholesterolu. Po spełnieniu swojej roli cząstki lipoprotein są eliminowane z osocza przez internalizację w komórkach. Jest to możliwe dzięki receptorom w komórkach które mają wpływ na stężenie lipoprotein wewnątrz komórek:
- receptory LDL, receptory apoE dla VLDL, IDL, hylomikronów (głównie w hepatocytach)
- receptory VLDL (wszędzie oprócz wątroby i jelita cienkiego)
METABOLIZM HORMONÓW STEROIDOWYCH - biorą udział w regulacji metabolizmu, seksualności i rozrodzie. Są syntezowane z cholesterolu gruczołach płciowych i w korze nadnerczy. Wyróżniamy hormony kory nadnerczy - androgeny, estrogeny
1. GLIKOKORTYKOIDY I MINERALOKORTYKOIDY: kortykosteron, kortyzol, kortyzon, aldosteron, 11-deoksykortykosteron, 11-deoksykortyzon - są produkowane w korze nadnerczy.
Usunięcie nadnercza powoduje: wzrost poziomu mocznika we krwi, utratę wody, Na+, Cl-, spadek resorbcji glukozy w jelicie, niedowład mięśni, spadek poziomu glikogenu w wątrobie
Działanie hormonów: zwalnianie intensywności glukoneogenezy; aktywacja metabolizmu białek; zwiększa intensywność katabolizmu w mięśniach i tkance limfoidalnej; gospodarka wodna i elektrolitowa
Niedoczynność: choroba Addisona (między innymi obrzęk); kortykosteron (C11 -OH); kortyzol (C11 -OH, C17 -OH); kortyzon (C11=O, C17 -OH); aldosteron (C11 -OH); deoksykortykosteron (brak podstawników przy węglach C11 i C17); deoksykortyzol (C11 -OH)
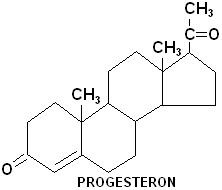
Wytwarzane są w: ciałko żółte, kora nadnerczy, łożysko - podczas ciąży
2. PROGESTERON - działanie: substrat do syntezy hormonów steroidowych; utrzymanie ciąży; pochodne - środki antykoncepcyjne, regulują cykl płciowy, aktywna forma wolna, metabolizowane w wątrobie po podaniu doustnym
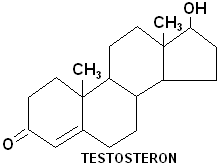
3. TESTOSTERON, ANDROSTERON, DEHYDROEPIANDROSTRON, ANDROSTENOLTION, 11-HYDROKSYTESTOSTERON: działanie: stymulacja spermatogenezy; rozwój drugorzędowych cech płciowych męskich, synteza mRNA, synteza białka, regulacja popędu płuciowego
ANDROGENY (C3 -OH; C17 -OH)
TESTOSTERON (C3=O; C17 -OH)
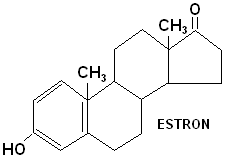
4. ESTRADIOL, ESTRON I ESTRIOL - działanie: wzrost narządu rodnego, rozwój drugorzedowych cech płciowych rzeńskich, przygotowanie rui, podtrzymanie ciąży, rozpoczęcie porodu, wzmożony rozwój tkanek, stymulacja syntezy wszystkich RNA i DNA białek.
Estradiol (C3 -OH; C17 -OH)
Estron (C3 -OH; C17=O)
Estriol (C3 -OH; C16 -OH; C17 -OH)
METABOLIZM WIT. D3 - pochodne cholesterolu są prekursorami do syntezy wit D3. pod wpływem UV następuje otworzenie pierścienia B, hydroksylacja przy C1 i C25. ogólnie aktywna forma ma grupy OH przy C1, C3, C25.
1.Próba Pettenkofera:
Służy do wykrywania kwasów żółciowych! Do roztworu żółci dodajemy kryształy sacharozy. Podwarstwiamy stężonym H2 SO4 . na granicy płynów powstaje purpurowy pierścień ze względu na występowanie grup OH w kwasach!
2.Próba Haya na wykrywanie kwasów żółciowych:
do probówki wlewamy roztwór żółci, jednocześnie do drugiej probówki dajemy taką sama ilość wody destylowanej. Na powierzchnie płynów wsypujemy odrobinę kwiatu siarczanowego. W roztworze żółci opada deszcz siarkowy, natomiast w próbie z wodą siarka zatrzymuje się na powierzchni. Przyczyną zatrzymania siarki na powierzchni wody jest jej wysokie napięcie powierzchniowe, które w obecności kw. Żółciowych zostaje obniżone.
3.Próba Salkowakiego:
Jest to próba służąca do wykrywania cholesterolu. Warunkiem tej próby jest zachowanie środowiska bezwodnego. Pod wpływem H2 SO4 następuje odłączenie 2 cząsteczek wody i połączenie 2 cząsteczek cholesterolu przy węglach C3 w bicholestadien. Jednocześnie przy węglach C7 następuje dołączenie 2 reszt sulfonowych. Powstaje kwas 2- sulfonowy o czerwonym zabarwieniu.
4.Próba Libermana- Burcharda:
Próba na wykrywanie cholesterolu. pod wpływem stężonego H2SO4 i bezwodnika kwasu octowego powstaje kwas jedno-sulfonowy, który w pierwszej fazie ma kolor czerwony, a następnie zmienia barwę na zieloną.
5.Wykazanie emulgującego działania żółci:
Do roztworu mydła dodajemy stężonego H2SO4 w celu wydzielenia wolnych kwasów tłuszczowych, które po energicznym wstrząśnięciu i odstawieniu próby gromadzą się na powierzchni płynu. Do próby wlewamy roztwór żółci i wstrząsamy. Obserwujemy rozpuszczenie się kwasów tłuszczowych.
6. Oznaczanie lipidów całkowitych w surowicy metodą sulfowanilinową:
![]()
Przygotowujemy dwie probówki. W jednej przygotowujemy próbę badaną, w drugiej wzorcową. Do obydwu dodajemy stęż. kwasu siarkowego. Dokładnie mieszamy i wstawiamy do łaźni wrzącej. Do prob. K odmierzamy stęż. H2SO4 . do wszystkich prob. dodajemy odczynnika wanilinofosforowego, a następnie zawartość każdej prob. mieszamy dokładnie oddzielną bagietką. Powstałe różowe zabarwienie próby badanej i wzorcowej kalorymetrujemy przy 530 nm. wobec próby K. Wyniki podstawiamy do wzoru
7. Oznaczanie aktywności lipazy w soku trzustkowym:
Najczęściej stosowanym substratem do oznaczania aktywności lipazy trzustkowej w soku trzustkowym jest oliwa z oliwek.
Przebieg oznaczenia: dwie małe kolbki oznaczamy jako próbę badaną i próbę kontrolną, i odmierzamy do nich równa ilość soku trzustkowego. Próbę kontrolna umieszczamy we wrzącej łaźni wodnej w celu inaktywacji enzymu. Do obydwu prób odmierzamy bufor fosforanowy, oraz emulsję oliwy. Próby umieszczamy w łaźni. Po zakończeniu inkubacji próby wyjmujemy z łaźni wodnej odmierzamy do nich etanol i fenoloftaleinę. Obydwie próby miareczkujemy roztworem NaOH do barwy jasno różowej.
Obliczenie:
Od liczby cm3 rozt. NaOH zużytego do miareczkowania próby odejmujemy wartość dla próby K i mnożymy przez 1250 w celu przeliczenia na mikromol produktu. Wynik otrzymujemy w IU aktywności enzymu. IU = (B-K) ● 1250
Wyszukiwarka