ĆWICZENIE NR 31
WYZNACZANIE IZOTERMY MIESZANIA TRZECH CIECZY
Teoria i schemat
Celem ćwiczenia jest wyznaczenie izotermy dla układu trzech cieczy, czyli sporządzenie wykresu fazowego, rozgraniczającego układ zawierający 2 fazy ciekłe i jednej ciekłej.
Układ składa się z 3 składników, z których 2 wykazują ograniczoną rozpuszczalność wzajemna, np. woda i toluen, natomiast trzeci np. metanol, rozpuszcza się w każdym z nich bezgranicznie. Stan układu określają parametry tj.: ciśnienie, temperatura, ułamki molowe składników w fazach gazowej i ciekłych.
W stałej temperaturze i pod stałym ciśnieniem najlepszym sposobem przedstawienia diagramu równowagi ciecz-ciecz jest trójkąt stężeń Gibbsa-Roosebooma, gdzie wierzchołki trójkąta odpowiadają czystym składnikom A, B, C a punkty leżące na bokach trójkąta określają skład układów dwuskładnikowych: dwuskładnikowych A+B, B+C oraz A+C. Współrzędne dowolnego punktu, leżącego wewnątrz trójkąta, określają skład układu trójskładnikowego (rys b). Linia równoległa do boku trójkąta (rys a) odpowiada układowi o stałej zawartości składnika. Linia łącząca wierzchołek trójkąta z punktem leżącym na przeciwległym boku trójkąta (rys c) reprezentuje wszystkie układy, o stałym stosunku ułamków molowych 2 składników.
Trójkąt Gibbsa-Roosebooma:
Tabela z wynikami i obliczenia
pomiar |
Woda d=0,9973 g/cm3 M=18 g/mol |
Ksylen d=0,8773 g/cm3 M=106 g/mol |
Aceton d=0,7866 g/cm3 M=58 g/mol |
||||||
|
|
|
|
||||||
|
Cm3 |
G |
% |
Cm3 |
G |
% |
Cm3 |
g |
% |
1 |
9 |
8,98 |
69 |
1 |
0,88 |
1 |
16,1 |
12,66 |
30 |
2 |
8 |
7,98 |
61 |
2 |
1,75 |
2 |
19,5 |
15,34 |
37 |
3 |
7 |
6,98 |
55 |
3 |
2,63 |
4 |
21,5 |
16,91 |
41 |
4 |
6 |
5,98 |
51 |
4 |
3,51 |
4 |
22 |
17,31 |
45 |
5 |
5 |
4,99 |
44 |
5 |
4,39 |
7 |
23 |
18,09 |
49 |
6 |
4 |
3,99 |
38 |
6 |
5,26 |
8 |
23,5 |
18,49 |
54 |
7 |
3 |
2,99 |
32 |
7 |
6,14 |
11 |
22 |
17,31 |
57 |
8 |
2 |
1,99 |
24 |
8 |
7,02 |
15 |
20,5 |
16,13 |
61 |
9 |
1 |
0,99 |
16 |
9 |
7,90 |
21 |
16,5 |
12,98 |
63 |
10 |
0,5 |
0,5 |
9 |
9,5 |
8,33 |
26 |
14,5 |
11,41 |
65 |
obliczenie ułamków molowych składników w mieszaninach jednofazowych
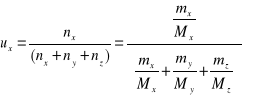
ux- ułamek molowy jaki stanowi składnik x w mieszaninie
nx, ny, nz - liczby moli poszczególnych składników
Mx My Mz -masy molowe poszczególnych składników
np. dla wody dla pomiaru 1
uH2O = ( 8,98 / 18 ) / (8,98/18 + 0,88/106 + 12,68 / 58 ) =0,68
rachunek jednostek
Tabela z wyliczonymi ułamkami molowymi
pomiar |
UH2O |
Uksylen |
Uaceton |
1 |
0,68 |
0,01 |
0,30 |
2 |
0,61 |
0,02 |
0,37 |
3 |
0,55 |
0,04 |
0,41 |
4 |
0,50 |
0,05 |
0,45 |
5 |
0,44 |
0,07 |
0,49 |
6 |
0,38 |
0,08 |
0,54 |
7 |
0,32 |
0,11 |
0,57 |
8 |
0,24 |
0,15 |
0,61 |
9 |
0,16 |
0,21 |
0,63 |
10 |
0,09 |
0,26 |
0,65 |
3. Wnioski
Celem ćwiczenia było wyznaczenie izotermy mieszania dla układu trzech cieczy, czyli sporządzenie wykresu fazowego, rozgraniczającego dwie fazy ciekłe od jednej fazy ciekłej. Został sporządzony układ trzech składników woda ksylen i trzeci taki,który rozpuszcza się w nich bez ograniczeń,w tym wypadku aceton. Zauważyłam,że wraz ze zmniejszaniem porcji wody w stosunku do porcji ksylenu objętość acetonu potrzebna do miareczkowania dwufazowej mieszaniny wody i ksylenu rosła do pewnego momentu. I tak na zmiareczkowanie 4 cm3 wody i 6 cm3 ksylenu potrzebne było 23.5 cm3 acetonu. Przy następnych proporcjach, czyli 1 cm3 wody i 9 cm3 ksylenu na zmiareczkowanie zużyto 16,5 cm 3 acetonu.
Podczas miareczkowania zauważyłam, że dla kolejnych próbek ilość rozpuszczalnika(acetonu) zwiększała się. Przy pierwszych pomiarach znacznie, lecz zbliżając się do maksimum coraz wolniej. Po osiągnięciu największej wartości, ilość acetonu potrzebna do uzyskania jednolitego roztworu zaczęła najpierw maleć małymi różnicami, które dla następnych próbek wzrastały.
Na podstawie użytych objętości i mas molowych wody ksylenu i acetonu obliczyłam masy poszczególnych składników użytych do poszczególnych pomiarów, aby następnie obliczyć ułamki molowe składników. Te z kolei posłużyły do wyznaczenia izotermy mieszania. Zauważyłam, że wraz ze zmniejszaniem się ułamków molowych wody ułamki molowe ksylenu i acetonu rosły oraz że ułamki molowe ksylenu były stosunkowo małe w porównaniu z ułamkami wody i acetonu.
Wyszukiwarka