CHEMIA OGÓLNA I NIEORGANICZNA
STECHIOMETRIA
Pojęcie mola; 12g C12, liczba Avogadry, masa molowa g/mol = a.j.m., masa 1 atomu = M/NA 1 a.j.m.= masa 1 atomu/12, Wyznaczenie liczby Avogadry (doświadczenie Rutherforda- rozpad Ra i zliczanie cząstek alfa) NA=6,022.1023
Skład procentowy związków: mass %=(masa pierwiastka w związku)/(masa związku)*100%
Określanie wzoru empirycznego: 1)Przyjąć, że masa związku=100g 2)Obliczyć liczbę moli poszczególnych pierwiastków: %pierw/Mpierw 3)podzielić przez najmniejszą z wartości do otrzymania liczb całkowitych
Prawo zachowania masy (masa produktów= masa substratów), Substrat limitujący (nadmiar/niedomiar)
STECHIOMETRIA W ROZTORACH
Właściwości wody: Budowa kątowa (105o H-H), Wiązania kowalencyjne O-H, Polarność
Rozpuszczanie: oddziaływanie polarnych cząsteczek wody z kationami i anionami w sieci krystalicznej soli
Elektrolity: Mocne (efektywnie przewodzą prąd, zawiera jony- nośniki ładunku- HNO3, NaCl), Słabe (zawiera mało jonów i jest w stanie przenieść mniej ładunków; ocet, woda z kranu), Nie-elektrolity (nie zawiera jonów i nie przewodzi prądu; czysta woda, roztwór cukru)
Mocne kwasy/zasady - dysocjują całkowicie (100%) z utworzeniem kationów H3O+/OH- w rozworze, Słabe kwasy/zasady - dysocjują w małym stopniu
Bilansowanie równań redoks w środowisku kwaśnym:
1)Bilans pierwiastków; oprócz O, H 2)Bilans O za pomocą H2O 3)Bilans H za pomocą H+
4)Bilans ładunku za pomocą elektronów
W środowisku zasadowym; 1)Tak jak kwasowe 2)Dodać OH- by zrównoważyć H+, utworzyć H2O z H+ i OH-
GAZY
Cechy: dopasowują się do naczyń, mieszają się całkowicie z innymi gazami, wywierają ciśnienie. Ciśnienie: ![]()
, 1 atm=101325 Pa, 1 atm=760mm Hg=760 Torr
Manometr - pomiar ciśnienia; Patm wysokie Pg=Patm-h, Patm niskie Pg=Patm+h
Prawo Boyle'a: V odwrotnie proporcjonalne do p V~1/p, V=k/p V,p=const
Prawo Charlesa: V proporcjonalne do T V~T, V=bT, p=const
Prawo Avogadry: V proporcjonalne do n V~n, V=an, T,p=const, niskie ciśnienia
Prawo Daltona: Pcałkowite=p1+p2+p3+… pxi=xi.pcałkowite (ciśnienie cząstkowe)
Parametry stanu gazu: intensywne- niezależne od masy(p,T), ekstensywne - zależne od masy
Gęstość gazu: ![]()
, Masa cząsteczkowa gazu:![]()
,
R=8,31J/mol.K=0,082 atm.dm3/K.mol
Założenia gazu doskonałego: Objętość można pominąć, ciągły ruch, zderzenia ze ściankami naczynia powodują ciśnienie, cząsteczki nie oddziałują ze sobą, zderzenia wyłącznie sprężyste, ruch po liniach prostych. Ek~T, Model działa dla T-wysokich, p-niskich.
![]()
, ![]()
(dla 1 mola), ![]()
(dla 1 mola),
![]()
(1 cząst.), 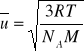
; u~T 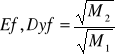
Efuzja: opisuje przejście gazu do pustego naczynia; współczynnik efuzji (gazu 1/gazu 2)
Dyfuzja: opisuje stopień mieszania się gazów; odległość przebyta (gaz 1/gaz 2)
Równanie Van der Waalsa: [Pobs+a(n/V)2].(V-nb)=nRT
Rozbieżności między równaniem VdW(równanie empiryczne) i równaniem gazu doskonałego są zauważalne dla wysokich temperatur i wysokich ciśnień.
Model gazu doskonałego działa dla: wysokich ciśnień, wysokich temperatur, małe cząsteczki, niepolarne, bez momentu dipolowego.
Równanie wirialne (równanie ogólne)- dla każdego gazu w każdych warunkach
![]()
K1- nie zależy od rodzaju gazu, K1=K1(n,T)=nK(T), K1=nRT (dla 1 mola)
Inne równania: Bertholeta: (p+an2/TV2)(V-nb)=nRT Dietericiego: p(V-nb)=nRTexp(-na/RTV)
Chemia atmosfery: skład powietrza N-78,06%, O-20,98%, Ar-0,93%, inne 0,03%
Zanieczyszczenia powietrza:CO, CO2, NOx, VOCs- węglowodory lotne, PAHs- policykliczne
Zły ozon: N2+O2->2NO+O2->2NO+O2 O2+O2->O3 2NO+O2->2NO2 3O2->2O3
Smog: 3O2->2O3 O*+H2O->2OH* OH*+NO2->HNO3 OH*+CHx->CHyOz
Kwaśne deszcze: powodowane przez: CO2, NO2, SO2 +O2 +H2O => Kwasy (mokra depozycja)
Dobry ozon (stratosfera):O3-hv->O2+O.rodnik O.+O3->2O2 O3+X->O2+XO. XO.+O.->O2
Źródła rodników: freony (CFC), N2O, H2O
TERMOCHEMIA
Energia- zdolność do wykonywania pracy lub produkowania ciepła
Praca objętościowa- W=F.∆h, ![]()
, ![]()
, W=-pS∆h=-p∆V (- przy ciśnieniu dotyczy sprężania)
Temperatura- przypadkowe ruchy cząstek - energia kinetyczna cząstek
Ciepło- przekazywanie energii pomiędzy ciałami, spowodowane różnicą temperatur pomiędzy nimi, przekazywanie pędu spowodowane uderzeniami cząsteczek
Podczas reakcji zmienia się energia potencjalna wiązań
Energia aktywacji- energia, którą muszą mieć cząsteczki substratów, żeby możliwe było przegrupowanie atomów i przebudowa struktury wiązań (katalizator obniża Eaktywacji)
Entalpia reakcji odwrotnej jest taka sama jak reakcji pierwotnej, następuje tylko zmiana znaku na przeciwny.
Reakcja ENDO- dodatnia ∆H; wzrost Ep; Reakcja EGZO- ujemna ∆H; spadek Ep elektronów
Gaz syntezowy - H2O i CO2,
Układ - coś, na czym skupiamy uwagę, Faza - wyodrębniony składnik rzeczywistości
Układy: Otwarty(wymienia masę), Zamknięty(nie wymienia masy z otoczeniem), Izolowany(nie wymienia E)
Prawo Zachowania Energii - suma energii układu jest stała Energia wewnętrzna- suma wszystkich energii
I Zasada Termodynamiki: energia wewnętrzna układu izolowanego jest stała
Funkcje stanu - zależą od stanu układu, nie zależą od etapów pośrednich reakcji (tylko od stanu początkowego i końcowego), H,U
Entalpia(suma energii, opisuje przemiany energetyczne układu dla p=const) H=U+pV, ∆H=Qp
Energia wewnętrzna opisuje przemiany energetyczne układu dla V=const Qv=∆U
Pojemność cieplna- (ciepło pobrane)/(zmiana temperatury) (J/K)
Ciepło właściwe- pojemność cieplna na gram substancji (J/K.g) ![]()
Molowe ciepło właściwe - pojemność cieplna na mol substancji (J/K.mol)
![]()
![]()
![]()
![]()
![]()
Kalorymetria - pomiar ciepła metodą bilansu cieplnego; rejestracja zmiany temperatury
Obliczenia ciepła z Energii wiązań: ![]()
Temperatura rośnie => reakcja egzotermiczna => ∆H=-Q substraty -> produkty+ ∆Hreakcji
Stan standardowy (warunki st)- 1013hPa, 25oC tworzenie wiązań -Q, rozrywanie wiązań +Q
Prawo Hessa ![]()
TERMODYNAMIKA
Entropia - miara nieuporządkowania
II zasada termodynamiki - Proces zachodzi samorzutnie, jeżeli wzrasta entropia
Możliwe są przemiany jedynie, jeżeli występują zmiany temperatury
Entropia - S, S=k.lnW, k-stała Boltzmanna, W - prawdopodobieństwo termodynamiczne
Zmiana entropii: ![]()
Wyszukiwarka