UNIWERSYTET WARMIŃSKO- MAZURSKI
W OLSZTYNIE
WYDZIAŁ NAUK TECHNICZNYCH
BUDOWNICTWO
Sprawozdanie z ćwiczeń laboratoryjnych z przedmiotu „Materiały budowlane”
TEMAT: Badanie korozji zapraw i betonów.
Monika Majewska
II rok Budownictwo
Gr. 1
2007/2008
Olsztyn, październik 2007
Celem ćwiczenia jest poznanie zagadnień korozji kwasowej i węglanowej zapraw i betonów. Uwzględniany będzie wpływ kwasowości środowiska wodnego oraz agresywnego CO2 na trwałości zapraw cementowych. Aby zmiany te pod wpływem wymienionych czynników były widoczne w krótkim czasie stężenia roztworów kwasów są duże: 2%, 4%, 6%.
1. Badanie wpływu roztworów kwasu solnego i octowego o różnych stężeniach na próby zapraw.
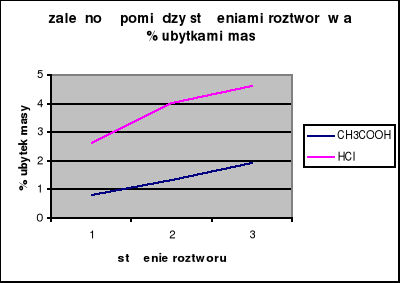
1.a. Przeznaczone do badania 3 próbki zapraw cementowych należy wyjąć z wody, osuszyć ścierką i zważyć z dokładnością do 0,01 g. Poszczególne próbki należy włożyć do zlewek zawierających po 150 cm3 2%, 4%, 6% roztworu HCl. Próby zapraw powinny być całkowicie zanurzone w roztworach kwasu. Po upływie 45 minut próbki należy wyjąć z roztworów, spłukać dokładnie wodą, usunąć luźno związane ziarna kruszywa i ponownie zważyć.
Wyniki badania:
Nr zlewki |
Stężenie roztworu HCl |
Masa próby przed zanurzeniem w HCl |
Masa próby po zanurzeniu |
Ubytek masy |
Ubytek masy |
- |
[%] |
[g] |
- |
[g] |
[%] |
1 |
2 |
147,10 |
143,24 |
3,86 |
2,62 |
2 |
4 |
140,19 |
134,57 |
5,62 |
4,01 |
3 |
6 |
139,89 |
133,43 |
6,46 |
4,62 |
1.b. Identyczne badania należy wykonać dla 3 próbek zapraw, które zanurzamy w 2%, 4%, 6% roztworze kwasu octowego CH3COOH.
Nr zlewki |
Stężenie roztworu CH3COOH |
Masa próby przed zanurzeniem w CH3COOH |
Masa próby po zanurzeniu |
Ubytek masy |
Ubytek masy |
- |
[%] |
[g] |
- |
[g] |
[%] |
1 |
2 |
146,39 |
145,35 |
1,04 |
0,71 |
2 |
4 |
144,82 |
142,91 |
1,91 |
1,32 |
3 |
6 |
145,94 |
143,15 |
2,79 |
1,91 |
2. Badanie wpływu CO2 na Ca(OH)2 zawarty w zaprawach i betonach.
Oznaczenie wykonuje się w układzie modelowym w aparacie przedstawionym na rysunku.
W wykraplaczu A znajduje się roztwór kwasu solnego, który wprowadza się do naczynia B otwierając kran k. W naczyniu B znajduje się grys wapienny, który reaguje z kwasem wg równania:
CaCO3 + 2HCl —› CaCl2 + CO2Î +H2O
W wyniku tej reakcji powstaje CO2 i przedostaje się rurką do probówki C. W probówce C znajduje się roztwór nasyconego wodorotlenku wapniowego. Otwierając kranik k należy rozpocząć wkraplanie kwasy solnego do naczynia B i obserwować zmiany zachodzące pod wpływem CO2 w probówce C.
1 reakcja Ca(OH)2 + CO2 + nH2O —› CaCO3 + (n+1)H2O
Jest to reakcja pozytywna, bo wytrąca się węglan wapnia, czyli mamy wiązanie wapna. Dalsze działanie CO2 jest szkodliwe.
2 reakcja CaCO3 + CO2 + H2O —› Ca(HCO3)2
Powstaje kwaśny węglan wapnia, reakcja jest negatywna, bo jest to związek rozpuszczalny- KOROZJA.
3. Wnioski.
Szybkość korozji kwasowej zależy od rodzaju oddziałującego kwasu oraz jego stężenia- im silniejszy i większe stężenie tym korozja przebiega szybciej. Przy korozji spowodowanej CO2 pierwsza reakcja jest pozytywna- zauważalne zmętnienie roztworu, jednak po dłuższym oddziaływaniu w środowisku wilgotnym następuje korozja, która widoczna była jako sklarowanie się zasadowego roztworu i powstanie rozpuszczalnego kwaśnego węglanu wapnia.
Wyszukiwarka