Prawa chemiczne
Prawo AVOGADRO
1 mol dowolnej subst gazowej w tych samych warunkach zajmuje tą samą obj
Prawo zachowania mas
masa substratów = m. Produktów
p. stosunków obj
Obj substancji gazowych biorących udział w reakcji chem mają się do siebie jak niewielkie liczby naturalne.
p. stałości składu
W związkach chem na daną liczbę atomów danego pierwiastka przypada stała liczba atomów 2. pierw.
Stała dysocjacji - stała równowagi reakcji dysocjacji - rozpadu zw chem na poszczególne jony pod wpływem rozpuszczalnika.
Stopień dysocjacji - stosunek liczby moli cząsteczek danego zw chemicznego które uległy rozpadowi do łącznej liczby cząsteczek tego jonu
pH - ujemny logarytm dziesiętny aktywności jonów hydroniowych wyr w molach na dm3
iloczyn jonowy wody - iloczyn ze stężeń gramojonowych [H+] i [OH-]. Dla wody wynosi 10-14.
Reakcja zobojętnienia (neutralizacji) - reakcja chemiczna między kwasem a zasadą, która prowadzi do zmiany pH środowiska reakcji w kierunku bardziej obojętnego odczynu. W jej wyniku powstaje solą i często, choć nie zawsze, woda.
NaOH + HCl → NaCl + H2O
Hydroliza
Sole mocnych kwasów i mocnych zasad nie ulegają hydrolizie, do takich soli należy NaCl, natomiast sole słabych zasad i mocnych kwasów jej ulegają i mają odczyn kwasny, tu należy NH4Cl; sole mocnych zasad i słabych kwasów mają odczyn zasadowy, tu należy CH3COONa, natomiast sole słabych kwasów i słabych zasad hydrolizie ulegają, ale mają odczyn ~obojętny, do takich należy CH3COONH4
Al(NO3)3+3H2O->Al(OH)3+3HNO3
Al3+ + H2O->Al(OH)3 + 3H+
Sól słabej zasady i mocnego kwasu
K2SO4-sól mocnej zasady i mocnego kwasu->hydroliza ni zachodzi
(NH4)2CO3+H2O->2NH4OH+CO2+H2O
Sól słabego kwasu i słabej zasady.
Szereg elektrochem metali
Metale o ujemnych potencjałach normalnych mogą wypierać wodór. Nazywane są aktywnymi.
Metale o dodatnich potencjałach normalnych nie wypierają wodoru z kwasów. Nazywane są szlachetnymi.
Im bardziej ujemny pot metalu tym większa jego zdolność do ulegania reakcji utleniania.
Im bardziej dodatni potencjał normalny metalu tym większa jego zdolność do redukcji.
Korozja - proces niszczenia metali i ich stopów. Są spowodowane czynnikami reakcji z otoczeniem. Rodzaje:
-atmosferyczna
-gazowa
-wodna
-ziemna
Zapobieganie:
-dobów odpowiedniego metalu lub tworzywa odpornego na czynniki korozyjne
-dobór dodatkowych stopów metali
-dobór kształtu konstrukcji
-odizolowanie korodującego metalu od czynnika korodującego przez: powlekanie innym metalem w kąpieli, powlekanie na drodze galwanicznej, zmianę warstw metalu na drodze chemicznej, pokrycie olejem, lakierem, gumą, plastikiem, substancjami chemicznymi lub betonem.
Cząstki elementarne
PROTONY - cząstki elementarne o masie ok 1u [1,6725*10-27kg] i ładunku +
NEUTRONY - cząstki elementarne o masie ok 1u, elektrycznie obojętne.
NUKLEONY - protony + neutrony
ELEKTRONY - najmniejsze cząstki elementarne o masie ok 1/1840 u i ładunku ujemnym. Masa tak mała, że często pomijane.
Liczby kwantowe
GŁÓWNA - [n] jest miarą energii całkowitej w danym stanie. Przybiera wart liczb całkowitych.
POBOCZNA - [l - orbitalna] Określona gł liczbą kwantową. Miernik pędu elektronów. Charakteryzuje bliżej konfigurację orbitalu elektronowego. Przybiera wart n-1
MAGNETYCZNA - [m] opisuje zachowanie elektronu w polu magnetycznym. Zmiana stanu przez skręcenie płaszczyzny orbitalu pod wpływem pola mag. Określa liczbę orbitali w atomie.
SPINOWA - [s] określa różnice energetyczne pomiędzy elektronami o tych samych pierwszych trzech liczbach kwantowych.
Budowa atomu a położenie w ukł okresowym
Nr grupy - wartościowość czyli liczba elektronów walencyjnych.
Nr okresu - liczba powłok elektronowych w atomie danego pierwiastka.
Liczba atomowa - il protonów w jądrze - jednocześnie liczba elektronów.
Zakaz Pauliego
Głosi, że w danym stanie kwantowym może znajdować się jeden fermion - albo inaczej, że żadne dwa fermiony nie mogą w jednej chwili występować w dokładnie tym samym stanie kwantowym.
Elektroujemność
Zdolność przyciągania wspólnych elektronów podczas tworzenia wiązania chemicznego.
Pauling stworzył skalę elektroujemnośći. Wart liczbowe określają w przybliżeniu względną zdolność atomu do przechodzenia w stan ujemny podczas tworzenia wiązania.
Wart elektroujemn:
-pozwala przewidywać w zw chemicznych które wiązania są jonowe w które kowalencyjne
-pozwala na przewidywanie biegunów wiązań kow spolaryzowanych.
Rodzaje wiązań
Atomowe: zwykłe, spolaryzowane, koordynacyjne
Jonowe
Wiązania międzycząsteczkowe: wodorowe, siły Van Der Valsa.
Wiązanie kowalencyjne niespolaryzowane
Wiązania kowalencyjne niespolaryzowane występują między dwoma atomami tego samego pierwiastka w cząsteczkach, które nie zawierają oprócz tego innych atomów. Tego rodzaju wiązania nie są spolaryzowane. Wiązania takie nazywa się czasami "atomowymi".
Wiązanie kowalencyjne spolaryzowane
Wiązanie kowalencyjne powstaje między dwoma atomami niemetali, których wzajemna różnica elektroujemności jest mniejsza od 1,7 w skali Paulinga.
Wiązanie koordynacyjne to rodzaj kowalencyjnego wiązania chemicznego. Istotą tego wiązania jest uwspólnienie pary elektronowej między dwoma atomami, przy czym oba te elektrony formalnie pochodzą od jednego atomu.
Wiązanie koordynacyjne jest zazwyczaj klasyfikowane jako podtyp wiązania kowalencyjnego. Różnica między wiązaniem kowalencyjnym a koordynacyjnym polega głównie na źródle współdzielonych elektronów, jest więc głównie formalna. Zarówno energia wiązań koordynacyjnych, jak i inne jego cechy często nie odbiegają od zwykłych wiązań kowalencyjnych, w których współdzielone elektrony należą od obu atomów.
Wiązanie jonowe
Wiązanie jonowe powstaje między dwoma atomami, których wzajemna różnica elektroujemności jest bardzo duża (Δeu≥1,7). Elektrony zamiast się uwspólnić "przeskakują" na stałe do jednego z atomów. W wyniku tego jeden z atomów ma nadmiar ładunku ujemnego i staje się ujemnie naładowanym jonem (anionem) a drugi ma nadmiar ładunku dodatniego i staje się kationem. Oba atomy tworzą parę jonową (+)(-), która trzyma się razem na zasadzie przyciągania ładunków elektrostatycznych i może w sprzyjających warunkach ulegać dysocjacji elektrolitycznej.
WIĄZANIE WODOROWE - jest to oddziaływanie (zwykle słabe) między kowalencyjnie związanym atomem wodoru i należącym do innej cząsteczki atomem silnie elektroujemnym, dysponującym wolną parą elektronową.
Atom wodoru (proton) może byś związany równocześnie z dwoma atomami, jeśli mają one małe wymiary i dużą elektroujemność. Wiązanie wodorowe występuje najczęściej w związkach wodoru z fluorem, chlorem, tlenem, azotem.
Wiązanie wodorowe występuje np.: między cząsteczkami wody.
WIĄZANIE METALICZNE - powstanie wiązania metalicznego polega na przekształceniu atomów tego samego metalu lub atomów różnych metali w zbiór kationów i swobodnie poruszających się między nimi elektronów.
Wiązanie metaliczne może istnieć w stanie stałym lub ciekłym.
Sily van der Waalsa- sa wynikiem wzajemnego oddzialywania elektronow i jader w czasteczkach. Powstaja szybkozmienne dipole ktore wzajemnie przyciagaja sie zwiekszajac w miare zblizania sie wzajemna polaryzacje elektronowa. Wzrost sil van der Waalsa powoduje wzrost temp. wrzenia substancji. Sily van der Waalsa maja charakter uniwersalny i odnosza sie do wszystkich czasteczek niezaleznie od ich ksztaltu i wielkosci!
Wiązania „SIGMA”
powstają w wyniku poszerzania orbitali przechodzących wzdłuż prostej przechodzącej przez środki atomu, prosta ta staje się wówczas osią symetrii orbitalu cząsteczkowego, może to nastąpić w przypadku przenikania się orbitali różych rodzajów, zarówno prostych jak i shybrydyzowanych.
„PI” - słabsze niż sigma, jest mniej korzystne energetycznie i występuje tylko wtedy gdy ze względu na przestrzenną orientację nie jest możliwe utworzenie wiązania sigma.
Hybrydyzacja - w chemii kwantowej to matematyczne przekształcenie funkcji orbitalnych, polegające na "skrzyżowaniu" dwóch lub więcej orbitali atomowych, na skutek czego powstają nowe orbitale, posiadające inny kształt i energię. W istocie hybrydyzacja jest operacją matematyczną ułatwiającą skonstruowanie teorii orbitali walencyjnych, a nie rzeczywistym zjawiskiem fizycznym.
SP

SP2
SP3
Izotop - atom tego samego pierwiastka o takiej samej liczbie atomowej a różnej liczbie masowej (różnej liczbie neutronów w jądrze). Zajmuje to samo miejsce w ukł okresowym.
Np. izotop węgla
126C - 6 pr., 6 el.,6 neutr.
146C - 6 pr., 6 ele., 8 neutr.
Alotropia - zjawisko występowania różnych odmian krystalograficznych tego samego pierwiastka chemicznego.
fosfor występujący w formie fosforu czerwonego, białego, fioletowego i czarnego
siarka występująca w formie romboidalnej, jednoskośnej i polimerycznej.
żelazo o sieci regularnej przestrzennie centrowanej (α i δ) oraz regularnej ściennie centrowanej (γ).
Węglowodory
Podział:
nasycone - alkany, między atomami węgla tylko wiązania pojedyncze. Wzór ogólny CnH2n+2
A. Ulegają reakcji spalania, która może przebiegać na trzy sposoby:
Spalanie całkowite, którego produktami są para wodna i dwutlenek węgla CH4+2O2→CO2+2H2O
Półspalanie, którego produktami są tlenek węgla i para wodna: CH4+1,5O2→CO + 2H2O
Spalanie niecałkowite, prowadzące do węgla i pary wodnej: CH4+O2→C+2H2O,wydzielająca się sadza powoduje, ten typ spalania określa się również jako spalanie kopcącym płomieniem
Dla spalania alkanów na powietrzu typowe są dwa pierwsze sposoby spalania
B. Reagują z fluorowcami według schematu reakcji podstawiania czyli inaczej substytucji dając fluorowcopochodne oraz odpowiednie fluorowcowodory. Reakcja taka biegnie stopniowo podstawiając każdy z atomów wodoru:
CH4 + Cl2→CH3Cl + HCl - powstały produkt to chlorometan lub inaczej chlorek metylu
CH3Cl + Cl2→ CH2Cl2 + HCl - nazwa pochodnej to chlorek metylenu lub dichlorometan
CH2Cl2 + Cl2→ CHCl3 + HCl - trichlorometan, chlorek metylidenu, nazwa zwyczajowa chloroform
CHCl3 + Cl2→CCl4+HCl - tetrachlorometan lub zwyczajowo tetra
Reakcja substytucji jest typowa dla alkanów, charakterystyczne jest równoległe utworzenie silnego kwasu (!)
C. Nie dają charakterystycznych reakcji odbarwiania wody bromowej i zakwaszonego roztworu manganianu(VII) potasu
Nienasycone
Alkeny - CnH2n
Zacznijmy od spalania, podobnie jak alkany w zależności od ilości dostarczanego tlenu może ulegać spalaniu całkowitemu i niecałkowitemu nie wykazuje zdolności do półspalania. Jeżeli spalanie następuje na powietrzu to spala się kopcącym płomieniem i ten typ spalania uważa się za typowy dla alkenów.
Reakcje z fluorowcami Reaguje bardzo łatwo, fluorowiec atakuje podwójne wiązanie, powoduje jego pęknięcie i do uwolnionych w ten sposób wiązań przyłączają się atomy fluorowca. Ten typ reakcji z fluorowcami, addycji. CH2=CH2+Cl2→CH2Cl-CH2Cl
Oddzielnego omówienia wymaga reakcja addycji, w której uczestniczą cząsteczki asymetryczne np. chlorowodór lub woda. Chcąc określić miejsce podstawienia atomów stosuje się wówczas regułę Markownikowa zgodnie z którą wodór zostaje podstawiony do atomu węgla, przy którym jest więcej atomów wodoru. Przykładowo reakcja propenu z chlorowodorem będzie miała przebieg:
CH3-CH=CH2+HCl→CH3-CHCl-CH3 powstaje 2-chloropropan
Łatwość reagowania z fluorowcami powoduje, że alkeny mają zdolność odbarwiania wody bromowej zgodnie z równaniem reakcji: CH2=CH2+Br2→CH2Br-CH2Br
Etylen odbarwia również zakwaszony roztwór manganianu(VII) potasu
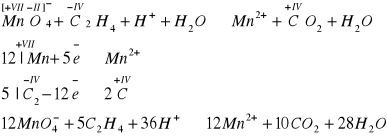
Reakcja polimeryzacji - alkeny ulegają polimeryzacji, to znaczy małe cząsteczki tzw. monomery, w wyniku pękania wiązań pi stają się dwuwartościowymi rodnikami, które łącząc się z sobą tworzą duże cząsteczki, zwane polimerami. Fazy polimeryzacji można prześledzić na przykładzie etylenu, kiedy to powstaje bardzo popularne tworzywo polimeryzacyjne - polietylen:
Etap I - pękanie wiązania pi ![]()
Etap II - tworzenia polimeru n [-CH2-CH2-]![]()
→ [-CH2-CH2-]n
Alkiny - CnH2n-2
Obecność wiązania potrójnego w cząsteczkach alkinów powoduje, że alkiny są związkami jeszcze bardziej reaktywnymi, niż alkeny. Łatwo ulegają reakcjom:
addycji - przyłączania,
spalania
polimeryzacji.
Przyłączanie wodoru do acetylenu:
C2H2 + H2 --> CH2 = CH2
W pierwszej fazie reakcji powstaje eten, który również przyłącza wodór. Jeśli zatem wodoru będzie wystarczająco dużo reakcja zajdzie dalej:
CH2 = CH2 + H2 --> CH3 - CH3
Ostatecznym produktem reakcji będzie etan - węglowodór nasycony, który nie ulega addycji.
Najprostszym przedstawicielem alkinów jest etyn - acetylen C2H2.
Jest to bezbarwny gaz, palny - spala się jasnym, świecącym płomieniem. Kopcący płomień wskazuje, że spalanie jest niecałkowite.
Ulega reakcji addycji z fluorowcami, H2, HCl ( HF, HBr, HI)np.:
C2H2 + HCl --> CH2 = CH2Cl
Acetylen C2H2 na skalę przemysłową otrzymuje się w reakcji hydrolizy węgliku wapnia (karbidu):
CaC2 + 2 H2O --> C2H2 + Ca(OH)2
Acentylen powstaje również w wyniku syntezy z pierwiastków (reakcja silnie egzotermiczna)
2C + H2 --> C2H2
Rozkładu (piroliza) metanu (w temperaturze ok. 1500oC)
2CH4 --> C2H2 + 3H2
Podstawowe reguły nazewnictwa węglowodorów:
Za podstawę nazwy związku przyjmuje się najdłuższy łańcuch węglowy.
Jeśli kilka łańcuchów ma tę samą długość, za podstawę nazwy przyjmujemy ten, który ma największą liczbę podstawników.
Łańcuch główny numerujemy w ten sposób, aby podstawniki znajdowały się przy atomach węgla o numerach możliwie jak najniższych.
Podstawnikiem mogą być grupy alkilowe, fluorowce, grupa wodorotlenowa, a więc wszystko co zastępuje wodór w łańcuchu głównym.
Podstawniki wymieniamy przed podstawą nazwy w kolejności alfabetycznej.
Przed nazwą podstawnika należy napisać numer atomu węgla przy, którym występuje.
Jeżeli jest kilka jednakowych podstawników, w nazwie związku wypisujemy je tylko raz dodając przed nimi numery atomów przy których się znajdują oraz liczebnik określający ich ilość: di, tri, tetra, penta, heksa.
Jeżeli w związku występuje wiązanie wielokrotne, podajemy numer atomu węgla, przy którym ono się znajduje, przed końcówką nazwy łańcucha głównego - numerujemy tak atomy węgla w łańcuchu, aby wiązanie miało jak najniższe lokanty.
Grupy funkcyjne:
1) fluorowiec -X (X=F, Cl, Br, I)
2) grupa hydroksylowa -OH
3) grupa eterowa -C-O-C-
4) grupa aldehydowa -CHO-
5) grupa ketonowa -CO-
6) grupa karboksylowa -COOH
7) grupa estrowa -CO-O-
8) grupa tiolowa -SH
9) grupa sulfonowa -SO3H
10) grupa sulfinowa -SOOH
11) grupa azowa -N=N-
12) grupa nitrowa -NO2
13) grupa nitrozowa -NO
14) grupa nitrylowa -CN
15) grupa aminowa -NH2.
Benzen (C6H6) to najprostszy związek organiczny z grupy węglowodorów aromatycznych.
[szerokie opracowanie w pliku pdf]
Wyszukiwarka